Слайд 2
Наш небольшой курс начнем с краткого рассмотрения исследований
по систематизации минералогических знаний, проводившихся во времена, о которых
мы говорим: «До нашей эры».
Минералогия очень древняя наука, хотя своё название она получила значительно позднее. По мере вовлечения различных минералов в сферу жизнедеятельности человека, по мере знакомства его с простейшими физическими и химическими свойствами разных минералов, необходимых для их практического использования, возникает потребность в систематизации имеющихся знаний о минералах. Таким образом, к началу нашей эры человечество обладало многочисленными конкретными знаниями, в том числе и по свойствам минералов, их диагностике, методам поиска и переработки. Это потребовало их систематизации.
Слайд 3
Около 2300 лет назад появилась, вероятно, первая сводка
по минералогии – «Трактат о камнях». Автор – ученик
Аристотеля Тиртамоса (327-287 гг до н.э.) Теофраст. В нём автор дает описание 16 минералов, подразделяя их на 3 группы: 1) металлы, 2) камни, 3) земли. К металлам из-за их блеска причислялись и сульфиды.
В начале нашей эры появились более обширные исследования в области химии и минералогии. Персидский ученый Абу Бакр Мухаммед бен Закария Ар-Рази ( 865-925 гг.) в «Книге тайны тайн» классифицировал все известные вещества, разделив их на три больших класса: 1) землистые (минеральные), 2) растительные, 3) животные.
Слайд 4
Минеральные вещества он делит на шесть групп: 1)

«духи» (спирты, летучие вещества), относя к этой группе ртуть,
нашатырь, аурипегмент, реальгар и серу; 2) «тела» (т.е. металлы), всего их семь: золото, серебро, медь, железо, олово, свинец, и «харасин» (предположительно это цинк); 3) «камни», их тринадцать: марказит, марганцевая руда, бурый железняк, галмей (цинковая руда, возможно, смитсонит), ляпис-лазурь, малахит, бирюза, красный железняк, белый мышьяк, сернистый свинец и сернистая сурьма, слюда, гипс и стекло; 4) «купоросы», их шесть: черный купорос, квасцы, белый купорос (вероятно, цинковый), зеленый купорос, желтый (Fe2[SO4]3), красный (веротно, также сульфат железа); 5) «бораки», их также шесть: хлебная бура (поташ ?), натрон (сода) бура ювелиров, «тинкар» (род мыла, применявшегося при пайке металлов), зараванская бура, арабская бура; 6) «соли», их 11 видов: хорошая соль (обычная), горькая (мирабилит или английская ?), каменная, белая, нефтяная, индийская, китайская, поташ, соль мочи, известь и соль золы.
Кроме этих основных групп Ар-Рази выделяет группу производственных веществ, среди которых выделяет «тела» и «не тела» (т.е. металлы и неметаллы). К производственным веществам – металлам он относит сплавы: латунь, бронзу, сплав из семи металлов, сплав меди со свинцом (свинцовая бронза) и «муфраг» - сплав свинца и олова . Неметаллы: ярь-медянка, крокус, свинцовый глет, сурик, свинцовые белила, окись меди и др.
Слайд 5
Все эти многочисленные перечисления я даю для того,
чтобы сложилось впечатление о том, как воспринималась химия и
минералогия в то время. Хочется остановиться еще на двух систематиках того времени.
Абу-Али ибн- Сина (Авиценна) (980-1037 гг.) в «Книге исцеления» подразделил твердые природные тела на : 1) камни и земли, 2) серные (горючие) вещества, 3) металлы (плавкие тела), 4) соли (растворимые в воде вещества). Таким образом, он отделил сульфиды от металлов и объединил три класса Ар-Рази – купоросы, бораки и соли в один класс солей.
Слайд 6
В те же времена в Европе появляются многочисленные
книги о камнях (лапидарии). Наиболее обширный лапидарий венецианского физика
Камилла Леонарда, опубликованный в 1502 году под названием «Зеркало камней», содержал описание 279 минералов и минеральных веществ в алфавитном порядке. Прошу обратить внимание на этот труд. Уже тогда появилось желание быстро ориентироваться в многочисленных названиях минералов.
Абу-Рейхан-Мухаммед ибн Ахмед аль-Бируни (972-1048 гг.) в «Книге сводок для познания драгоценностей» описывает 48 камней. Относя к ним: жемчуг, стекло, эмаль, фарфор, некоторые сплавы. Расположил он их в зависимости от твёрдости, используя для её определения шкалу, состоящую из: 1) алмаза, 2) корунда, 3) агата.
Слайд 7
К началу XVI века значительно возросло количество известных
полезных ископаемых, в связи с чем возникла необходимость их
определения и детального изучения. Определился предмет науки – руда («минера»). Впервые слово «минералогия» было применено в науке об ископаемых в 1636 году итальянским ученым Бернардом Цезием из Модены.
Георг Бауэр, живший в средние века и известный под именем Агриколы, (1494-1555 гг.) все ископаемые тела делил на: 1) гомогенные, 2) гетерогенные смеси минералов, т.е. горные породы. Гомогенные он делил на: а) земли, б) соли, в) драгоценные камни, г) металлы, д) прочие. Г. Агрикола, характеризуя минералы, описывает их форму, твердость, относительный вес (плотность), цвет, блеск, вкус, запах.
Слайд 8
Торберн Улаф Бергман (1735-1784 гг), заведующий
кафедрой химии и минералогии Упсальского университета в Швеции разработал
химическую систематику минералов.
Систематика Авраама Готлиба Вернера (1749-1817 гг.) построена только на внешних признаках. Она не учитывала химического состава. А. Г. Вернер положил начало новому направлению в минералогии — описательной минералогии.
В 1747 г. Ю. Валлериус (Johan Gottschalk Wallerius, 1709-1785 гг.), профессор минералогии Упсальского университета в Швеции использовал систематику минералов, близкую к систематике К.Линнея.
В 1730 г. Магнус фон Бромель разделил минералы на восемь классов: 1) земли, 2) соли, 3) серы, 4) камни, 5) окаменелости, 6) медицинские камни, 7) полуметаллы, 8) металлы.
В 1739 г. Крамер выделил в минералах семь классов: 1) металлы, 2) полуметаллы, 3) соли, 4) горючие вещества, 5) камни, 6) земли, 7) воды.
Слайд 9
Поэтому, например, в отряд калиевой селитры попали: селитра,
кварц, берилл, корунд; в род буры – топаз, турмалины
и гранаты; в род поваренной соли – флюорит, натриевая селитра.
В 1779 г. появилась на русском языке систематика минералов, разработанная Карлом фон Линнем – Карелусом Линнеусом (1707-1778 гг.), базировавшаяся, как и его систематика растительного и животного мира, на чёткой соподчиненности таксонов: класс, отряд, род, вид, вариация. Признаки, клавшиеся в основу этой систематики, оказались чисто формальными (форма, генезис).
Слайд 10
IV. Металлические тела. В каждом классе выделяются более
мелкие таксоны: отделение, род, вид, отличие, разность.
Далее класс
I. он делит на семь родов: 1. известковые, 2. стронциевые, 3. тяжелые, 4. тальковые, 5. глинистые, 6. цирконные и гиацинтовые, 7. кремнистые земли и камни, что отвечает соединениям Ca, Sr, Ba, Mg, Al, Zr, Si.
Последовательность таксонов, Карла фон Линнея отразилась на систематике минералов по химическим и физическим признакам, разработанной в конце XVIII века Василием Михайловичем Севергиным (1765—1826), который резко критиковал систематику А.Г. Вернера за то, что она не учитывала химического состава минералов. Все ископаемые тела В.М.Севергин делит первоначально, как это делал Авиценна на 4 класса: I. Земли и камни. II. Соли. III. Горючие тела.
Слайд 11
Род известковых земель включает 6 отделений: 1. известь

с воздушною кислотою соединённая (карбонаты кальция), 2. известь с
купоросною кислотою соединённая (сульфаты кальция), 3. известь с плавиковой кислотою соединённая (флюорит), 4. известь с борной кислотою соединённая (борацит), 5. известь с фосфорною кислотою соединённая (апатит и фосфорный известковый камень), 6. известь с прочими землями соединённая (вилуйский гиацинт-вилуит, «стекловатый шпат» - шпинель). Далее систематика сроится по физическим признакам, выделяются отличия (мрамор, зернистый известняк, известковый шпат, гороховый камень и др.) и разности (а. одноцветные мраморы: белый, черный и т.д. – всего 9 разностей, б. разноцветные мраморы – всего 11 разностей и т.п.). Иную систематику В.М.Севергин предложил для класса II. Солей. Первоначально он делился на 3 отделения: 1. кислые соли и кислоты, 2. щелочные соли, 3. средние соли. Отделение средних солей делилось на роды: род I углекислые средние соли (3 вида: 1. поташная, 2. минеральная и 3. летучая щелочная соль),род II купоросные средние соли (4 вида: 1. глауберова соль, 2. купоросный винный камень и т.д.), род III селитряные, род IV солёные, род V буровые средние соли.
Слайд 12
В XVII-XVIII веках появились геометрические систематики, например,
систематика швейцарского врача-натуралиста М.А. Капеллера (1685-1790 гг.), который выделял
минералы, кристаллизующиеся: 1) из водных растворов; 2) из растворов, содержащих взвешенные частицы посторонних тел (глин и т.п.); 3) путём упаривания жидкости; 4) в результате сублимации; 5) на поверхности растворов в соприкосновении с воздухом; 6) в движущейся жидкости.
Ренэ Жюст Гаюи (1743-1822 гг.), используя закон постоянства гранных углов, разработал оригинальную систематику, основанную, к сожалению, только на наружных признаках, которая тем не менее использовалась в течение нескольких десятилетий в монографиях по минералогии (например, первое издание «Системы минералогии» Д.Д. Дэна).
В 1819 году появилась классификация кристаллов по 7 сингониям, разработанная Христианом Самуилом Вейсом (1780-1856 гг.).
Слайд 13
в ряд между ними, распадающийся на три части:
электроотрицательные – O, S, N, F, Cl, P, Se,
As, Mo, Cr, W, B, C, Sb, Te, Ta, Si, Os; переходный элемент: H; электроположительные элементы: Au, Ir, Rh, Pt, Pd, Hg, Ag, Cu, Ni, Co, Bi, Zn, Zr, Pb, Ce, U, Fe, Cd, Zn, Mn, Al, Y, Be, Mg, Ca, Sr, Ba, K.
Эта теория объясняла причины образования химических соединений, являлась основой для создания учения об электроотрицательности элементов, получившего особенно большое развитие уже в наше время в работах
Л. Полинга, С.С. Бацанова. В.С. Урусова, А.А. Годовикова.
Необходимо сказать несколько слов о Йенсене Якобе Берцелиусе (1779-1848 гг.), который разработал номенклатуру химических элементов. Он считал, что все вещества состоят из положительно и отрицательно заряженных частиц, удерживаемых силой взаимного притяжения. Самый электроотрицательный элемент – кислород, самый положительный – калий. Остальные Й.Я. Берцелиус расположил
Слайд 14
Ученик Вернера Ф. Моос (1773—1839 гг.) в 1811
г. предложил общеизвестную десятибалльную шкалу твердости минералов, которой пользуются
все минералоги до настоящего времени, а в 1820 году опубликовал работу «Характеристика естественной минералогической систематики». Систематика была очень дробной и включала кроме видов подвиды, разновидности, подразновидности, выделение которых опиралось на косвенные признаки.
1852 год ознаменовался появлением «Кристаллохимической систематики минералов», опубликованной Густавом Розе (1798-1873 гг.), которая опиралась на разработки Й. Я. Берцелиуса.
Дмитрий Иванович Менделеев (1834-1907 гг.) профессор Петербургского университета в 1869 году открыл периодический закон, ознаменовавший новую эру в развитии химии, минералогии, физики.
Слайд 15
И вот, Джеймс Дуайт Дэна (1813-1895 гг.) –
минералог и геолог Йельского университета, США, автор книги «Система
минералогии» создал удачную химическую систематику минералов, в основу которой положен Периодический закон Д.И. Менделеева. Систематику Дж.Д.Дэна разрабатывал постепенно, и она достигла совершенства в 6 издании (1920 год). Все минералы были подразделены на 8 больших групп (типов).
I. Самородные элементы.
II. Сульфиды, селениды, теллуриды, арсениды, антимониды.
III. Сульфосоли – сульфоарсениды, сульфоантимониды,
сульфовисмутиды.
IV. Галогениды – хлориды, бромиды, иодиды; фториды.
V. Оксиды.
VI. Оксосоли: 1. карбонаты; 2. силикаты; 3.титанаты ;
4. фосфаты, арсенаты, ванадаты, антимонаты, нитраты ; 5.
бораты, уранаты ; 6. сульфаты, хроматы, теллураты ; 7.
вольфраматы, молибдаты. VII.Соли органических кислот:
оксалаты, меллаты и т.д.
VIII. Углеводороды.
Слайд 16
В основу объединения минералов в крупные таксоны Дж.
Д. Дэна клал тип аниона, учитывая сходство между элементами,
вытекающее из их положения в Периодической системе. Но есть и отступления. Так титанаты рассматриваются вслед за силикатами в одном с ними типе (автор переоценил сходство Si4+ и Ti4+), нитраты – вместе с фосфатами, арсенатами , антимонатами (N, P, As, Sb находятся в одной группе в Периодической системе, но свойства N как кайносимметрика существенно отличаются от свойств P, As, Sb), уранаты – вместе с боратами (причины этого объединения не понятны).
В основе объединения минералов в мелкие таксоны лежат свойства электроположительных элементов и в особенности соотношения между электроположительными и электроотрицательными элементами. В случае оксосолей в основе выделения таксонов лежат отношения между основаниями и ангидридами, а также принадлежность их к безводным, кислым, основным солям и кристаллогидратам.
Слайд 17
Владимир Иванович Вернадский (1863-1945 гг.) – академик Императорской
академии наук, заведующий минералогическим отделением геологического музея Академии наук
высоко ценил работы по систематике минералов, считал, что «установление естественной, правильной классификации связано с глубочайшим охватом химических и минералогических явлений» [Вернадский В.И. 1923. История минералов земной коры. Пг., НХТИ, вып. 1, 208 с.].
В.И. Вернадский принял точку зрения Й.Я. Берцелиуса на минералогию как на химию земной коры.
Слайд 18
Основные требования к систематике минералов, сформулированнные В.И. Вернадским:
1. В основу систематики должны быть положены химические свойства
веществ, элементов их образующих, сходство и различие в свойствах этих элементов и др. химические признаки. 2. Систематика должна учитывать генетические и парагенетические их особенности, что должно выражаться в объединении в отдельные, желательно максимально более крупные по числу минеральных видов, таксоны минералов, близких по генезису (парагенезису), отвечать пониманию физико-химических связей между таксонами, закономерностей перехода от одних из них к другим. 3. Структурные (геометрические), часто называемые кристаллохимическими, особенности минералов являются их вторичными ( следующего уровня после химических) признаками, поскольку они определяются химическим составом минералов, физико-химическими параметрами их образования. их безусловно необходимо учитывать в систематике, но лишь на более низком уровне её таксонов.
Слайд 19
Раздел III. Сульфиды, сульфосоли и им подобные соединения.
В
разделе III выделял 2 класса: В классе I –
16 групп, в классе II – 10.
Раздел IV. Галоидные соединения (галогениды).
I класс. Фториды.5 групп. II класс. Хлориды, бромиды, иодиды. 5 групп.
Раздел V. Окислы (оксиды).
I класс. Простые и сложные окислы, с 16 группами.
II класс. Гидроокислы и окислы, содержащие гидроксил, с 6 группами.
Раздел VI. Кислородные соли (оксисоли), в котором 10 классов.
I класс. Иодаты. II класс. Нитраты.
Анатолий Георгиевич Бетехтин (1897-1962 гг.) – автор «Минералогии», полнейшего издания-справочника по минералогии (1950 год), не превзойденного до сего времени. А.Г. Бетехтин выделял шесть разделов.
Раздел I. Самородные элементы и интерметаллические соединения.
В разделе I выделял 10 групп.
Раздел II. Карбиды, нитриды и фосфиды.
Слайд 20
III класс. Карбонаты.
Безводные карбонаты.
6 групп.
Водные карбонаты. 4 группы.
IV
класс. Сульфаты, селенаты, теллураты. 16 групп.
V класс. Хроматы
VI класс. Молибдаты и вольфраматы. 3 группы
VII класс. Фосфаты, арсенаты и ванадаты.
Безводные фосфаты, арсенаты и ванадаты.
А. Кислые безводные фосфаты, арсенаты и ванадаты.
Б. Нормальные безводные фосфаты, арсенаты и ванадаты. 2 гр.
В. Основные безводные фосфаты, арсенаты и ванадаты.9 групп.
Водные фосфаты, арсенаты и ванадаты.
А. Кислые водные фосфаты, арсенаты и ванадаты.
Б. Нормальные водные фосфаты, арсенаты и ванадаты. 5 групп.
В. Основные водные фосфаты, арсенаты и ванадаты. 7 групп.
Слайд 21
VIII класс. Арсениты.
IX класс. Бораты.
Безводные бораты.
А. Кислые безводные ортобораты.
Б. Нормальные безводные ортобораты.
В. Основные безводные бораты. 6 групп.
Водные бораты.
1. Водные метобораты.
2. Водные тетрабораты.
3. Водные пентабораты.
4. Водные гексабораты.
5. Прочие полибораты.
X класс. Силикаты.
Подкласс А. Силикаты с изолированными тетраэдрами SiO4 в
кристаллических структурах. 18 групп.
Подкласс Б. Силикаты с изолированными группами тетраэдров
SiO4 в кристаллических структурах.
Слайд 22
а. Силикаты с изолированными группами тетраэдров Si2O7
в
кристаллических структурах. 4 группы.
б. Силикаты с кольцевыми радикалами. 5 групп.
Подкласс В. Силикаты с непрерывными цепочками тетраэдров SiO4 в кристаллических структурах.
а. Силикаты с с одинарными анионными цепочками. 1 группа.
б. Силикаты с двойными анионными цепочками. 2 группы.
в. Силикаты с с более сложной цепочечной структурой. 2 гр.
Подкласс Г. Силикаты с непрерывными слоями тетраэдров SiO4 в кристаллических структурах. Выделяются 13 групп.
Подкласс Д. Силикаты с непрерывными трёхмерными каркасами из тетраэдров (Si,Al)O4 в кристаллических структурах.
Выделяются 7 групп: группа полевых шпатов с 3 подгруппами:
плагиоклазов, ортоклазов, гиалофанов; группа скаполита ; группа лейцита ; группа нефелина; группа содалита ; группа канкринита ; группа цеолитов с подгруппами шабазита, натролита – томсонита, гейландита и филлипсита.
Прочие цеолиты.
Прочие силикаты с анионами каркасного строения.
.
Слайд 23
Класс I. Самородные элементы. А. Металлы – 5
групп. Б. Полуметаллы и неметаллы – 4 группы. В.
Карбиды, нитриды, фосфиды.
Класс II. Сульфиды и сульфосоли.
А. Интерметаллические соединения.
Б. Сульфиды и их аналоги, среди которых: 1. металлические – 14 групп; 2. полуметаллические – 4 группы.
В. Сульфосоли – 10 групп.
Иван Николов Костов (1913 – 2004 гг.) – болгарский минералог и кристаллограф разработал систематику минералов, опирающуюся на химический состав минералов и парагенетические ряды отдельных элементов, в которой выделил 12 классов.
Слайд 24
Класс III. Галогениды. А. Фториды – 4 группы.
Б. Хлориды, бромиды, иодиды – 10 групп.
Класс IV. Окислы
и гидроокислы. А. Окислы и гидроокислы металлов – 21 группа. Б. Окислы полуметаллов и металлоидов – 4 группы.
Класс V. Силикаты. А. Силикаты – 27 изолированных тетраэдрических групп. Б. Цепочечные силикаты – 5 групп. В. Листовые силикаты – 9 групп. Г. Каркасные силикаты – 12 групп.
Класс VI. Бораты – 10 групп.
Класс VII. Фосфаты, арсенаты, ванадаты – 33 группы.
Класс VIII. Вольфраматы, молибдаты – 3 группы.
Класс IX. Сульфаты. А. Сульфаты – 21 группа. Б. Селенаты, селениты, теллураты, теллуриты – 2 группы.
Класс X. Хроматы.
Класс XI. Карбонаты – 13 группы.
Класс XII. Нитраты и иодаты. А. Нитраты. Б. Иодаты.
Слайд 25
Г.П. Барсанов считал, что в основе классификации минеральных
тел должны лежать:
1) тип химической связи в кристаллах;
2) качественный состав атомов, входящих в кристалл и связанных друг с другом через тот или иной тип химической связи;
3) как и чем окружены атомы (ионы) в кристаллической пространственной структуре, т.е. координация, тип упаковки,
мотив структуры.
Георгий Павлович Барсанов (1907 – 1991 гг.) – замечательный минералог и педагог, специалист в области истории минералогии, директор Минералогического музея им. А.Е. Ферсмана АН СССР (1952–1976), вице-президент Международной минералогической ассоциации (1960–1964), зав. кафедрой минералогии МГУ (1953–1986).
Слайд 26
Все минералы Г.П. Барсанов разделил по типу связи,

зависящей от атомного состава соединения, на 4 типа. Далее
в основу деления минеральных видов на классы внутри выделенных типов, по мнению автора, должен быть качественный состав анионов, строящих ту или иную структуру. Внутри классов выделяются таксоны в зависимости от наличия или отсутствия в структуре добавочных анионов (например F-1, Cl-1, (OH)-1 в узловом положении) к главному или комплексных анионов (например, [SO4]-2+[PO4]-3 или [SiO4]-4+[PO4]-3 и др.). Наконец, следующий по соподчинённости таксон выделяется по качественному составу катионов [1a].
Тип I. Атомные (частью ионные) решетки с металлическим или ковалентным типом связи.
Класс: свободные атомы элементов.
Подклассы. I. Структура типа Cu: группа меди – золота. II. – типа α – Fe: группа железа. III. – типа Оs: группа осмия – рутения. IV – типа Sb: группа сурьмы – мышьяка. V – типа Te: группа теллура. VI – типа графита (слоистые): группа графита. VII – типа алмаза: группа алмаза. VIII – молекулярная структура: группа серы.
Класс: интерметаллические соединения. 3 группы: амальгамы; домейкита; дискразита, мальдонита, хедлейита.
Слайд 27
Тип II. Ионные решетки с ковалентным ( реже

ионным ) типом связи.
Класс: сернистые соединения.
Сульфиды простые. Подклассы. I.
Структура типа куприта. II. – антифлюоритового типа: группа дигенита. III. – типа NaCl. IV – типа NaCl деформированная: группа герценбергита, киновари. V – типа никелина: группа миллерита, пирротина. VI – типа сфалерита: группа сфалерита, вюртцита. VII – типа сфалерита сдвоенные: группа халькопирита. VIII – типа шпинели: группа линнеита. IX – ленточного типа: группа антимонита. X – слоистого типа: группа молибденита. XI – структуры слоистые с усложненными связями: группа ковеллина. XII – типа NaCl с группой S2-2: группа пирита – марказита. XIII – молекулярные структуры: группа реальгара.
С комплексными анионами. Подклассы. I. Структура типа сфалерита (простые и сдвоенные): группа германита, группа вольтцина. II. – типа блёклых руд: группа дигенита. III. – ленточного типа: группа сарторита и др. IV – слоистого типа: группа цилиндрита, киновари. V – с невыясненными структурами: группа айкинита, фрейеслебенита.
Класс: селениды.
Подклассы. I. Структура типа куприта. II. – антифлюоритового типа. III. – типа NaCl. IV – типа сфалерита. V – ленточного типа. VI – слоистого типа.
Класс: теллуриды.
Подклассы. I. Структура. антифлюоритового типа, II. – типа NaCl. III. –типа сфалерита. IV – ленточного типа. V –слоистого типа.
Слайд 28
Класс: арсениды.
Арсениды простые. Подклассы. I. Структура типа никелина.
II. – типа NaCl с группой As2-2: группа скуттерудита.
С
комплексными анионами. Подкласс. I. Структура типа NaCl с группой (As – S)-2: группа кобальтина – арсенопирита.
Класс: Антимониды.
Антимониды простые. Подкласс. I. Структура типа никелина.
С комплексными анионами. Подкласс. I. Структура типа NaCl с группой
[(Sb,As) – S]-2. II. –типа сфалерита (вюртцита).
Тип III.Типичные ионные решетки без комплексных анионных групп в структурах.
Класс: хлориды, бромиды, иодиды.
Подклассы. I. Структура типа NaCl: группа кераргирита. II – типа сфалерита: группа нантокита. III – с невыясненными структурами: группа каломели.
С ионными связями. Подклассы. I. Структура типа NaCl: группа галита. II – с невыясненными структурами: группа риннеита.
С кристаллизационной водой: группа карналлита.
Сложные с добавочными анионами (ОН)-1, О-2 и др.: группа кененита, группа добреита.
Класс: фториды.
Фториды простые.
Слайд 29
Подклассы. I. Структура типа NaCl: группа виллиомита. II

– типа флюорита: группа флюорита. III. – структура невыясненного
типа: группа иттрокальцита – флюоцерита.
Сложные безводные.
Подкласс. I. Структура невыясненного типа: группа криолита, группа ферручита.
С кристаллизационной водой и добавочными анионами.
Подкласс. I. Структура невыясненного типа: группа томсенолита, группа геарксутита – ральстонита, группа кридита.
Класс: окислы.
Окислы простые.
Подклассы. I. Структура типа куприта. II –типа NaCl. III – типа сфалерита. IV – типа RO с невыясненными структурами. V – типа шпинели с координацией (6). VI – типа рутила: группа рутила – ильменорутила, касситерита, группа пиролюзита. VII – типа флюорита: группа уранинита. VIII – молекулярные структуры: группа арсенолита – клаудетита.
Окислы водные. Подклассы. I. Структура слоистого типа: группа брусита, бёмита, лепидокрокита. II. – ленточного типа: группа диаспора.
Окислы водные с невыясненными структурами: группа псиломелана – тунгстита-кларкеита.
Коллоидные тела. Группа лимонита – варламовита.
Слайд 30
Окислы водные с добавочными анионами. Подкласс. I. Структура

слоистого типа: группа пироаурита – заратита.
Окислы сложные. Подклассы. I.
Структура островного типа: группа хризоберилла. II –типа шпинели: группа шпинелидов. III – типа перовскита, браунита. IV –с невыясненными структурами: группа коронадита – псевдобрукита. V – коллоидного типа: группа аллофана.
Тип IV. Ионные решетки с наличием в структуре комплексного аниона.
Класс: ниоботанталаты и ниоботанталотитанаты.
Кристаллические. Подклассы. I. Структура типа рутила: группа тапиолита, группа колумбита. II – с структурами типа АВХ4: группа стибиотанталита, группа симпсонита.
Метамиктные (коллоидоподобные). Подклассы. I. Структура типа АВ2Х6 : группа самарскита, группа ферсмита, группа виикита, (отчасти)группа эвксинита, группа эшинита. II –типа АВХ4: группа пирохлора, группа фергусонита.
Класс: силикаты.
С изолированными тетраэдрами [SiO4]-4.
Без добавочных анионов: группа оливина, монтичеллита, ларнита, виллемита, группа граната (алюмогранаты, ферригранаты, хромгранаты), группа циркона, группа эвлитина.
С добавочными анионами О-2, ОН-1, F-1, и другие: группа сфена – ферсманита, группа дистена, группа лампрофиллита, группа гуммита, группа плазолита, группа годжкинсонита.
Слайд 31
С добавочными анионами ОН-1, F-1: группа датолита -

эвклаза, группа топаза, группа велерита, группа ринкита, группа беккелита,
группа лессингита, группа силикатов урана.
Сложного состава с добавочными анионами: группа сапфирина, группа аксинита, группа сперрита.
Сложные силикаты c As, Sb, V и другие.
Со структурой смешанного типа: группа везувиана.
Со сдвоенными тетраэдрами [Si2O7]-6.
Без добавочных анионов: группа тортвейтита, группа церита, группа мелилита.
С добавочными анионами ОН-1, F-1, и другие: группа эпидота, группа ильваита, группа пренита, группа каламина, группа мелинофана, группа лавсонита, группа астрофиллита.
Кольцевого строения с кольцами [Si3O9]-6.
Без добавочных анионов: группа бенитоита и другие.
Кольцевого строения с кольцами [Si6O18]-12.
Без добавочных анионов: группа берилла, группа кордиерита, группа миларита, группа диоптаза.
С добавочными анионами ОН-1, F-1, и другие: группа эвдиалита и др.
Бороалюмосиликаты кольцевого строения с кольцами [Si6Al3B3O30]-18: группа турмалина.
Цепочечного строения с радикалом [Si2O6]-4.
Слайд 32
Псевдоромбические пироксены: группа энстатита – гиперстена.
Моноклинные пироксены: группа

диопсида, группа жадеита – эгирина.
Со сложными цепочками: группа рамзаита.
Ленточного
строения с радикалом [Si4O11]-6.
Ромбические амфиболы: группа антофиллита. Моноклинные амфиболы: группа актинолита, группа арфводсонита—родусита.
Алюмосиликаты: группа жедрита, группа роговой обманки, группа амфибол-асбестов, группа сепиолита—палыгорскита.
Ленточного строения с радикалом [Si6O17]-10 .
С добавочными анионами: группа волластонита.
С кристаллизационной водой: группа ксонотлита, группа гиролита.
Слоистые с радикалом [Si2O5]-2.
С добавочными анионами (ОН)-1: группа талька, группа серпентина, группа хризотил-асбеста, группа ревдинскита, группа каолинита—накрита, группа галлуазита—гарниерита, группа монтмориллонита— керолита, группа планшеита—хризоколлы, группа бейделлита, группа нонтронита.
Алюмосиликаты с добавочными анионами (ОН)-1.
Слюды: группа флогопита, группа биотита, группа литиевых слюд (тайниолит, циннвальдит, лепидолит), группа мусковита (мусковит, серицит и др.), группа хлоритоида.
С добавочными слоями (ОН)-1. Группа хлорита (Fe—Mg-хлориты, Fe-хлориты и др.), группа гидрослюд.
Слайд 33
Со слоями из тетрагональных колец: группа санборнита, группа

апофиллита.
Сложного состава: группа эвдидимита, группа пиросмалита.
Каркасные с радикалом [SiO2]:
группа кварца, группа тридимита— кристобалита.
Коллоидные SiO2: группа опала.
Каркасные алюмо- и боросиликаты с радикалом [AlnSim-nO2m]-n.
Без добавочных анионов: группа К—Na- и К—Ва-полевых шпатов. Группа Na—Са-полевых шпатов (плагиоклазов); группа лейцита, группа петалита, группа данбурита, группа нефелина.
С добавочными группами внедрения: группа скаполита, группа канкринита, группа содалита—нозеана, группа гельвина.
С добавочной группой Н2О: цеолиты — группа натролита-томсонита, группа шабазита-фоязита, группа гейландита-десмина, группа филлипсита.
Класс: бораты.
Бораты простые безводные. Подкласс. I. С изолированными [BO]-5 или [ВО3]-3: группа котоита.
С добавочными анионами: группа гамбергита, группа людвигита.
Бораты, содержащие воду. Подклассы: I. Простые цепочки с радикалом [ВО2]-1: группа ашарита. II — со сложными цепочками: группа буры, группа улексита, группа гидроборацита и другие.
С добавочными анионами: I. Слои с радикалом [В(ОН)4]-1: группа типлеита. II — сложный каркас: группа борацита.
Слайд 34
Класс: хроматы.
Хроматы простые безводные. Подкласс. I. С изолированными
![Систематика минералов Класс: хроматы.Хроматы простые безводные. Подкласс. I. С изолированными группами [СгО4]-2: группа](/img/tmb/12/1108374/7b2cd1b164feb7657d5871fe066625b5-720x.jpg)
группами [СгО4]-2: группа крокоита.
С добавочными анионами: группа меланохроита.
Класс: молибдаты.
Молибдаты
простые, безводные. Подкласс. I. С изолированными группами [МоО4]-2: группа вульфенита, группа повеллита.
С кристаллизационной водой: группа ферримолибдита.
Класс: вольфраматы.
Вольфраматы простые безводные. Подкласс. I. С изолированными группами [WO4]-2: группа шеелита, группа вольфрамита.
Сложные с добавочными анионами и кристаллизационной водой: группа антуанита.
Класс: фосфаты.
Фосфаты простые безводные. Подкласс. I. С изолированными группами [РО4]. Типа А"n[РО4]p: группа графтонита. Типа А′nА"m[РО4]p: группа трифилина—сиклерита. Типа А"'[РО4]: группа монацита.
Фосфаты простые с кристаллизационной водой. Типа А"n[РО4]p·qH2O: группа гюролита. Типа А"'n[РО4]p·qH2О: группа варисцита, фосфосидерита. С добавочными анионами (ОН)-1, F-1, Cl-1, СО3-2 и другие.
Безводные типа А"'n[РО4]p·х (ОН, F и др.): группа триплита, группа тарбуттита, группа гердерита, группа либетенита, группа апатита, группа пироморфита. Типа А′nА"m[РО4]p·х (ОН, F и др.): группа амблигонита.
Слайд 35
Типа А′′nА"′m[РО4]p·х(ОН и др.): группа лазулита—грифита.
С кристаллизационной водой.

Типа А′n[РО4]p·х (ОН) · qH2O: группа лудламита. Типа А"'n[РО4]p·х
(OH)·qH2O: группа вавеллита—эвансита, группа какоксена—дельвоксита. Типа А′′nА"′m[РО4]p·х (ОН) qH2O: группа дюфренита.
Фосфаты с добавочными анионами (ОН)-1 и другие и с кристаллизационной водой. Типа А′′nА"′m[РО4]p· х (ОН) · qH2O: группа крыжановскита, группа чильдренита, группа бирюзы, группа арроядита.
С комплексными анионами: группа диадохита, группа штаффелита (франколита), группа кампилита.
Класс: арсенаты.
Арсенаты простые с кристаллизационной водой. Подкласс. I. С изолированными группами [AsO4]. Типа A′′n[AsO4]p· qН2О: группа аннабергита, группа розeлита, группа цейнерита. Типа A′nA"m[AsO4]p· qН2О: группа фармаколита. Типа A'"[AsO4] ·qН2О: группа скородита.
Сложные с добавочными анионами. Типа A′′n[AsO4]p ·х (ОН): группа оливенита, группа адамита, группа байльдонита, группа хлорофеницита—бартита, группа миметезита. Типа A′′′n[AsO4]p· х (ОН): группа ателестита.
С кристаллизационной водой. Типа A′nA"′m[AsO4]p· x (OH)·qH2O: группа эвхроита.
С катионами А", А'", А"+А'" и другие: группы леграндита, группа фармакосидерита.
Слайд 36
Типа Аn, A"′m[AsO4]p·х (ОН)·qН2О: группа питтицита, группа бедантита,

группа халькофиллита и другие.
Класс: ванадаты.
Простые безводные. Типа A'"[VO4]: группа
пухерита.
С кристаллизационной водой. Типа A"n[VO4]p·qH2O: группа бракебушита, группа карнотита.
Cложные с добавочными анионами (ОН)-1 и другие.
Типа A"n[VO4]p·х ОН: группа ванадинита, группа эндлихита.
С кристаллизационной водой: группа хьюэттита.
Класс: сульфаты.
Сульфаты простые безводные. Подкласс. I. С изолированными группами [SO4]-2. Типа A′n[SO4]: группа тенардита. Типа A"[SO4]: группа ангидрита, группа барита. Типа A′nA′′m[SO4]p: группа глауберита—лангбейнита.
Сульфаты простые с кристаллизационной водой. Типа An[SO4]p·qH20: группа мирабиллита. Типа A"[SO4]·qH2O: группа гипса, группа кизерита, группа эпсомита, группа мелантерита, группа халькантита. Типа A′′′n[SO4]p·qH2O: группа алуногена. Типа A′nA′′m[SO4]p·qH2O: группа астраханита. Типа A′nA′′′m[SO4]p·qH2O: группа чермигита. A′′nA′′′m[SO4]p·qH2O: группа галотрихита.
Сложные с добавочными анионами. Типа A′′n[SO4]p·х(ОН,О): группа брошантита, группа ланаркита. Типа A′nA′′m[SO4]p·х Сl: группа караколита. Типа A′nA′′′m[SO4]p·х (ОН): группа алунита. Типа A′′nA′′′m[SO4]p·х(ОН): группа плюмбоярозита.
Слайд 37
С комплексными анионами: группа ганксита.
С кристаллизационной водой. Типа
![Систематика минералов С комплексными анионами: группа ганксита.С кристаллизационной водой. Типа A′′n[SO4]p·х ОН·qН2О: группа](/img/tmb/12/1108374/277eae7b6805dddf7c4e201af7526dd6-720x.jpg)
A′′n[SO4]p·х ОН·qН2О: группа вернадскита—натрохальцита. Типа Типа A′′′n[SO4]p·х ОН·qН2О: группа;
бутлерита, алюминита. Типа A′nA′′′m[SO4]·х Aq, A′′nA′′′m[SO4]p·х Aq,
A′′′′n [SO4]p·х Aq, группа сидеронатрита, группа копиапита, группа цианотрихита, группа уранопилита.
Класс: карбонаты.
Карбонаты простые безводные. Подкласс. I. С изолированными группами [СО3]-2. Типа А"[СО3]: группа кальцита, группа доломита, группа арагонита, группа альстонита.
С кристаллизационной водой. Типа A′n[CO3]p· x H2O: группа термонатрита. Типа A′′n[CO3]p·x H2O: группа ураноталлита. Типа A′nA′′m[CO3]p·xH2O: группа гейлюссита.
Сложные с добавочными анионами (ОН)-1, Сl-1 и другие. Типа
A′′n[CO3]p·q(OH): группа малахита—азурита, группа аурихальцита, группа гидромагнезита, группа фосгенита. Типа A′′′n[CO3]p·q(OH): группа бастнезита, группа бисмутита. Типа A′n A′′′m[CO3]p·q(OH): группа паризита, группа анкилита.
С комплексными анионами: группа ледгилита—шрекингерита.
Класс: нитраты.
Нитраты простые. Типа A'[NO3]: группа селитры.
Слайд 38
Я Вас познакомила с наиболее распространёнными систематиками минералов.
К сожалению, большинство их них констатируют выделение разных таксонов,
показывают их соподчинённость, но не дают принципов их выделения, не объясняют последовательность их выделения, что очень затрудняет, а порой делает невозможным использовать эти классификации для пополнения их вновь открываемыми минеральными видами. Поэтому в последнее время появились несколько трудов по минералогии, в которых минералы описываются в алфавитном порядке. И это плохо, т.к. кроме характеристики минерала, читатель не может ничего сказать о нём, а именно, в каких условиях он образуется, в какой ассоциации, а, следовательно, нет возможности предсказать, где искать его, как использовать. Такие классификации не обладают предсказательными свойствами. А как известно всякая гипотеза становится теорией, если она позволяет что-то предсказывать, что со временем подтверждается.
Слайд 39
Структурно-химическая систематика минералов А.А. Годовикова
Александр Александрович Годовиков
(1927-1996 гг.) – минералог широкого профиля, профессор, директор Минералогического
музея им. А.Е.Ферсмана (1984 – 1996 гг), известный специалист по теоретической, описательной, экспериментальной и генетической минералогии.
Круг научных интересов А.А. Годовикова был очень широк. Исследования всей его жизни были направлены на решение главной задачи, поставленной Александром Александровичем для возглавляемого им коллектива ученых и для себя лично, а именно, – на приближение минералогии к тому рубежу, когда она стала бы точной наукой, а не описательной. В связи с этим А.А.Годовиков разрабатывал теоретические вопросы минералогии, стремясь создать основу для единой классификации минералов, которая базировалась бы на химических признаках, на генетических особенностях минералов, на учете их структуры
Слайд 40
Теоретические исследования А.А. Годовикова опубликованы в 6 монографиях

и положены в основу естественной структурно-химической систематики минералов. Как
уже говорилось ранее, до 1997 года – года выхода в свет «Структурно-химической систематики минералов» А.А. Годовикова, публикацию которой автору не суждено было увидеть, существовало несколько классификаций минералов, основанных, на выделении таксонов либо по химическому, либо по структурному признаку. Это не удовлетворяло минералогов, поскольку не учитывался генезис минералов. Поэтому появилось несколько геохимических систематик: А.Е. Ферсмана (1933); А.Н. Заварицкого (1950); И. Костова (1968); Х. Штрунца (H. Strunz, 1970); А.М. Кларка (A.M. Clark, 1993), к ним мы вернемся немного позже. В них наблюдался большой разнобой в выделении отдельных таксонов, а объяснения принятой последовательности таксонов давались не всегда.
А.А. Годовиков, создавая систематику минералов, использовал основные требования к систематике, сформулированные еще В.И. Вернадским.
Слайд 41
По мнению А.А. Годовикова «наиболее полно минералога должна
удовлетворить такая систематика, в которой за основу приняты химические
признаки, позволяющие понять связь с ними структуры и свойств минералов».
Систематика должна быть естественной, поэтому, «наряду с формальными признаками, она должна учитывать реальные ассоциации минералов, их парагенезисы, различия в физико-химических параметрах, при которых образуются и находятся минералы, отдавая в ряде случаев предпочтение в расположении минералов в систематике последним признакам».
«Необходимо учитывать, что природные ассоциации минералов не случайные, а являются результатом отбора отдельных элементов по всей совокупности их свойств в естественные ассоциации». Это и является критерием естественности минералогической систематики.
Систематика минералов А.А. Годовикова отражает новейшие данные о связи химического состава со структурой и свойствами минералов, условиями их образования, парагенезиса.
Слайд 42
В её основу положены химические признаки, условия образования

минералов. Структура минералов учитывается не на уровне высших, а
средних и даже низших таксонов, так как она находится в прямой зависимости от химического состава и физико-химических параметров минералообразующих систем.
При этом, по мнению А.А. Годовикова, «важно стремиться к выделению в систематике таких таксонов, которые:
а) объединяли бы возможно большее число минеральных видов, что облегчает их общую характеристику и избавляет минералогию от многочисленных повторений, возникающих в тех случаях, когда она из-за отсутствия хорошо разработанной систематики излагается как описательная наука;
б) позволили бы показать постепенные переходы от одних таксонов к другим, их естественные и многочисленные взаимосвязи.
В максимальной степени указанным требованиям удовлетворяет систематика, которая опирается на: а) детально разработанные представления о связи свойств элементов с их электронным строением, положением их в Периодической системе;
б) многочисленные, часто не учитывавшиеся до сих пор в необходимой мере, химические признаки, от которых зависят химические свойства минералов, условия их образования, парагенезис;
Слайд 43
в) выявленные закономерности связи структуры химических соединений с

фундаментальными свойствами образующих их элементов;
г) закономерности изменения структуры
и свойств минералов в зависимости от физико-химических параметров систем, из которых произошло их образование или в которых они оказались после этого».
Прежде чем перейти к структурно-химической систематике минералов А.А. Годовикова, необходимо познакомится с некоторыми общими понятиями, которые необходимы для понимания материала.
Достаточно подробно они рассматриваются в монографиях А.А. Годовикова, здесь мы приведём краткое их определение. В уточнении нуждается и понятие валентности, имеющее разную трактовку.
Валентность — число атомов Н (или другого эквивалентного элемента), с которыми соединяется или которое может замещать один атом данного элемента в соединении. Это определение отвечает первоначальному смыслу термина валентность. Валентность не отражает действительного (эффективного) заряда ионов, числа связей данного иона с другими (КЧ).
Слайд 44
Силовые характеристики атомов и ионов — мера кулоновского
взаимодействия отрываемого (чаще валентного) электрона с ядром (γ). В
качестве силовых характеристик для атомов и ионов в свободном состоянии и катионов в кристаллах с ионной связью используются
γорб. = F/rорб., где F – сродство атома к электрону,
rорб. – орбитальный радиус атома.
γорб n+ = In/r n+орб., где In – n-й потенциал ионизации, r n+орб. – орбитальный радиус иона с валентностью n+.
γi = In/ri, где ri – эффективный ионный радиус катиона валентностью n+ в ионном кристалле.
Силовые характеристики являются мерой донорно-акцепторных (кислотно-щелочных) свойств атомов и ионов. Для перевода их в ньютоны все использованные ниже величины СХ, выраженные в эВ/Å , необходимо умножить на 16,0206· 10-8.
Слайд 45
Орбиталь (электронная) в атоме — распределение электронной плотности

вокруг атомного ядра, заданное первыми двумя квантовыми числами —
n и l и описываемое квадратом волновой функции; в квазиклассическом приближении (при больших значениях n и l) орбитали переходят в классические орбиты.
Орбитальный радиус атома (иона) определяется радиусом внешней орбитали атома (иона), рассчитанным квантово-механическим путем, ионный радиус— экспериментальная величина, зависящая, в частности, от координационного числа. При расчетах СХ в работах А.А. Годовикова использовались орбитальные радиусы Вебера и Кромера и ионные радиусы Уайтаккера и Мунтуса.
Кайносимметричные орбитали — орбитали, имеющие минимальные значения второго (побочного) квантового числа (l) при заданном первом (главном) квантовом числе (n), например, Is-, 2p-, 3d-, 4f- и т. д. орбитали. Электроны, находящиеся на этих орбиталях, называются кайносимметричными; атомы (ионы) с валентными кайносимметричными электронами называются кайносимметричными атомами (ионами), или просто
Слайд 46
кайносимметриками. .(Годовиков А.А. Свойства элементов…. 1977 с.5-6).
Некайносимметричные орбитали
— все остальные, отличающиеся от кайно-симметричных орбиталей величиной второго
(побочного) квантового числа на единицу и более, например, 2s-, 3s-, 4s- ... ; Зр-, 4р- ... и т. д. орбитали. Различают соответственно некайносимметричные электроны, атомы, ионы.
Степень сходства различия в свойствах элементов в пределах вертикальных направлений Периодической системы (групп) определяется посредством четырех разновидностей аналогий. [3].
Групп-аналоги — элементы одной группы Системы, сходные по числу достраивающихся электронов; иногда они сходны по групповой валентности.
Тип-аналоги — элементы одной подгруппы Системы, сходные не только по числу внешних (валентных) электронов, но и по типу самих элементов (s, f, d, p). Сходство между такими элементами больше, чем между групп-аналогами; различия же определяются в
Слайд 47
основном кайно- и некайносимметричным характером внешних электронов, строением

предвнешнего электронного слоя. Так в пределах 1а-тип-аналогов — Н,
Li, Na, К, Rb, Cs, Fr — резко отличными свойствами выделяется Н, как кайносимметричный элемент; специфические свойства Li и Na определяются кайносимметричными предвнешними электронами (Is2 и 2р6 соответственно); К, Rb, Cs, Fr — появлением в предвнешнем слое d-дыры у K и d-, f- и т. д. дыр у остальных элементов.
Шелл-аналоги — элементы, имеющие сходство в строении предвнешнего электронного слоя. Так, среди Ia-тип-аналогов К, Rb, Cs, Fr являются шелл-аналогами. Для большинства соединений этих элементов наблюдается близкое к линейному изменение свойств по мере роста атомного номера (Z) катиона. В то же время Н, Li и Na не являются шелл-аналогами. Различия в свойствах шелл- и не шелл-аналогов выражены в Системе со смещением тем, что прямоугольники элементов шелл-аналогов расположены строго друг под другом, тогда как прямоугольники не шелл-аналогов смещены вправо по мере увеличения СХ элемента.
Слайд 48
Шринк-аналоги— пары элементов, появляющиеся после d- или f-сжатия

(их символы в Системе со смещением шелл-аналогов приведены друг
под другом),— А1—Ga, Si—Ge, P—As, S—Se, Cl—Br — для р-элементов, Y—Lu, Zr—Hf, Nb—Та, Mo—W и т. д. для d-элементов. Сходство в свойствах перечисленных пар элементов уменьшается по мере увеличения Z (роста Δ СХ в указанных парах).
Некайносимметричные s-элементы делятся на s'- и s''-элементы.
К s'-элементам относятся элементы с предвнешними кайносимметричными электронами Li, Be, Na и Mg,
к s''-элементам — с d-, f-, g- и т. д. дырами в предвнешнем электронном слое — К, Са и их шелл-аналоги.
d-Элементы делятся на d'- и d"-элементы. К d'-элементам относятся элементы с достраивающимися d-орбиталями — IIIb—VIIIb-элементы (Sc, Ti, V, Cr, Mn, Fe, Co, Ni и их тип-аналоги), к d"-элементам—с завершенными d-орбиталями 1b- и Пb-элементы (Си, Zn и их тип-аналоги).
ps-Элементы — р-элементы, близкие по свойствам к s-элементам. Типичным примером ps-элементов является А1.
ds-Элементы — d-элементы, близкие по свойствам к s-элементам. Типичным примером ds-элементов является Sc.
Слайд 49
Таксоны структурно-химической систематики минералов А.А. Годовикова и их
соподчинённость:
Тип
Квазитип
Подтип
Квазиподтип
Надкласс
Класс
Квазикласс
Подкласс
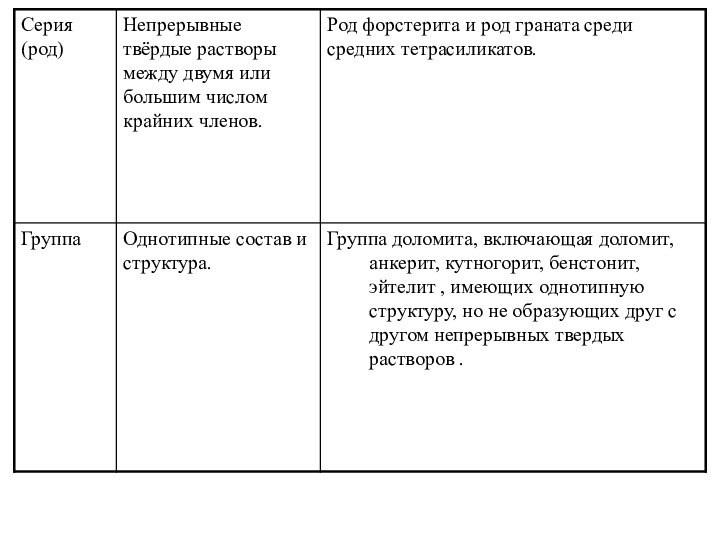
Семейство
Подсемейство
Серия (род)
Группа
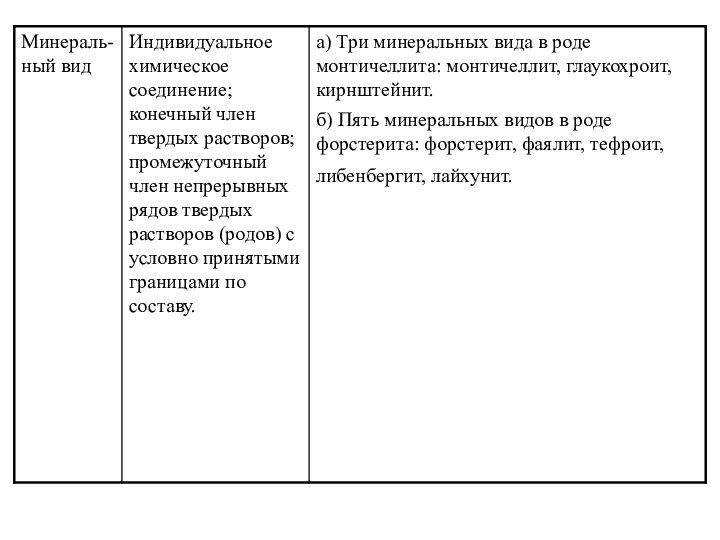
Минеральный вид
Слайд 50
А.А.Годовиков считал, что существенной особенностью классификации минералов, как

впрочем, и неорганических кристаллических веществ в целом, является невозможность
использования при её разработке строго системного подхода. Пожалуйста, не упустите этот тезис.
Прежде чем перейти к рассмотрению самих таксонов необходимо остановиться на уточнении ряда основных положений и терминов.
Начнём с систематики элементарных веществ, соединений в зависимости от преобладания в них того или иного типа химической связи.
Элементарные вещества издавна принято делить на: 1) металлы, 2) полуметаллы или металлоиды и 3) неметаллы. Эти термины в настоящее время потеряли значительную часть своей определенности. Разные авторы дают разные определения этих понятий. К сожалению, мы не можем подробно останавливаться на этом. Желающие могут познакомиться с определениями разных авторов, представленных в книге А.А. Годовикова «Структурно-химическая систематика минералов». Мы будем рассматривать эти понятия так, как их рассматривал А.А. Годовиков.
Большинство элементарных веществ относится к металлам. Меньшее их чиcло – полуметаллы. Невелико число и неметаллических элементарных веществ.
Слайд 51
Несоизмеримо больше соединений различных элементов друг с другом.

При этом тип химической связи в них, их кристаллические
структуры и свойства зависят от разности электроотрицательностей образующих элементов (атомов, ионов), их атомных (порядковых) номеров. Изменения типа химической связи, свойств у соединений в зависимости от изменения фундаментальных свойств атомов, их образующих, могут происходить как постепенно, так и скачкообразно. В целом химическая связь должна рассматриваться как металлически-ковалентно-ионно-остаточная; ее характер в соединении определяется не только степенью ковалентности (ионности), в общем случае пропорциональной разности силовых характеристик (электроотрицательностей), но также степенью металличности, определяемой порядковым номером элемента или средним порядковым номером электроположительных элементов соединения. Еще одним измерением связи в некоторых случаях выступает степень ее "остаточности", для выражения которой пока, не удалось найти простой зависимости от указанных фундаментальных свойств элементов и атомов. Несмотря на то, что природа химической связи во всех её проявлениях едина, обычно выделяют четыре ее предельных (крайних) типа – металлическую, ковалентную, ионную и остаточную связь, выраженных в отдельных соединениях в различной степени.
Слайд 52
Металлы, элементы которых занимают левую наибольшую часть развернутого

варианта Периодической системы, при взаимодействии друг с другом образуют
вещества с типично металлическими свойствами – прежде всего высокой проводимостью, сильным металлическим блеском, определяющимися металлическим типом связи или просто металлической связью. Такие вещества получили название металлидов или интерметаллидов.
Полуметаллиды – соединения металлов с полуметаллами: арсениды, антимониды, висмутиды и теллуриды (к ним же относятся не известные в качестве минералов полониды и астатиды). Это вещества с высокой проводимостью (часто полупроводникового типа), с металлическим блеском, хрупкие, в ряде случаев со спайностью, вплоть до весьма совершенной (минералы семейства тетрадимита). Они характеризуются химической связью с существенным преобладанием степени её металличности.
Неметаллиды – соединения электроположительных (металлических) и полуметаллических элементов с оставшимися неметаллическими элементами. К неметаллидам относится подавляющее число соединений от халькогенных до галогенных с весьма разнообразными свойствами, которые
Слайд 53
определяются постепенным снижением в указанном
направлении степени металличности
и степени ковалентности химической связи, увеличением её степени ионности.
Рассмотренные
группы элементарных веществ, располагаются таким образом.
Здесь металлы выделены красным шрифтом, неметаллы набраны жирным шрифтом, и полуметаллы выделены синим шрифтом.
Слайд 54
Среди неметаллидов выделяются своими свойствами
IVа-неметаллиды, что определяется

особым - "перевальным" - положением IVа-элементов в Периодической системе.
Оно проявляется в том, что левее IVа-группы находятся практически только металлические элементы, а правее - неметаллические и полуметаллические
Особым положением в Периодической системе IVа-группы объясняются и такие специфические свойства IVа-неметаллов, как образование ими многочисленных органических соединений, в том числе углеводородов, кремнийводородов (силанов, силонов и т.п.), более редких, но близких к ним по строению и свойствам германоорганических соединений. При этом карбиды, силициды и германиды можно рассматривать как производные соответствующих водородных соединений. В зависимости от электроположительного элемента они могут иметь самый различный тип связи, в том числе металлический, ковалентный, остаточный, ионный. Этим определяется разнообразие свойств подобных соединений, в том числе разнообразие их кристаллических структур, трудность определения из-за этого их места в общей последовательности смены таксонов в систематике. Так, уже отмечалось, что часть авторов включает их в "интерметаллиды". Однако это не удобно не только из-за
Слайд 55
специфических свойств этих веществ, отличающих их от металлидов,

полуметаллидов и остальных неметаллидов, но также и потому, что
такое их положение разбивает естественные связи и переходы в едином ряде: металлиды → полуметаллиды → халькогенные соединения → кислородные соединения → галогенные соединения, представляющем естественную смену типа химической связи : металлическая → металлически-ковалентная → ионно-ковалентная → ковалентно-ионнная → ионная связь.
Поэтому наиболее правильным, по мнению А.А. Годовикова, является выделение из общего ряда различных соединений веществ, образуемых IVа-неметаллическими элементами, исключив, однако, из их числа соединения типа карбонатов, которые по особенностям своего состава, свойств следует рассматривать среди остальных кислородных соединений.
При этом соединения IVа-неметаллов, включая самородные минералы, карбиды, силициды и органические соединения, должны рассматриваться как заключающие систематику.
Это первый случай нарушения строгого системного подхода.
Слайд 56
Сюда же отнесены и такие соединения Vа-неметаллов (N
и P) как нитриды и фосфиды, близкие по своим
свойствам, структурам, условиям образования к карбидам и силицидам, имеющие с IVа-неметаллами то общее, что они также принадлежат к легким (содержат от 1 до 3 p-электронов) типическим p-элементам (2-го и 3-го периодов). Важно, что в этом случае находят свое законное место и органические соединения, заключающие минералогическую систематику.
Для понимания основ систематики минералов важнейшее значение имеют такие понятия как простые соединения, двойные или более сложные соединения, соли. К простым обычно относят соединения двух элементов, состоящие из простых катионов и анионов. Например, сфалерит ZnS, халькозин Cu2S, антимонит Sb2S3 и т.п. минералы. К простым соединениям относят также минералы, содержащие простейшие комплексные катионы, например, нашатырь NH4Cl, или простейшие комплексные анионы, например, пирит Fe[S2], арсенопирит Fe[AsS], скуттерудит Co4[As4]3.
Слайд 57
К двойным или более сложным соединениям относят минералы,

содержащие более одного катиона. Например, халькопирит CuFeS2, станнин CuFeSnS4,
перовскит CaTiO3, ферберит FeWO4 и т.п. минералы.
Значительно более сложным является понятие "соли". Соли, продукты замещения атомов H кислоты на металл или группы OH основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли, например, NaCl, K2SO4, (C17H35COO)3Al. Неполное замещение атомов H приводит к кислым солям (например, гидросульфат аммония NH4HSO4), неполное замещение групп OH – к основным солям, например, дегидроксостеарат алюминия (C17H35COO)Al(OH)2. Соли обычно имеют ионную кристаллическую структуру, хотя в солях халькофильных элементов, особено слабых кислот, связь катиона с кислотным остатком часто ковалентная. Соли характеризуются относительно высокими значениями температур плавления и кипения.
Говоря об основаниях, ангидридах, кислотах, солях необходимо, таким образом, различать халько-, окси- и галогенооснования, халько-, окси- и галогеноангидриды, халько-, окси- и галогенокислоты, халько-, окси- и галогеносоли.
Слайд 58
Образование их можно пояснить следующими реакциями:
а) для оснований:
2Na
+ H2S → H2 + Na2S (тиооснование),
2Na + H2O
→ H2 + 2NaOH (гидроксиоснование),
2Na + 2HCl → H2 + 2NaCl (галогенооснование);
б) для кислот:
As2S5 + 3H2S → 2H3AsS4 (тиокислота),
SO3 + H2O → H2SO4 (оксикислота),
BF3 + HF → HBF4 (галогенокислота);
в) для солей:
3Na2S + As2S5→ 2Na3AsS4 (тиоcоль),
Na2O + SO3 → Na2O4 (оксиcоль),
NaF + BF3 → NaBF4 (галогеносоль).
Слайд 59
Для типичных оснований характерна ионная связь катион-лиганд, ионная

гомодесмическая координационная структура, в предельных, наиболее типичных случаях, –
хорошая растворимость в воде и диссоциция в растворах по реакциям типа Na2S → 2Na+ + S2- , NaOH → Na+ + OH-, NaCl → Na+ + Cl-.
Основания характеризуются низкой валентностью (W) катионов, относительно высокими температурами плавления, низкой упругостью пара. По мере увеличения степени ковалентности связи катион-лиганд указанные свойства становятся менее определенными.
Типичные ангидриды, например, As2S5, As2S3, SO3, P2O5, BF3, SiF4 характеризуются молекулярной (SO3, P2O5, BF3, SiF4) или квазимолекулярной (As2S5, As2S3) структурой с ковалентной связью внутри молекул (и квазимолекул) и остаточной связью между ними. Из-за этого наиболее типичные из таких веществ, не растворяются в воде или интенсивно с нею реагируют, имеют низкие температуры плавления, высокие упругости пара. Для них характерны высоковалентные катионы-анионообразователи (W обычно – 4, редко – 3 как у B).
Слайд 60
Халько-, окси- или галогеносоли обладают гетеродесмической связью -

ионной между катионами и кислотными остатками и ионно-ковалентной между
анионообразователем и лигандами. Такие соли хорошо растворяются в воде с образованием положительно заряженных катионов и отрицательно заряженных комплексных анионов, сохраняющих в растворе ту же форму, что и в кристаллическом теле, хотя, как правило, они в той или иной мере гидратированы. Увеличение степени ковалентности или металличности связи катион - кислотный остаток (анионный радикал) приводит к снижению растворимости солей.
Принадлежность вещества к простому, двойному соединению или к соли определяется фундаментальными свойствами образующих его атомов – их СХ и порядковым номером Z, их соотношением, принадлежностью вещества к халькогенным, кислородным или галогенным соединениям. Общая закономерность при этом проявляется в том, что переход простое соединение → двойное соединение → соль происходит по мере увеличения разности СХ образующих их катионов, т.е. по мере увеличения степени ионности связи. Уменьшение их суммарных или средних Z, т.е. уменьшение степени металличности связи, может благоприятствовать переходу как в одну, так и в другую сторону (рис.1).
Слайд 61
Рис. 1. Зависимость между суммарной величиной атомного номера
(ΣZ) атомов А(В), М(Т), разностью их силовых характеристик (Δγорб.n+)
и структурой образуемых ими соединений в ряду кислородных соединений 2АО2→АВО4→М[ТО4], где А, В и Т - d- катионы. Тип структуры: I – TiO2(рутила), II – FeWO4(ферберита), III – CaWO4(шеелита), IV – Y[VO4], V – Pb[CrO4], VI – Ba[FeO4].
Слайд 62
Все сказанное говорит не только о существенных различиях
в кристаллических структурах и свойствах простых соединений, сложных соединений,
солей, но и о естественной смене их в указанном порядке по мере изменения СХ и Z, создает основу для классификации веществ в пределах халькогенных, кислородных и галогенных соединений, т.е.в пределах выделения высших таксонов систематики – типов.
Далее необходимо рассмотреть появившиеся в 20 веке геохимические классификации элементов и катионов, чтобы понимать принципы выделения классов и других более мелких таксонов. Первой весьма удачной геохимической систематикой элементов, не утратившей определенного значения и по настоящее время, является разделение элементов на геохимические (генетические) группы, предложенное В. М. Гольдшмидтом.
Слайд 63
Рис. 2 Изменение атомного объёма элементарных веществ (
V ) по мере увеличения атомного номера ( Z
) соответствующих элементов. Структуры:
CBC – ОЦК, CPH – ПГУ, CPC – ПКУ, of diamonds – алмаза, structures of other types – структуры иного типа, La – структуры типа La.
Слайд 64
Сидерофильные элементы, находящиеся в минимальных участках кривых зависимости
атомных объёмов от атомного номера. К ним он отнёс
C, P, Fe, Co, Ni, Tc, Mo, Ru, Rh, Re, Os, Ir и Pt.
Халькофильные элементы, находящиеся на восходящих участках – S, Cu, Zn, Ga, Ge, As, Se, Pd (его правильнее было бы отнести к сидерофильным элементам), Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi и Po.
Виктор Мориц Гольдшмидт (1888 – 1947 гг.) – директор Геологического музея университета в Осло. На основе кристаллохимии он анализировал условия распределения элементов в различных минералах, условия их концентрации и миграции. Опираясь на кривую изменения атомного объёма элементарных веществ от атомного номера (рис.2) В.М. Гольдшмидт разделил все элементы на 4 группы:
Слайд 65
Литофильные элементы, находящиеся на нисходящих участках – Li,
Be, B, Na, Al, Si, K, Ca, Sc, Ti,
V, Cr, Mn, Rb, Sr, Y, Zr, Nb, Cs, Ba, Ln, Hf, Ta, W, Fr (его на графике В. М. Гольдшмидта ещё не было), Ra, Ac, Th, Pa, U. Сюда же он отнёс O, F, Cl, Br, I, находящиеся на восходящих участках рассматриваемых кривых, учитывая обычность этих элементов в минералах горных пород и делая отступление от логически-формальной в пользу естественной классификации элементов.
Атмофильные элементы, находящиеся в верхних участках кривых – He, N, Ne, Ar, Kr, Xe, Rn (Em); сюда же он отнёс H.
Неудовлетворённость систематикой В. М. Гольдшмидта привела к разработке собственных геохимических систематик А. Е. Ферсманом и А.Н.Заварицким.
Слайд 66
В систематике А. Е. Ферсмана следует отметить выделение
типических элементов (т. е. элементов с кайносимметричными внешними и
предвнешними электронами). Это сделано путем отделения их (в периодической системе) от остальных двойной горизонтальной чертой. При этом в верхнюю половину таблицы попали все типические элементы первых трех периодов, а также элементы от K до Ni включительно. Этим подчеркивались и особые свойства большинства элементов, относящихся к первой серии d-элементов, также относящихся, как было установлено позже, к кайносимметрикам.
Александр Евгеньевич Ферсман (1883-1945) – академик, директор Минералогического музея с 1919 по 1930 гг. Область его интересов чрезвычайно широка. Минералогия, кристаллография, геохимия, учение о полезных ископаемых, технология минерального сырья. Исследователь и организатор промышленной разработки ряда месторождений Кольского полуострова, Урала, Средней Азии. Создатель стройной теории генезиса пегматитов.
Слайд 67
1. Водорода – Н.
2. Благородных газов –
He, Ne, Ar, Kr, Xe, Rn.
3. Элементов горных пород
– Li, Na, K, Rb, Cs, Be, Mg, Ca, Al, Si.
4. Элементов магматических эманаций – B, C, N, O, P, S, F, Cl.
5. Элементов группы железа – Ti, V, Cr, Mn, Fe, Co, Ni.
Александр Николаевич Заварицкий (1884 – 1952 гг.) – академик, крупный геолог, петрограф, специалист по рудным месторождениям и вулканологии предложил свою геохимическую классификацию элементов, которая отличается наибольшей последовательностью и большей детальностью. Она, с одной стороны, базируется на свойствах элементов, отраженных в развёрнутом варианте Периодической системы, с другой – на огромном личном опыте крупнейшего петрографа и петролога. Он выделяет в рамках Периодической системы 11 полей элементов:
Слайд 68
6. Редких элементов – Sc, Y, Ln, Zr,
Hf, Nb, Ta.
7. Радиоактивных элементов – Fr, Ra, Ac,
Th, Pa, U.
8. Элементов группы платины – Ru, Rh, Pd, Os, Ir, Pt.
9. Металлических (цветных) элементов – Cu, Ag, Au, Zn, Cd, Hg, Ga, In, Tl, Ge, Sn, Pb.
10. Металлоидных металлогенных элементов ( элементов сульфокислот) – As, Sb, Bi, Se, Te, Po.
11.Тяжелых галоидов – I, Br, At.
4 элемента – Mo, W, Tc, Re остались вне выделенных полей.
Особо надо отметить, что систематика А. Н. Заварицкого, как это он сам отмечал, во многом близка к технической классификации элементов Г. Берга, разработанной на основе сугубо производственных (технических) признаков, что укрепляет значение обоих из них.
Слайд 69
Близкой к рассмотренным оказалась минералого-кристаллохимическая систематика элементов А.А.
Годовикова, разработанная с учетом последних данных по особенностям электронного
строения элементов:
1. учения о кайно- и некайносимметричных электронах;
2. элементах, различных степенях близости (аналогии);
3. свойств элементов в зависимости от их электроотрицательности, выраженной силовыми характеристиками – СХ и порядковым номером элемента Z. Однако в ней имеется целый ряд существенных изменений. Выделенные в этой систематике 13 полей элементов удобно объединить в более крупные группы, используя терминологию В. М. Гольдшмидта, изменив, однако, наполнение групп с учетом указанных данных. В этом случае получим следующую систематику элементов:
Слайд 70
1. Водород – H. Выделение H в отдельную
группу соответствует систематике
А.Н.Заварицкого.
2. Литофильные элементы с низкими СХ.
2.1. Щелочные и щелочноземельные элементы – Li, Na, K, Rb, Cs, Fr;
Mg, Ca, Sr, Ba.
2.2. Редкоземельные и радиоактивные элементы – Sc, Y, Ln (La - Yb),
Th, U.
2.3. Амфотерные элементы – Be, Al, (Ga).
2.4. Кайносимметричные d'-элементы – Ti, V, Cr, Mn, Fe, Co, Ni. Эта
группа элементов полностью аналогичная группе железа А. Н.
Заварицкого; Ti связан диагональным сходством с Nb и Ta,
отнесенных к следующей группе 3.1., чем объясняется
изоморфизм между ними и обычность примесей Ti в минералах
Nb и Ta и наоборот.
3. Литофильные элементы со средними СХ .
3.1. Некайносимметричные d'-комплексообразователи – Zr, Hf, Nb, Ta.
3.2. Mo и W.
4. Благородно-металлические (сидерофильные) элементы – Ru, Rh, Pd,
Ag, Os, Ir, Pt, Au; из них Ag и Au часто оказываются в халькофильных
минералах и ассоциациях.
Слайд 71
5. Халькофильные элементы.
5.1. Халькофильные элементы с
низкими СХ – Cu, Zn,
Cd, Hg, (Ga), In, Tl, Pb.
5.2. Халькофильные элементы со средними СХ – Ge, Sn,
As, Sb, Bi, Se, Te. Группы 5.1. и 5.2. очень близки
группам 9 – метаталлических (цветных) элементов и 10–
металлоидных металлогенных элементов (элементов
"сульфокислот") А.Н.Заварицкого соответственно, за
исключением Ge и Sn, которые он отнёс к группе 9.
6. Легкие анионообразователи – B, C, Si, N, P, O, S, F, Cl. Эта группа
элементов полностью аналогичная группе элементов магматических
эманаций А. Н. Заварицкого, входящих в виде анионообразователей (B, C,
Si, N, P, S) или анионов (O, F, Cl) в литофильные минералы и лишь S
играет наряду с этим анионную роль в халькофильных минералах.
7. Тяжелые анионообразователи – Br и I.
8. Благородногазовые элементы – He, Ne, Ar, Kr, Xe, Rn.
Слайд 72
Приведённая систематика, однако, нуждается в дополнительных уточнениях, поскольку
большинство элементов оказываются амфотерными и их кислотно-основные свойства определяются:
1. свойствами других элементов, находящихся в соединении;
2. их соотношениями;
3. физико-химическими параметрами систем, в которых образовался или находится минерал.
Представления об амфотерности в применении к кристаллическим веществам, должны опираться на величины КЧ катионов. Общей закономерностью здесь является то, что увеличение КЧ катиона приводит к усилению его основных свойств, а уменьшение КЧ, напротив, - усилению его кислотных свойств.
Таким образом, катионы типично сидерофильных элементов могут стать в кристаллохимическом отношении аналогами типичных литофильных элементов, и катионы типично халькофильных элементов могут стать также аналогами типичных литофильных элементов.
Слайд 73
В этом отношении можно указать на Mn2+, Fe2+

, Co2+ , Ni2+ , которые при КЧ =
6 оказываются кристаллохимическими аналогами Mg2+ , что проявляется в широком изоморфизме между ними, образовании не только изоформульных, но и изоструктурных соединений.
Точно также Pb2+ при КЧ 12 оказывается кристаллохимическим аналогом Ba2+, K+ в минералах типа голландита, Ca2+ – в минералах типа македонита, близких по структуре к перовскиту (CaTiO3);
Tl+ с КЧ = 12 оказывается аналогом типично литофильного щелочного K+ в изоструктурной паре джерфишерит - талфенисит. Подобных примеров существует множество, что очень затрудняет использование генерализованных систематик элементов (катионов) типа рассмотренных выше.
Различия в кислотно-щелочных свойствах катионов с разными КЧ удобно выражать приведенными величинами СХ т.е. их отношением к КЧ – СХ/КЧ, которые наряду с электронным типом катиона (s-, f-, d-, p-), его порядковым номером позволяют прийти к очень важным выводам. Рассмотрим это несколько подробнее в порядке, отвечающем переходу от s-, f- через d- к p-элементам.
Слайд 74
Рис.3. Связь приведённых силовых характеристик(СХ/КЧ) с кислотно-основными свойствами
катионов. (Надо исправить обозначение (4)Mn 4+ на (4)Mn 7+.
СХ/КЧ = 121.8)
Слайд 75
Элементы s- и f-типа в подавляющем числе случаев

дают катионы с настолько низкими значениями СХ/КЧ, что почти
все они могут быть отнесены к катионам с щелочными или ярко выраженными основными свойствами (рис. 3).
Особое положение среди s-катионов занимают Li+, для которого при КЧ = 6 СХ/КЧ = 4,7 , а при КЧ = 4 – 7,1, Mg2+ , у которого СХ/КЧ при КЧ = 6 равна 10,2, а при КЧ = 4 – 15,3 и Be2+, для которого СХ/КЧ при КЧ = 6 равна 21,8, а при КЧ = 4 – 32,8. Указанные особенности этих катионов проявляются в их особом поведении в соединениях. Так, Li+ не изоморфен с другими s-катионами Iа-группы с более низкими СХ/КЧ. В тоже время его соединения по свойствам и условиям образования существенно отличаются даже от изоструктурных минералов. В качестве примера назовём холмквистит, лепидолит и сподумен, являющиеся в этом отношении "белыми воронами" в семействах амфиболов, слюд и пироксенов соответственно.
Своеобразна в минералах и роль (6)Mg2+ , который во многих из них проявляет изоморфизм вплоть до полного с катионами типа (6)Fe2+ , (6)Mn2+ , но не с остальными IIа-катионами; в ряде минералов (например, в слюдах, хлоритах) он изоморфен в широких пределах с (6)Al3+ .
Катионы же (4)Mg2+ могут быть изоморфны даже с катионами типа (4)Al3+ или играть сходную с последними кристаллохимическую роль, что проявляется, например, в оксишпинелидах. Таким образом, в кристаллохимическом отношении у Mg2+ намечается переход к амфотерным катионам.
Слайд 76
Типичным амфотерным s-катионом является Be2+, для которого в

минералах обычно КЧ = 4 (СХ/КЧ = 32,8). Именно
с этим связано образование минералов типа бериллосиликатов, характеризующихся тем, что они содержат гетероядерные берилло-кремниевые полимерные радикалы, бериллофосфатов со смешанными гетероядерными берилло-фосфорными радикалами и т. п. минералов.
Среди f-катионов особое положение занимает U6+, для которого известно более 180 минеральных видов, с U6+ в виде иона уранила (UO2)2+. Среди них оказывается небольшое число относительно простых соединений, тогда как основная их масса обладает свойствами солей слабых кислот, в которых ион уранила входит в состав комплексных анионных радикалов. Это установлено в уранатах и многочисленных солях уранило-кислот. Поскольку до сих пор нет точных значений СХ U6+ для определения СХ/КЧ, приходится брать два крайних значения СХ. При этом важно, что даже при относительно высоких значениях КЧ (8 = 2 + 6 и 6 = 2 + 4) они оказываются заметно выше аналогичных величин почти всех рассмотренных s- и f-катионов, кроме (4)Be2+. Таким образом, все рассмотренные катионы можно разделить на два типа: 1) литофильные s- и 2) литофильные f-катионы, достаточно четко обособленные на приведенном рисунке.
Слайд 77
Как известно к лантаноидам по своим свойствам очень
близки два d-элемента – Sc и Y. Они обычно
находятся в одних и тех же минералах в виде изоморфных смесей и их очень трудно отделять химическим путем друг от друга. Все это привело к объединению всех рассматриваемых элементов в группу редких земель, для обозначения которой принят символ TR. Близость величин СХ/КЧ у Sc3+ и Y3+ с подобными величинами катионов лантанидов, хорошо видна на рисунке. Учитывая сказанное, эти катионы обозначаются как литофильные df -катионы. При этом не следует забывать, что максимальное сходство с f-катионами они имеют при высоких КЧ, тогда как при КЧ = 6, например, Sc3+ может играть кристаллохимическую роль (6)Al3+, что проявляется в бацците (Sc,Al)2Be3[Si6O18], являющемся кристаллохимическим аналогом берилла Al2Be3[Si6O18].
Слайд 78
Значительно более сложно выглядит связь величин СХ/КЧ с

кислотно-основными свойствами у остальных d-катионов (рис. 3). Это определяется
как большим разнообразием их валентностей и КЧ так и принадлежностью их не только к литофильным, но и к халькофильным элементам (катионам).
(Платиноиды исключены из рассмотрения из-за своих уникальных свойств и отличного от большинства других элементов поведения в минералах).
Остановимся на неполновалентных катионах кайносимметричных d-элементов, объединявшихся ранее А. Н. Заварицким в группу железа, а А.А. Годовиковым – в группу кайносимметричных d'-элементов. Из рис. 3 видно, что по валентности и величине СХ/КЧ такие катионы как (6)Mn2+ (6,7), (6)Fe2+ (7,4), (6)Co2+ (8,3), (6)Ni2+ (9,3) близки к (6)Mg2+ (10,2). Это проявляется в изоморфизме вплоть до полного между этими катионами во многих минералах.
Близкие величины СХ/КЧ имеют и трехвалентные (6)Ti3+ (10,1), (6)V3+ (11,5), (6)Cr3+ (12,9), (6)Fe3+ (14,4), (6)Mn3+ (14,9), для которых также отмечается широкий изоморфизм, как между собой, так и с (6)Al3+ (21,4) (оксишпинелиды, слюды, пироксены, гранаты и многие другие).
Следует отметить, что во многих минералах проявляется достаточно широкий изоморфизм также между рассматриваемыми 2-х и 3-х валентными катионами (особенно в слюдах, хлоритах).
По величине СХ/КЧ трехвалентные (6)Ti3+, (6)V3+, (6)Cr3+, (6)Fe3+, (6)Mn3+ близки и к (4)Mg2+ (15,3), чем можно объяснить их близкую кристаллохимическую роль в минералах типа оксишпинелидов.
Слайд 79
Иную кристаллохимическую роль играют (6)Ti4+ (15,8), (6)V4+ (17,8),

(4)Fe3+ (21,6), (4)Mn3+ (22,4), (4)Ti4+ (23,7), (6)V5+ (25,6), (4)V4+
(26,7), выступающие, например, в сложных оксидах в виде электроотрицательных амфотерных катионов с очень слабо кислотными свойствами, а также в виде слабых анионообразователей в минералах типа ферритов, феррисиликатов, приближаясь в этом отношении к (4)Be2+ (32,8) и (4)Al3+ (32,2).
Здесь надо отметить, что по величине СХ/КЧ среди катионов Ti даже (4)Ti4+ (23,7) далек от типичных анионообразователей. Поэтому соответствующие соединения, не известные пока в виде минералов, должны рассматриваться как сложные оксиды. Применение же к ним принятого в химии названия титанатов, подразумевающего под ними соли титановых кислот, весьма условно.
Учитывая отмеченную выше близость этих катионов с такими s-катионами как (6)Mg2+ , (4)Mg2+, (4)Be2+ и принадлежность соответствующих элементов к литофилам, все они обозначаются нами как ds-катионы.
К ds-катионам отнесены также (6)Zn2+ (10,2) и (6)Cu2+ (11,0), близкие по СХ/КЧ к (6)Mg2+ (10,2) и (4)Mg2+ (15,3), чем объясняется их близкая кристаллохимическая роль, например, в оксишпинелидах, пироксенах и некоторых других минералах.
Особое положение на рисунке занимают катионы элементов, выделенных как некайносимметричные d'-комплексообразователи – Zr, Nb и Ta. Несмотря на низкие значения величин СХ/КЧ, в минералах эти катионы изредка играют роль катионов простых соединений, например, в простых оксидах, цирконе и т.п.
Слайд 80
Гораздо более характерна для них роль электоротрицательных катионов

в сложных соединениях типа цирконатов, танталониобатов, где они, однако,
не достигают роли типичных анионообразователей. Склонность их к комплексообразованию проявляется и в образовании смешанных анионных радикалов цирконо- и танталосиликатов. По этим признакам к ним близок и Ti4+ , также образующий минералы типа титаносиликатов, в которых между Ti и Nb, Ta проявляются изоморфные замещения, что является отражением диагонального сходства Ti с Nb и Ta, о котором речь уже шла выше.
Таким образом, Ti выступает как элемент с двойственными кристаллохимическими особенностями – с одной стороны он является членом кайносимметричных d'-элементов, с другой – выступает как равноправный представитель некайносимметричных d'-комплексообразователей.
Роль электроорицательных катионов в сложных оксидах, стремящиxся к роли анионообразователей в оксисолях, еще ярче выражена у Mo6+ , W6+, особенно при их КЧ = 4, отвечающем молибдатам и вольфраматам.
Все это показывает их естественную связь со сложными оксидами и противоестественность растаскивания их по принципиально разным таксонам, как это, например, делал А.С.Поваренных [13], рассматривавший минералы типа вольфрамитов с КЧ у Mo6+ и W6+, равным 6, среди сложных оксидов, а минералы типа шеелита с КЧ у Mo6+ и W6+, равным 4, совсем в другом месте систематики – среди оксисолей, близких к сульфатам, с которыми они не имеют никаких генетических связей и объединяются лишь по формальным признакам – одинаковости КЧ и валентности анионообразователей.
Слайд 81
То же можно сказать о вычленении ванадатов V5+с

КЧ= 4 из других теснейшим образом генетически связанных с
ними минералов V5+ , в которых его КЧ = 5 или 6 и рассмотрение их совместно или близко к минералам класса фосфатов только по формальным признакам: изоформульности соответствующих кислот; одинаковой валентности анионообразователей; одинаковости их КЧ.
Таким образом, кайносимметричные (6)Ti4+, (6)V4+, (4)Fe3+, (4)Mn3+, (4)Ti4+, (6)V5+ , (4)V4+ и некайносимметричные (6)Zr4+, (6)Ta5+, (6)Nb5+, (6)W6+, (4)Ta5+, (6)Mo6+, (4)Nb5+, (4)W6+, (4)Mo6+ представляют группу амфотерных катионов со свойствами от слабо основных при КЧ = 6 до слабо кислотных при КЧ = 4, заканчивающуюся (4)V5+, проявляющем наиболее кислотные свойства.
В то же время полновалентные (4)Cr6+ и (4)Mn7+ обладают достаточно сильными кислотными свойствами, что выражается в их роли как анионообразователей сильных хромовой и марганцевой кислот и их солей.
Учитывая сказанное, кристаллохимическую роль отдельных катионов в минералах, рассмотренные d-катионы целесообразно разделить на три группы:
Слайд 82
а). Литофильные d-катионы с низкими СХ - (4)Fe3+,

(4)Mn3+. Их целесообразно объединить с s-катионами, рассматривая как ds-катионы,
поскольку они кристаллохимически тесно связаны с другими трех- и двухвалентными ds-катионами. Это проявляется и в парагенезисе соответствующих минералов, находящихся совместно или закономерно сменяющих друг друга по мере изменения окислительного потенциала Eh. В то же время не следует забывать и о значительной роли (4)Fe3+ в халькогенных минералах.
б). Литофильные d-катионы со средними СХ - (6)Ti4+, (6)V4+, (4)Ti4+, (6)V5+, (4)V4+, (6)Zr4+, (6)Ta5+ , (6)Nb5+, (6)W6+, (4)Ta5+, (6)Mo6+, (4)Nb5+, (4)W6+, (4)Mo6+, (4)V5+. Они образуют как простые, так и сложные оксиды, которые по своему составу, ряду свойств и особенно генезису, тесно связаны с завершающими этот ряд оксисолями. Вычленение последних по признаку высоких констант соответствующих кислот и рассмотрение этих классов минералов на этом основании вместе с оксисолями p-анионообразователей (фосфатами или сульфатами), как это обычно делается по логически-формальным мотивам, является противоестественным. С этим согласуются средние значения Eh, требующиеся для образования подобных минералов, их низкая растворимость, характер парагенезиса.
в). Литофильные d-катионы с высокими СХ - (4)Cr6+ и (4)Mn7+, являющиеся d-анионообразователями сильных кислот, рассмотрение которых должно завершать кислородные соединения литофильных d-катионов.
В подкрепление сказанному приведем последовательность рассмотренных классов оксисолей по мере увеличения силы кислот (уменьшения константы диссоциации pKа соответствующих кислот):
Слайд 83
Класс (4)-Ванадаты (3,74; H3[VO4])
Класс (4)-Молибдаты (2,54; H2[MoO4])
Класс (4)-Вольфраматы
![Систематика минералов Класс (4)-Ванадаты (3,74; H3[VO4])Класс (4)-Молибдаты (2,54; H2[MoO4])Класс (4)-Вольфраматы (2,20; H2[WO4]) Класс](/img/tmb/12/1108374/bb3fc25029128917eeb84da520e893c2-720x.jpg)
(2,20; H2[WO4])
Класс (4)-Хроматы (0,80; H2[CrO4])
В качестве ds-катиона в
некоторых минералах выступают (12)Ag+ (1,2), играющий, например, в аргентоярозите роль (12)K+ (0,61) , а также (4)Zn2+ (15,3) и (4)Cu2+ (16,5), которые обычно являются типичными халькофильными катионами и лишь изредка играют роль ds-катионов, например, в оксишпинелидах.
Остальные d-катионы с КЧ 4 и ниже являются типично халькофильными.
Те же признаки положены в систематику p-катионов (рис. 3), которые можно объединить по их роли в минералах в 6 групп:
а). ps-Катионы литофильных элементов- (6)Al3+ и (4)Al3+, близкие кристаллохимически, как уже отмечалось, к (6)Mg2+ и особенно к (4)Mg2+ и (4)Be2+. Сюда по величине СХ/КЧ можно было бы отнести (6)Ge4+ и (6)Si4+. Однако, (6)Si4+ устойчив только при очень высоких давлениях (стишовит со структурой типа рутила) и оказывается в составе минералов, образующихся в земной коре, крайне редко. Из них пока можно указать лишь на единственно твердо установленный минерал - таумасит с формулой Ca3Si(OH)6[CO3][SO4] ·12H2O.
Слайд 84
Если же учесть тесную генетическую связь минералов (6)Ge4+

и (6)Si4+ с минералами (4)Ge4+ и (4)Si4+, относящимися к
очень слабым ангидридам кремневой и германиевой кислот и их солям, представляется более целесообразным, в силу тех же причин, о которых говорилось выше, минералы (6)Ge4+ и (6)Si4+ рассматривать совместно с минералами (4)Ge4+ и (4)Si4+, отделив их от минералов (6)Al3+ и (4)Al3+. При этом нельзя забывать об определенной кристаллохимической близости (4)Al3+ и (4)Si4+, выражающейся в существовании многочисленных алюмосиликатов с гетероядерными алюмокремневыми полимерными радикалами.
б). Литофильные анионообразователи оксикислот, к которым относятся полновалентные катионы p-элементов, выделенныe ранее в легкие анионообразователи – (4)Si4+, (4)B3+, (4)P5+, (3)B3+, (4)S6+, (4)Cl7+, (4)C4+, (4)N5+. Здесь особо надо отметить различные КЧ, которые может иметь B, из-за чего его свойства как анионообразователя существенно меняются – (4)B3+ по этим признакам находится между (4)Si4+ и (4)P5+, тогда как (3)B3+ – между (4)P5+, и (4)S6+. Кроме того, известно много минералов, содержащих полимерные радикалы с (4)B3+ и (3)B3+ одновременно, существенно отличающиеся по свойствам и условиям образования, парагенезису от остальных боратов.
Слайд 85
К этой же группе условно отнесены соли (4)S4+
– сульфиты, поскольку несмотря на низкое значение СХ/КЧ у
этого анионообразователя (17,8), сернистая кислота относится к сильным кислотам (pKa = 1,85) и ее соли вполне могут рассматриваться в связи с сульфатами, от которых их отличает прежде всего более низкая величина Eh, необходимая для их образования. (На рис. 3 отсутствует точка (4)S4+).
в). ps-Катионы халькофильных элементов – (12)Tl+, (12)Pb2+, (8)Pb2+,(8)Sb3+ и (8)Bi3+. Из них (12)Tl+ является, как уже говорилось, кристаллохимическим аналогом (12)K+ в паре джерфишерит - талфенисит и т.п. минералах; (12)Pb2+ – (12)Ca2+ в македоните; (12)Ba2+,(12)K+ – в минералах типа голландита; (8)Pb2+, (8)Sb3+ и (8)Bi3+ – (8)Ca2+, (8)TR3+ в минералах со структурой пирохлора. Эти же катионы входят в состав и некоторых других литофильных минералов.
Слайд 86
г). Халькофильные p-катионы с низкими СХ, – (4)Tl+,

(3)Tl+, (6)Pb2+, (6)Sb3+, (6)Bi3+, (6)As3+, (6)Te4+, (4)As3+, (4)Te4+, (6)In3+,
(4)Tl3+, (4)In3+, (6)Sn4+, (4)Pb4+, (4)Sn4+, (4)Ga4+, выступающие в качестве электроположительных компонентов простых и сложных халькогенных соединений, халькосолей, в которых КЧ многих катионов возрастает, например, для Pb2+ до 7 и даже 8, для Cu+ до 6 и т.д., а также в кислородных минералах, относящихся к арсенитам, ..., теллуритам, теллуратам.
д). Халькофильные p-катионы со средними СХ – (3+Е)Sb3+, (3+Е)Bi3+, (3+Е)As3+, (6)Bi5+, (6)Sb5+, (6)Te6+, (4)Sb5+, (6)As3+, выступающие в виде электроотрицательных компонентов в сложных сульфидах и оксидах, анионообразователей халькосолей → оксисолей типа арсенитов, ..., теллуритов и теллуратов. При этом, по своим свойствам и условиям образования последние минералы ближе к соответствующим сложным соединениям, нежели к типичным оксисолям вроде фосфатов и сульфатов, среди которых они обычно рассматриваются без должных на то оснований. В этом отношении они напоминают рассмотренные выше танталониобаты, молибдаты, вольфраматы, ванадаты.
Слайд 87
е). Халькофильные анионообразователи радикалов оксисолей – (4)Ge4+, (4)As5+,
(4)Se6+. Оксисоли, отвечающие таким кислотам из-за кристаллохимического логически-формального сходства
обычно помещают в систематике сразу же за силикатами, фосфатами и сульфатами соответственно. Условно сюда же причисляются селениты, которые несмотря на то, что анионообразователь (4)Se4+ имеет низкое значение СХ/КЧ, являются солями достаточно сильных кислот, напоминая в этом отношении сульфиты с анионообразователем (4)S4+. Однако, учитывая условия образования этих минералов в основном за счет окисления халькофильных минералов, тесную их химическую и парагентическую связь с минералами, образуемыми элементами двух предыдущих групп, наиболее естественным является завершение ими рассмотрения минералов халькофильных элементов. При этом следует учитывать следующую последовательность классов минералов в зависимости от силы их кислот:
Слайд 88
Класс (6)-Арсениты (9,23; H3AsO3)
Класс (4)-Германаты (9,10; H2[GeO4]) –
рассматриваются вслед за силикатами
Класс (6)-Теллураты (7,61; H6TeO6 или
Te(OH)6)
Класс (4)-Теллуриты (2,57; H2TeO3)
Класс Селениты (2,75; H2SeO3)
Класс (4)-Арсенаты (2,25; H3[AsO4])
Класс (4)-Селенаты (1,92; H2[SeO4])
Подводя итог и учитывая некоторые известные факты, можно представить систематику важнейших, входящих в минералы ионов, в следующем виде (в скобках указаны величины СХ/КЧ):
1. Водородные и водородсодержащие ионы, нейтральные молекулы – H+, (H3O) +, NH+4; (OH)-; H2O.
2. Катионы литофильных элементов с низкими СХ, включающие:
a). s-Катионы – (12)Cs+ (0,35), (12)Rb+ (0,47), (9)Cs+ (0,47),
(12)K+ (0,61), (9)Rb+ (0,63),
Слайд 89
(12)Ba2+(0,96), (12)Sr2+(1,3), (9)Ba2+(1,3), (12)Na+(1,5),

(12)Ca2+(1,8), (9)Sr2+(1,8), (9)Na+(2,0), (9)Ca2+ 2,5), (6)Na+
(3,1),
(6)Ca2+(3,7), (6)Li (3,7), (4)Li+(7,1), (6)Mg2+(10,2), (4)Mg2+
(15,3), (6)Be2+ (21,8), (4)Be2+ (32,8).
б). f-Катионы – (12)Ce3+(2,0), (12)La3+(2,0), (12)Th4+(2,7), (8)Ce3+
(3,1), (12)U4+ (3,65), (8)Th4+ (4,1); особыми свойствами
обладает U6+, встречающийся в минералах преимущественно
в виде иона уранила (UO2)2+, образующего слабые урановые
кислоты, уранаты и многочисленные уранил-оксисоли.
в).df-Катионы– (12)Y3+(2,7), (6)Y3+(4,0), (12)Sc3+(4,2), (6)Sc3+(6,3).
г). ds-Катионы – (12)Ag+(1,2), (6)Mn2+(6,7), (6)Fe2+(7,4), (6)Co2+
(8,3), (6)Ni2+(9,3), (6)Ti3+(10,10), (6)Zn2+(10,2), (6)Cu2+(11,0),
(6)V3+(11,5), (6)Cr3+(12,9), (6)Fe3+(14,4), (6)Mn3+(14,9), (4)Fe3+
(21,6), (4)Mn3+(22,4); частично эту же роль играют (4)Zn2+
(15,3) и (4)Cu2+(16,5), более характерные для халькофильных
минералов; катионы (6)Mn2+(6,7), (6)Fe2+(7,4), (6)Co2+(8,3),
(6)Ni2+(9,3), (6)Cr3+ (12,9), (6)Fe3+ (14,4), (6)Mn3+ (14,9), (4)Fe3+
(21,6), (4)Mn3+ (22,4), особенно выделенных жирным шрифтом
Слайд 90
выступают также как халькофильные катионы с

низкими СХ
(гр. 4.г).
д). ps-Катионы
литофильных элементов – (6)Al3+(21,4), (6)Ge4+
(29,2), (4)Al3+(32,2), (6)Si4+(37,6).
е). ps-Катионы халькофильных элементов – (12)Tl+ (0,48),
(12)Pb2+ (1,3), (8)Pb2+(1,9), (8)Sb3+(3,3), (8)Bi3+(3,4), (6)Pb2+(2,5),
(6)Sb3+(4,4), (6)Bi3+(4,6), (6)As3+(5,7), (6)Te4+(6,0); катионы
(6)Pb2+(2,5), (6)Sb3+(4,4), (6)Bi3+(4,6), (6)As3+(5,7), (6)Te4+(6,0)
выступают в качестве катионов также в некоторых халькосолях.
3. Катионы - комплексообразователи литофильных элементов с
низкими - средними СХ, включающие:
а). Катионы некайносимметричных d'-комплексообразователей с
низкими - средними СХ – (12)Zr4+(4,5), (6)Zr4+(9,4), (6)Ta5+
(12,7), (6)Nb5+(15,2), (6)W6 +(17,8), (4)Ta5+(19,1), (6)Mo6+(20,6),
(4)Nb5+(22,7), (4)W6+(26,8), (4)Mo6+(30,9).
б). Катионы кайносимметричных d'-комплексообразователей со
средними СХ – (6)Ti4+(15,8), (6)V4+(17,8), (4)Ti4+(23,7), (6)V5+
(25,6), (4)V4+(26,7), (4)V5+(38,4), (4)Cr6+(54,4), (4)Mn7+(121,3).
Слайд 91
4. Халькофильные катионы с низкими СХ, включающие:

а). Катионы халькофильных элементов с низкими СХ – (4)Tl+
(1,45), (3)Tl+(1,9), (6)Pb2+(2,5), (4)Ag+(3,5), (4)Au+ (3,6), (6)Sb3+
(4,4), (6)Bi3+(4,6), (6)As3+(5,7), (6)Te4+(6,0), (4)Cu+ (6,2), (4)Hg2+
(7,7), (4)As3+(8,6), (4)Te4+(8,9), (3+E)Sb3+(8,9), (3+E)Bi3+(9,1),
(6)In3+(9,7), (6)Zn2+(10,2), (6)Cu2+(11,0), (3+E)As3+(11,4), (4)Tl3+
(12,8), (4)In3+(14,6), (4)Zn2+(15,3), (4)Cu2+(16,5), (6)Sn4+(16,9),
(4)Pb4+(17,5), (4)Sn4+(25,3), (4)Ga3+(37,8) и катионы тех же
элементов с более низкими КЧ; катионы (6)Pb2+ (2,5), (6)Sb3+
(4,4), (6)Bi3+ (4,6), (6)As3+ (5,7), (6)Te4+ (6,0) выступают в
качестве катионов также в некоторых в оксидах (см. гр. 2.е),
(6)Sb3+ (4,4), (6)Bi3+ (4,6), (6)As3+ (5,7), (6)Te4+ (6,0), (4)As3+ (8,6),
(4)Te4+ (8,9), (3+E)Sb3+ (8,9), (3+E)Bi3+ (9,1), (3+E)As3+ (11,4),
(6)Sn4+ (16,9) – в качестве комплексообразователей в ряде
сложных халькогенных и кислородных соединений (гр. 5).
б). Некоторые, в первую очередь выделенные жирным шрифтом,
катионы кайносимметричных d'-элементов – (6)Mn2+ (6,7),
(6)Fe2+ (7,4), (6)Co2+ (8,3), (6)Ni2+ (9,3), (6)Cr3+ (12,9), (6)Fe3+ (14,4),
Слайд 92
(6)Mn3+ (14,9), (4)Fe3+ (21,6), (4)Mn 3+ (22,4),

широко известные в
минералах как ds-катионы (см.
гр. 2.г).
5. Халькофильные катионы-комплексообразователи (в основном катионы халькофильных элементов со средними СХ) – (6)Sb3+
(4,4), (6)Bi3+(4,6), (6)As3+(5,7), (6)Te4+(6,0), (4)As3+(8,6), (4)Te4+
(8,9), (3+E)Sb3+(8,9), (3+E)Bi3+(9,1), (3+E)As3+(11,4),
(6)Sn4+(16,9), (6)Bi5+(17,2), (6)Sb5+(24,3), (6)Ge4+(29,2),
(6)Te6+(33,1), (4)Sb5+ (36,4), (6)As5+(42,4), (4)Ge4+(43,6),
(4)As5+(63,7), (4)Se6+(78,0); катионы (6)Sb3+(4,4), (6)Bi3+ (4,6),
(6)As3+(5,7), (6)Te4+(6,0), (4)As3+ (8,6), (4)Te4+(8,9), (3+E)Sb3+(8,9),
(3+E)Bi3+(9,1), (3+E)As3+(11,4), (6)Sn4+(16,9) некоторые из которых
выступают также как катионы халькофильных элементов с
низкими СХ, например, 6)Sb3+ (4,4), (6)Bi3+(4,6), (6)As3+(5,7).
6. p-Анионообразователи (катионы легких и тяжелых
анионообразователей) – (4)Si4+(56,4), (4)B3+(86,2), (4)P5+(90,3),
(3)B3+(114,9), (4)S6+(130,2), (4)Cl7+(181,8), (3)C4+(238,8), (3)N5+
(418,3); (4)S4+(17,8), (3)I5+(23,7), (3)Br5+(27,3).
Слайд 93
Приведенная систематика катионов положена в основу дальнейшей систематики
минералов, особенно в пределах классов, выделяемых по характеру анионов.
В то же время она показывает, что одни и те же катионы могут играть катионную роль в минералах разных типов, например, в литофильных и халькофильных, выступать в одних минералах как катионы, проявляя свои основные свойства, а в других - как анионообразователи, проявляя свои кислотные свойства. Величина СХ/КЧ в целом предоопределяет роль катионов в соединениях, но она не может использоваться как строгий формальный критерий, поскольку свойства катионов в большой мере зависят и от тонкостей строения атомов, в частности принадлежности их к кайно- или некайносимметрикам, величины их Z. В то же время во многих случаях она позволяет судить не только о роли катиона в соединении, но и о возможности изоморфизма между ним и другими катионами, особенно если они близки по другим признакам.
Слайд 94
Остановимся на принципах выделения в систематике высших таксонов,

их последовательности, связи между ними. К высшим таксонам относятся
все таксоны до классов, квазиклассов и субклассов включительно, хотя далеко не все авторы дают им специальные названия, трассируя их последовательность цифрами (сначала римскими, а затем арабскими) и буквами (сначала заглавными, затем – строчными), или только последовательно увеличивающимися цифровыми индексами.
В качестве ведущего признака выделения высших таксонов принят преимущественный тип химической связи, по которому все минералы объединены в пять типов:
1.Тип: Минералы преимущественно с металлическим и металлически-ковалентным типом связи – самородные металлы и полуметаллы, металлиды и полуметаллиды.
2.Тип: Минералы преимущественно с металлически-ковалентным и ионно-ковалентным, редко с остаточным типом связи – халькогенные соединения и самородные VIа-неметаллы.
3.Тип: Минералы преимущественно с ионно-ковалентным и ковалентно-ионным типом связи – неметаллиды легкого (типического, кайносимметричного) VIa-элемента (О) – кислородные соединения.
Слайд 95
4.Тип: Минералы преимущественно с ковалентно-ионным и ионным типом

связи – галогенные соединения
5.Тип: Углерод, его соединения (кроме
карбонатов) и близкие к ним вещества.
Среди выделенных типов отсутствует тип "элементарных (простых) веществ", обычно начинающий большинство известных минералогических систематик. Это вполне оправдано и необходимо, так как в тип элементарных веществ объединяют вещества с самыми различными видами химической связи – металлы, полуметаллы, неметаллы, полупроводники, молекулярные вещества. Общее между ними лишь то, что каждое из этих веществ состоит из атомов одного сорта. В то же время свойства, условия образования, парагенезис элементарных (самородных) веществ с различным типом связи не имеют практически ничего общего. Поэтому трудно построить систематику элементарных веществ так, чтобы получить естественный переход от них к минералам следующего таксона. Целесообразнее из выделявшегося ранее типа "элементарных (простых) веществ" вычленить самородные металлы, металлиды, полуметаллы и полуметаллиды в самостоятельный тип, что и сделано выше.
Слайд 96
При этом самородные металлы помещаются впереди соответствующих металлидов,
а полуметаллы - перед соответствующими полуметаллидами. Точно также самородные
неметаллы – S и Se, рассматриваются перед халькогенными соединениями, за счет которых они часто образуются.
Невозможность использования строго системного подхода при разработке классификации минералов проявилось уже в особом положении типа V среди всех перечисленных типов, в специфическом месте в систематике отдельных самородных минералов, о чем речь шла выше. Это же необходимо учитывать и при выделении последующих таксонов в каждом из типов, когда в основу их выделения приходится класть разные признаки, определяемые сложностью их состава, особенностями химической связи, кристаллических структур, свойств и условий образования соответствующих веществ.
Слайд 97
Так тип 1 делится на два подтипа:
1.1.
– металлы и металлиды,
1.2. – полуметаллы и полуметаллиды,
отражающие существенные различия в химической связи, структурах, свойствах тех и других. Последний, в свою очередь делится на 2 квазиподтипа:
1.2.1. – полуметаллы и полуметаллиды Vа-полуметаллов;
1.2.2. – полуметаллы и полуметаллиды VIа-полуметаллов.
Тип 2 сначала делится на два квазитипа, объединяющих резко различные по типу химической связи вещества:
2а. – элементарные (самородные) VIа-неметаллы, характеризующиеся остаточной связью;
2б. – халькогенные соединения, обладающие в основном металлически-ковалентной и ионно-ковалентной связью.
Далее квазитип 2б. делится на два подтипа:
2б.1. – халькогенные соединения сидеро- и халькофильных катионов;
2б.2. – халькогенные соединения литофильных катионов, отражающие существенные различия в составе, устойчивости в природных условиях, свойствах, условиях образования и пaрагенезисе минералов каждого из подтипов.
Слайд 98
В этом случае соблюдается и требование постепенного перехода

от одних таксонов к другим, поскольку некоторые минералы последнего
подтипа близки по составу, свойствам, условиям образования к минералам, начинающим следующий тип 3. Подтип 2б.1. в свою очередь делится на два квазиподтипа:
2б.1а. – сульфиды и сульфосоли сидеро- и халькофильных катионов;
2б.1б. – селениды и селеносоли сидеро- и халькофильных катионов, отражающие различия в свойствах, условиях образования и парагенезисе природных халькогенных соединений S и Se, хотя многие из них связаны непрерывными изоморфными переходами.
При этом надо помнить, что в минералах, относящихся к халькогенным соединениям чаще всего наблюдается постепенный переход от простых халькогенидов через сложные к халькосолям. Именно этим объясняется то, что одни авторы рассматривают все халькосоли в качестве сложных халькогенидов, тогда как другие настойчиво выделяют их в отдельные таксоны как халькосоли, являющиеся естественным завершением рядов типа простые халькогениды → сложные (двойные и т.п.) халькогениды → халькосоли.
Слайд 99
Тип 3 делится по принадлежности минералов к изо-
или анизодесмичеким соединениям прежде всего на два подтипа:
3.1.
– оксиды и гидроксиды (изодесмические),
3.2. – оксисоли (анизодесмические).
В зависимости от принадлежности катионов минералов первого из них к тому или иному типу он делится далее на шесть последовательно сменяющих друг друга квазиподтипов, что отвечает переходу от катионов с низкими СХ к катионам с высокими СХ, от литофильных катионов через халькофильные к катионам неметаллических элементов с наиболее высокими СХ:
3.1а – оксиды и гидроксиды литофильных катионов с низкими СХ,
3.1б – оксиды и гидроксиды литофильных катионов со средними СХ,
3.1в – оксиды и гидроксиды халькофильных катионов (кроме Vа- и VIа-катионов),
3.1г – оксиды и гидроксиды Va-катионов (As, Sb, Bi),
3.1д – оксиды и гидроксиды VIа-катионов (Те),
3.1е – оксиды и гидроксиды неметаллических (литофильных) катионов. Подтип же 3.2. делится непосредствено на классы.
Слайд 100
Тип 4 первоначально делится по тем же признакам

на два подтипа:
4.1. – галогениды (изодесмические) и
4.2.
– галогеносоли (анизодесмические).
Последний в зависимости от принадлежности анионообразователя к d- или p-катионам в свою очередь делится на два квазиподтипа:
4.2а. – галогеносоли с d-анионообразователями;
4.2б. – галогеносоли с p-анионообразователями.
Здесь необходимо обратить внимание на то, что большинство авторов, очевидно, по традиции, уходящей корнями в прошлый век, до сих пор рассматривает галогеносоли как сложные галогениды. При этом игнорируется факт чёткой обособленности в их структурах радикальных групп, например, тетраэдрических [BF4]-, [BeF4]2- , октаэдрических – [SiF6]2-, [AlF6]3-, полимерных – [BeF3]-, [B2F7]-, [Al3F14] 2- и др., многие из которых сохраняются и в растворах высоко растворимых галогеносолей. Некоторые галогенокислоты, например, H[BF4], как уже отмечалось, являются настолько сильными, что получили в химии название сверхкислот или магических кислот.
Слайд 101
Все это однозначно свидетельствует в пользу солевой природы
галогеносолей [6]. Непонимание этого привело, например У.Штрунца [24], к
рассмотрению галогеносолей не только в качестве сложных галогенидов, но и как изодесмических (!) соединений, к объединению по этому признаку всех галогенных соединений с оксидами. Скорее всего, именно с этим связано место, отводимое вплоть до последнего времени в минералогических систематиках галогенным соединениям между халькогенными и кислородными соединениями [23], [20], или между оксидами и оксисолями [17], хотя по типу химической связи, существованию среди галогенных соединений галогеносолей, они должны рассматриваться после кислородных соединений.
Последовательность типов: халькогенные → кислородные → галогенные соединения – отвечает, как уже отмечалось, закономерной смене в их представителях преимущественного типа связи в направлении металлически-ковалентная → ионно-ковалентная → ковалентно-ионная → ионная связь.
Слайд 102
Значительно сложнее по указанным выше причинам строится систематика
типа 5. Первоначально он делится на два квазитипа резко
различных по числу представителей:
5а. объединяет неорганические соединения, включая самородные IVа-неметаллы;
5б. – органические соединения.
Первый из них далее делится на два подтипа:
5а.1. – элементарные (самородные) IVа-неметаллы;
5а.2. – минералы преимущественно с ковалентной и металлически-ковалентной связью – карбиды, и близкие к ним соединения, силициды, нитриды и фосфиды.
Органические же соединения, в которых важнейшую роль играет остаточная связь, делятся далее на три подтипа:
5б.1. – соли органических кислот;
5б.2. – углеводороды и близкие к ним соединения;
5б.3. – природные смеси органических веществ, включая ископаемые смолы.
Слайд 103
Классы и их последовательность.
Классы соединений в химии с

начала прошлого века по предложению Й.Я.Берцелиуса выделяются по анионам.
Этот же подход сохраняется и в минералогии. Однако с точки зрения систематики важны два вопроса:
1) какую часть формулы соединения, и на каком основании следует рассматривать в качестве аниона;
2) какой должна быть последовательность рассмотрения отдельных классов, какое место в ней должны занимать соединения с несколькими анионами – арсенидо-сульфиды, сульфидо-галогениды, силикато-карбонаты, силикато-фториды, арсенато-сульфаты и т.п.
Для соединений с простыми анионами типа S2- , O2-, F-, Cl-, даже полиядерными типа [S2]2-, [As4]4-, и т.п., вопрос о выделении аниона очевиден и его можно не затрагивать. Не менее ясен он и для соединений с комплексными анионами типа [SiO4]4-, [SO4]2-, [CO3]2-, в том числе c полимерными [Si6O18]12-, [Si2O5]2- и т.п., в которых анионообразователи имеют наименьшее из возможных координацинных чисел, т. е. проявляют свои кислотные свойства в максимальной мере.
Слайд 104
Однако, дело усложняется для амфотерных анионообразователей, когда требуется

провести границу между двойными (сложными) соединениями и солями с
комплексными анионами, поскольку анионообразователи могут в зависимости от кислотно-основных свойств иметь разные КЧ.
Выше было показано, что в качестве катионов-анионообразователей (комплексообразователей) в минералах могут выступать катионы трёх групп, каждая из которых отвечает минералам определенного парагенезиса, намечая свою специфичеcкую последовательность смены минералов в зависимости от изменения кислотно-основной обстановки, окислительного потенциала.
1. Катионы - комплексообразователи литофильных элементов с низкими - средними СХ, включающие:
а). Катионы некайносимметричных d'-комплексообразователей с
низкими - средними СХ - (12)Zr4+, (6)Zr4+, (6)Ta5+, (6)Nb5+,
(6)W6+, (4)Ta5+ , (6)Mo6+, (6)Nb5+, (4)W6+, (4)Mo6+.
б). Катионы кайносимметричных d'-комплексообразователей с
средними СХ - (6)Ti4+, (6)V4+, (4)Ti4+, (6)V5+, (4)V4+, (4)V5+, (4)Cr6+,
(4)Mn7+.
Слайд 105
Они входят в состав кислородных соединений – сложных

оксидов и оксисолей, находящихся преимущественно в изверженных породах, связанных
с ними пегматитовых и гидротермальных жилах, продуктах их метаморфизма и выветривания. Переход от сложных оксидов к оксисолям отвечает увеличению кислотности катиона-комплексообразователя, уменьшению его КЧ от 6 через 5 до 4. Таким образом, можно наметить тесно генетически связанные ряды минералов типа: (6)-ванадаты → (5)-ванадаты → (4)-ванадаты, в которых первые их члены относятся к характерным сложным оксидам, а последние являются типичными оксисолями, в том числе и довольно сильных кислот, к которым можно отнести (4)-ванадаты и тем более (4)-арсенаты. Замыкают эти вещества (4)-хроматы и (4)-перманганаты, являющиеся уже оксисолями очень сильных кислот.
Многие из рассматриваемых катионов-комплексообразователей входят в состав генетически связанных друг с другом минералов, относящихся к единому парагенезису, например, титанаты и танталониобаты щелочных и редкометальных гранитных пегматитов, а (6)Zr4+ , (6)Ti4+ ,(5)Ti4+, (6)Ta5+, (6)Nb5+ и т.п. катионы являются типичными для смешанных анионных радикалов типа цирконо-, титано-, ниобо-, танталосиликатных, особенно характерных для парагенезисов агпаитовых горных пород и их дериватов.
Слайд 106
2. Халькофильные катионы-комплексообразователи (в основном катионы халькофильных элементов

со средними СХ) - (6)Sb3+, (6)Bi3+, (6)As3+, (6)Te4+, (4)As3+,
(4)Te4+, (3+Е)Sb3+, (3+Е)Bi3+, (3+Е)As3+, (6)Sn4+, (6)Bi 5+, (6)Sb5+, (6)Ge4+, (6)Te6+, (4)Sb5+, (6)As5+, (4)Ge4+, (4)As5+, (4)Se6+; катионы (6)Sb3+, (6)Bi3+, (6)As3+, (6)Te4+, (4)As3+, (4)Te4+, (3+Е)Sb3+, (3+Е)Bi3+, (3+Е)As3+, (6)Sn4+, выступают также как катионы халькофильных элементов с низкими СХ (гр. 4.а). Они типичны для парагенезисов двух типов. Один из них характеризуется первичными минералами, в которых в качестве лигандов выступают S и Se. Указанные катионы-комплексообразователи входят в состав сложных халькогенидов и халькосолей сульфидных залежей магматогенного, вулканогенного и метаморфогенного происхождения, различных гидротермальных жил, генетически связанных чаще всего с кислыми породами. Другой, типичный для них парагенезис, образуется в зоне окисления указанных первичных парагенетических ассоциаций минералов и для него характерны как сложные оксиды, так и оксисоли вплоть до солей относительно сильных оксикислот типа мышьяковой.
Слайд 107
3. p-Анионообразователи (катионы легких и тяжелых анионообразователей) –
(4)Si4+, (4)B3+, (4)P5+, (3)B3+, (4)S6+, (4)Cl7+, (3)C4+, (3)N5+, (4)S4+,
(3)I5+, (3)Br5+ типичны для минеральных парагенезисов магматических и изверженных пород, их пегматитов (силикаты, некоторые фосфаты, карбонаты, бораты), скарнов (силикаты, бораты, карбонаты), гидротермальных жил (особенно карбонаты и некоторые сульфаты), вулканических эксгаляций (сульфаты, галогениды, галогеносоли), кор выветривания (силикаты), морских осадков (галогениды, сульфаты, карбонаты, фосфаты, бораты), эвапоритов (бораты, галогениды), зон окисления (карбонаты, сульфаты, нитраты и др.).
Таким образом, каждая из приведенных групп катионов-анионообразователей входит в состав минералов своего парагенезиса, как бы образуя свою генетическую ветвь.
Слайд 108
Граница сложные соединения → соли для соединений различных

типов проходит по-разному, определяясь в первую очередь фундаментальными свойствами
образующих их атомов - их СХ и Z [5], [7].
В то же время не верно относить к соединениям определенного класса вещества только на основании их брутто-формулы, не учитывающей их структуры. Так до сих пор практически все авторы относят кислородные соединения, содержащие Te6+, к солям теллуровой кислоты или теллуратам, рассматривая их в качестве аналогов сульфатов в тесной связи с последними. На первый взгляд это вполне естественно, особенно, если опираться на примитивно-прямолинейное представление об аналогии свойств элементов в рамках отдельных подгрупп периодической системы, например, выражающееся, в объединении O, S, Se, Te и Po в "халькогены", и не учитывающее различий кайно- и некайносимметричных элементов [1], [2], [3], неметаллических и полуметаллических элементов, элементов шелл- и шринк-аналогов, отличающих их от не шелл- и не шринк-аналогов [3], [17].
Слайд 109
К такому подходу толкает и сходство брутто-формул серной,

селеновой и так называемой теллуровой кислот – H2SO4, H2SeO4
и H2TeO4 соответственно. Однако, если первые два соединения полностью отвечают структурным представлениям о кислотах, поскольку содержат обособленные тетраэдрические комплексные радикалы [SO4]2- или [SeO4]2- с КЧ S и Se, равным 4, что дает основание к написанию их структурных формул в виде H2[SO4] и H2[SeO4], этого нельзя сказать о "теллуровой кислоте". Исследование этого соединения не обнаружило в его структуре анионных групп [TeO4]2- с КЧ Te = 4. Вместо этого было установлено, что ионы Te6+ имеют КЧ = 6, т.е. отвечают КЧ амфотерных или слабо кислых анионообразователей. Структура же этого соединения оказалась состоящей из цепочек TeO4(OH)2 - октаэдров, в двух противоположных вершинах которых находятся OH-ионы, связанные друг с другом общими атомами O экваториальных вершин октаэдров [25]. Легко видеть, что, вырезав элемент повторяемости такой структуры, получим структурную формулу в виде Te(OH)2O2. Таким образом, это соединение является гидроксидо-оксидом Te6+ с очень слабо кислыми свойствами, резко отличающими его от серной и селеновой кислот.
Слайд 110
Поэтому его целесообразнее рассматривать не среди кислот и

их солей в подтипе 3.2. – оксисолей, а в
заключение подтипа 3.1. – оксидов и гидроксидов как соединение с переходными свойствами от оксидов и гидроксидов к кислотам и солям. Этого вывода не изменяет и существование также называемой теллуровой кислоты с формулой Te(OH)6 или H6TeO6, для которой также характерна октаэдрическая координация Te. Различные полимерные группы, обнаруженные и в ее солях [25], близки по этому и другим свойствам к сложным оксидам.
Свойства SO3, SeO3, H2SO4, H2SeO4 с одной стороны, и TeO3, Te(OH)6 или H6TeO6 – с другой, резко различаются. Так, SO3 при нормальных условиях – газ (Т кип. 44,8оC), ниже 16,8оC– прозрачная льдовидная масса энергично взаимодействующая с водой, с образованием серной кислоты H2[SO4], с pKа = 1,94. SeO3 – твердое стекловидное вещество (Т пл. 118,5оC; Т кип. 185оC); взаимодействующее с водой с образованием селеновой кислоты H2 [SeO4] с pKа = 1,92. TeO3– твердое инертное вещество. Холодная вода и разбавленные щелочи на него не действуют (Т пл. выше 400оC). Получается дегидратацией H6TeO6 в атмосфере кислорода в присутствии H2[SO4] концентрированной. На первом этапе дегидратации H6TeO6 получается TeO2 (OH)2. H6TeO6 – слабая кислота с pKа = 7,61.
Слайд 111
Все это естественно, т.к. S и Se связанны

шринк-аналогией, что сближает их свойства, тогда как Te отличается
от них, не будучи их шринк-аналогом. Это отвечает и приведенной выше систематике катионов, в соответствии с которой типичный для Te в минералах катион (6)Те6+ относится к халькофильным катионам со средними СХ, заметно отличаясь в этом отношении от (4)S6+ и (4)Se6+, для которых КЧ = 6 в минералах не установлено. Шринк-аналогия S и Se и не шринк-аналогия с ними Te проявляется и в элементарных веществах, среди которых S и Se являются неметаллами, тогда как Te - полуметалл. Поэтому и соли теллуровой кислоты или теллураты должны рассматриваться как сложные оксиды, содержащие (6)Te6+ , что подтверждается результатами исследования их кристаллических структур. В качестве примера к сказанному можно привести минерал яфсоанит. Авторами, открывшими его [11], было высказано мнение, что он "относится к группе теллуратов и является сложной солью теллуровой кислоты" с формулой (Zn1,38 Ca1,36 Pb0,26)∑3TeO6. Иследование его структуры [21] показало, что структурная формула яфсоанита имеет вид (8)Ca3 (6)Te2 [(4)ZnO4]3 и он должен рассматриваться как сложный оксид - цинкат со структурой, аналогичной структуре граната, в которой роль Si играет Zn, а Te выступает в роли типичного катиона - Al. В этом отношении яфсоанит аналогичен изоcтруктурным синтетическим сложным оксидам, называемым гранатитами, с общей формулой (8)R3+3(6)M3+2[(4)X3+O4]3, где R3+= Y, Ln; M3+, X3+= Fe, Al, Ga.
Слайд 112
Аналогичные причины тем более заставляют рассматривать соедининия Te4+,

часто называемые теллуритами, среди сложных оксидов, к которым А.А.Годовиковым
по тем же причинам отнесены также арсениты, антимониты и антимонаты.
К сложным оксидам, рассматриваемым в их заключение, отнесены также соединения с d-оксорадикалами, даже с тетраэдрической координацией анионообразователя – ванадаты, молибдаты, вольфраматы, поскольку соответствующие "кислоты" и "ангидриды" не только яляются твердыми веществами с октаэдрической координацией V5+ , Mo6+, W6+, но и обладают очень слабо кислотными свойствами, более слабыми, чем кремневые кислоты. Такое положение рассматриваемых веществ представляется тем более обоснованным, что отражает естественные связи их со сложными оксидами, в которых КЧ электороотрицательных катионов (в том числе V5+ , Mo6+, W6+) постепенно меняется от 6 через 5 к 4. В этом проявляются существенные химические различия в свойствах d- и p-элементов, как анионообразователей, заставляющие вычленять ванадаты из класса фосфатов и арсенатов, а молибдаты и вольфраматы из класса сульфатов и селенатов, в которых они обычно рассматриваются по столь общему признаку, как групп-аналогия, формальному сходству оксорадикалов.
Слайд 113
Из d-элементов особое место в этом отношении занимают

лишь кайносимметричные Cr и Mn в высшей степени окисления,
кислородные соединения которых относятся к сильным ангидридам (кислотам), образующим типичные соли с гетеродесмическими связями – хроматы и перманганаты. Поэтому они рассматриваются, вслед за сульфатами.
В более ранних систематиках в последовательности классов в подтипе оксисолей нет единого и сколько нибудь обоснованного подхода. Видна разница в положении отдельных классов, у разных авторов. К сожалению объяснений принятой последовательности не даётся.
В классификации А.А.Годовикова оксисоли появляются уже в конце класса оксидов и гидроксидов, которые заканчиваются минералами семейства кремнезёма. Естественно за ними поместить класс силикатов – оксисолей наиболее слабых оксикислот, начиная его с алюмосиликатов, структуры многих из которых являются производными от структур различных полиморфов кремнезёма. Связь между свойствами и условиями образования минералов семейства кремнезёма и силикатами настолько значима, что некоторые минералоги семейство кремнезёма помещали в один класс с силикатами, исключая его из оксидов [22], [12].
Слайд 114
К сложным оксидам силикаты близки не только потому,

что они соли очень слабых кремневых кислот, но и
по таким свойствам как низкая растворимость, высокие температуры плавления, а многие из них еще и потому, что содержат в своей структуре полимерные радикалы, что сближает их со многими титанатами, тантало-ниобатами и т.п. минералами.
Оксиды и силикаты литофильных элементов, как правило, образуются в эндогенных, часто высокотемпературных, процессах; для оксидов и силикатов халькофильных элементов наиболее обычно образование в условиях зоны окисления.
Дальнейшую последовательность расположения классов целесообразно подчинить последовательности смены солей, отвечающей увеличению силы кислот, образующих эти соли. Такая последовательность в целом отвечает увеличению степени ионности связи между катионами и кислотными радикалами, уменьшению роли полимерных радикалов в солях, повышению их растворимости, изменению условий образования с гипогенных на все более и более низкотемпературные, вплоть до поверхностных, закономерному изменению многих физических свойств соответствующих минералов.
Слайд 115
Эта последовательность нарушается в классе боратов, влючающем минералы,

в которых КЧ B в оксирадикалах может быть 4;
3; 4 и 3. Поэтому предложено [4] делить бораты на 3 квазикласса: 1) (4)-бораты, 2) (3)-бораты, 3) (4)-(3)-бораты, рассматривая их в систематике в указанной последовательности. Первые из них структурно наиболее близки к силикатам; радикальные группы (4)-боратов могут поликондесироваться с кремнекислородными радикалами, образуя единые гетероядерные полимерные радикалы боросиликатов. (4)-Бораты характерны для гипогенных условий; их образованию благоприятствует высокое давление, повышенная щелочность. (3)-Бораты также преимущественно гипогенные минералы, тогда как для (4)-(3)-боратов характерно образование при упаривании морской или озерной воды с образованием эвапоритов, в некоторых корах выветривания, редко в низкотемпературных гидротермальных жилах. Поэтому принимается следующая последовательность рассмотрения отдельных классов оксисолей с литофильными p-анионообразователями (в скобках указаны величины pKa и формулы кислот, для которых они определены [13], для многоосновных кислот приведен кислотный показатель первой ступени диссоциации):
Слайд 117
Отнесение минерала к определенному классу оксисолей оказывается спорным,
когда в его состав входят несколько разных анионных радикалов,
например, [SiO4]4- и [PO4]3- ; [CO3]2- и [SO4]2- ; [CO3]2- и F-, т.е. когда минерал оказывается смешанной солью [5]. При этом к смешанным солям не относятся:
а) соединения включения, имеющие структуру с крупными полостями, в которых и находятся дополнительные анионы, иногда вместе с катионами (оксиды Mn с туннельными структурами типа голландита, минералы серии канкринит-вишневит, цеолиты);
б) минералы с гибридными структурами, в которых отдельные слои представляют собой нейтральные или
Слайд 118
слабо заряженные пачки, включающие в свой состав "инородный"
анион (тундрит, ломоносовит и т.п. минералы).
До сих пор предлагалось
относить такие минералы к определенному классу по наиболее сильному аниону [4], [5].
Однако, моделирование разработанной систематики в экспозиции Минералогического музея им.А.Е.Ферсмана РАН показало, что с парагенетической точки зрения удобнее поступать наоборот, относя минерал - смешанную соль к тому или иному классу по аниону наиболее слабой кислоты.
Слайд 119
Последовательность высших таксонов в разработанной структурно-химической систематике минералов.
1.
Тип: Минералы преимущественно с металлическим и металлически-ковалентным типом связи
- самородные металлы и полуметаллы, металлиды и полуметаллиды.
1.1. Подтип: Металлы и металлиды.
1.1.1. Класс: Металлы и металлиды сидеро- и халькофильных элементов.
1.1.2. Класс: Металлы и металлиды литофильных элементов.
1.2. Подтип: Полуметаллы и полуметаллиды (только сидеро- и халькофильных катионов).
1.2.1. Квазиподтип: Полуметаллы и полуметаллиды Va-полуметаллов.
1.2.1а. Класс: Самородные Va-полуметаллы.
1.2.1б. Класс: Va-Полуметаллиды – арсениды, антимониды, висмутиды.
1.2.2. Квазиподтип: Полуметаллы и полуметаллиды VIа-полуметаллов.
1.2.2а. Класс: Самородные VIa-полуметаллы .
1.2.2б. Класс: VIa-полуметаллиды – теллуриды.
Слайд 120
2. Тип: Минералы преимущественно с металлически-ковалентным и ионно-ковалентным,
редко с остаточным типом связи – халькогенные соединения и
самородные VIа-неметаллы.
2а. Квазитип: Элементарные (самородные) VIа-неметаллы (остаточная связь).
2б. Квазитип: Халькогенные соединения (металлически-ковалентная и ионно-ковалентная, редко остаточная связь) - простые (изодесмические) ? сложные ? халькосоли (анизодесмические).
2б.1. Подтип: Халькогенные соединения сидеро- и халькофильных катионов.
2б.1а. Квазиподтип: Сульфиды и сульфосоли сидеро- и халькофильных катионов.
2б.1а.1. Класс: Сульфиды сидеро- и халькофильных катионов.
2б.1а.2. Класс: Сульфосоли сидеро- и халькофильных катионов.
2б.1б. Квазиподтип: Селениды и селеносоли сидеро- и халькофильных катионов.
2б.1б.1. Класс: Селениды сидеро- и халькофильных катионов.
Слайд 121
2б.1б.2. Класс: Селеносоли сидеро- и халькофильных катионов
2б.2.
Подтип: Халькофильные соединения литофильных катионов.
2б.2.1. Класс: Сульфиды (и селениды)
литофильных катионов.
2б.2.2. Класс: Сульфосоли литофильных катионов.
2б.1б.1. Класс: Селениды сидеро- и халькофильных катионов.
3. Тип: Минералы преимущественно с ионно-ковалентным и ковалентно-ионным типом связи - неметаллиды легкого (типического, кайносимметричного) VIa-элемента (О) - кислородные соединения.
3.1. Подтип: Оксиды и гидроксиды (изодесмические).
3.1а. Квазиподтип: Оксиды и гидроксиды литофильных катионов с низкими СХ.
3.1а.1. Класс: Оксиды и гидроксиды s-, ds- и ps-катионов.
3.1а.2. Класс: Оксиды и гидроксиды f-катионов с низкими СХ – 4-х валентных f-катионов.
Слайд 122
3.1а.3. Класс: Оксиды и гидроксиды f-катионов со средними
СХ – 6-ти валентных f-катионов (U6+ ) ? соединения
уранила (UO2)2+ - ураниловые кислоты, уранаты и их производные (урановые слюдки и близкие к ним минералы).
3.1б. Квазиподтип: Оксиды и гидроксиды литофильных катионов со средними СХ.
3.1б.1. Надкласс: Оксиды Zr .
3.1б.1а. Класс: Простые оксиды Zr.
3.1б.1б. Класс: Сложные оксиды Zr ? титанаты циркония ? цирконотитанаты.
3.1б.2. Надкласс: Оксиды Sn4+ и Ti4+.
3.1б.2а. Класс: Оксиды и гидроксиды Sn4+ и Ti4+.
3.1б.2б. Класс: Сложные оксиды Ti4+ (Sn4+) ? титанаты (станнаты), только (6)-титанаты , (6)-станнаты).
Слайд 123
3.1б.3. Надкласс: Оксиды и гидроксиды Nb5+ и Ta5+.
3.1б.3а.
Класс: Простые оксиды и гидроксиды Nb5+ и Ta5+ .
3.1б.3б.
Класс: Сложные оксиды Nb5+ и Ta5+ ((6)-танталониобаты ? (4)-танталониобаты).
3.1б.4. Надкласс: Оксиды и гидроксиды Mo и W .
3.1б.4а. Класс: Простые оксиды и гидроксиды Mo и W .
3.1б.4б. Класс: Сложные оксиды и гидроксиды Mo и W ((6)-молибдаты и вольфраматы → (4)-молибдаты и вольфраматы).
3.1б.5. Надкласс: Оксиды и гидроксиды Mn4+ .
3.1б.5а. Класс: Простые оксиды и гидроксиды Mn4+ .
3.1б.5б. Класс: Сложные оксиды и гидроксиды Mn4+ .
3.1б.6. Надкласс: Оксиды и гидроксиды V4+ .
3.1б.6а. Класс: Простые оксиды и гидроксиды V4+ .
3.1б.6б. Класс: Сложные оксиды и гидроксиды V4+ (ванадиты).
3.1б.7. Надкласс: Оксиды и гидроксиды V5+ .
3.1б.7а. Класс: Простые оксиды и гидроксиды V5+ .
Слайд 124
3.1б.7б. Класс: Сложные оксиды и гидроксиды V5+ ((6)-ванадаты
? (5)-ванадаты ? (4)-ванадаты).
3.1б.7б.1. Квазикласс: (6)-Ванадаты.
3.1б.7б.2. Квазикласс: (5)-Ванадаты.
3.1б.7б.3. Квазикласс:
(4)-Ванадаты.
3.1в. Квазиподтип: Оксиды и гидроксиды халькофильных катионов (кроме Vа- и VIа-катионов).
3.1в.1. Надкласс: Оксиды и гидроксиды Iб-катионов.
3.1в.2. Надкласс: Оксиды и гидроксиды IIб-катионов.
3.1в.3. Надкласс: Оксиды и гидроксиды IIIa-катионов.
3.1в.4. Надкласс: Оксиды и гидроксиды IVa-катионов.
3.1г. Квазиподтип: Оксиды и гидроксиды Va-катионов.
3.1г.1. Надкласс: Оксиды и гидроксиды As3+ , Sb3+ , Bi3+ .
3.1г.1а. Класс: Простые оксиды и гидроксиды As3+, Sb3+, Bi3+.
3.1г.1б. Класс: Сложные оксиды и гидроксиды As3+, Sb3+, Bi3+ ? (6)- Арсениты, антимониты, висмутиты.
Слайд 125
3.1г.2. Надкласс: Оксиды и гидроксиды Sb5+, Bi5+(все сложные)
?антимонаты и висмутаты (только (6)-антимонаты и (6)-висмутаты).
3.1д. Квазиподтип: Оксиды
и гидроксиды VIа-катионов (Те).
3.1д.1. Надкласс: Оксиды и гидроксиды Те4+.
3.1д.1а. Класс: Простые оксиды и гидроксиды Те4+.
3.1д.1б. Класс: Сложные оксиды и гидроксиды Те4+→теллуриты.
3.1д.2. Надкласс: Оксиды и гидроксиды Те6+ (все сложные) → теллураты (все (6)-теллураты).
3.1е. Квазиподтип: Оксиды и гидроксиды неметаллических (литофильных) элементов.
3.1е.1. Класс: Оксиды и гидроксиды Si (кремневые ангидриды и кремневые кислоты).
3.1е.2. Класс: Оксиды и гидроксиды B (борный ангидрид и борные кислоты) .
3.1е.3. Класс: Оксиды и гидроксиды Se (селенистый ангидрит).
Слайд 126
3.2. Подтип: Оксисоли (анизодесмические).
3.2.1. Класс: Силикаты.
3.2.2. Класс: Бораты.
3.2.2.1. Квазикласс: (4)-Бораты.
3.2.2.2. Квазикласс: (3)-Бораты.
3.2.2.3. Квазикласс: (4)-(3)-Бораты.
3.2.3. Класс: Карбонаты.
3.2.4.
Класс: Фосфаты.
3.2.4.1. Квазикласс: Ортофосфаты.
3.2.4.2. Квазикласс: Пирофосфаты.
3.2.4.3. Квазикласс: Трифосфаты.
3.2.4а.Класс: Арсенаты.
3.2.4а.1. Квазикласс: (6)-Арсенаты.
3.2.4а.2. Квазикласс: (4)-Арсенаты (ортоарсенаты).
3.2.4б. Класс: Арсениты.
3.2.5. Класс: Сульфаты.
3.2.6. Класс: Сульфиты.
Слайд 127
3.2.6а. Класс: Селениты.
3.2.7. Класс: Хроматы.
3.2.8. Класс: Нитраты.
3.2.8а. Класс:
Иодаты.
3.2.8б. Класс: Иодиты.
3.2.8в. Класс: Роданаты (тиоцианаты).
4. Тип: Минералы преимущественно
с ковалентно-ионным и ионным типом связи – галогенные соединения.
4.1. Подтип: Галогениды (изодесмические).
4.1.1. Класс: Фториды.
4.1.2. Класс: Хлориды, бромиды.
4.1.2а. Класс: Иодиды.
4.2. Подтип: Галогеносоли (анизодесмические) (с гексацианоферратами и гексатиоцианитами, родонидами) .
4.2а. Квазиподтип: Галогеносоли с d-анионообразователями.
Слайд 128
4.2а.1. Класс: Хлороферриты и хлорокуприты (только s-катионов и
NH+4).
4.2а.2. Класс: Гексахлороферраты и гексахлороманганаты (только s-катионов).
4.2б. Квазиподтип: Галогеносоли
с р-анионообразователями.
4.2б.1. Класс: Фтороалюминаты (только s-катионов).
4.2б.2. Класс: Фторобораты (только s-катионов).
4.2б.3. Класс: Фторосиликаты (только s-катионов и NH4+).
4.2б.4. Класс: Хлороалюминаты (только s-катионов).
5. Тип: Углерод, его соединения (кроме карбонатов) и близкие к ним вещества.
5а. Квазитип: Неорганические соединения (кроме карбонатов) и близкие к ним вещества.
5а.1. Подтип: Самородные минералы.
5а.2. Подтип: Минералы с преимущественно ковалентной и металлически-ковалентной связью – карбиды и близкие к ним соединения – силициды, нитриды и фосфиды.
Слайд 129
5а.2.1. Класс: Карбиды.
5а.2.1а. Класс: Силициды.
5а.2.2. Класс: Нитриды.
5а.2.2а. Класс: Фосфиды.
5б. Квазитип: Органические соединения.
5б.1. Подтип: Соли
органических кислот.
5б.1.1. Класс: Соли бензополикарбоновых кислот
( С6H6-n (COOH)n; n = 6 ).
5б.1.2. Класс: Цитраты. 5б.1.3. Класс: Ацетаты. 5б.1.4. Класс: Оксалаты. 5б.1.5. Класс: Формиаты.
5б.2. Подтип: Углеводороды и близкие к ним соединения.
5б.2.1. Класс: Углеводороды циклические (по мере уменьшения х = Н : С).
5б.2.2. Класс: Углеводороды кислородсодержащие (по мере увеличения О : С).
5б.2.3. Класс: Азотсодержащие органические вещества.
5б.3. Подтип: Смеси органических веществ, в том числе ископаемые смолы.
Слайд 130
Критерии выделения таксонов в структурно-химической систематике минералов А.А.Годовикова
представлены в таблице.
Слайд 141
Литература:
1а.Барсанов Г.П. (19590 Принципы современной классификации минералов. Тр.

Минералогического музея. М. Изд-во АНСССР. Вып. 9. стр.3-18.
1.
Бокий Г.Б., Голубкова Н.А. (1989). Введение в номенклатуру ИЮПАК. М.,
Наука, 184 с.
2. Годовиков А.А. (1981). Замечания к номенклатурным правилам ИЮПАК
по химии (том 1, полутом 1). ЖНХ, вып. 4, сс. 1159 – 1164.
3. Годовиков А.А. (1982). Периодическая система Д.И.Менделеева и
силовые характеристики элементов. Новосибирск, Наука, 96 с.
4. Годовиков А.А. (1983). Минералогия, 2-е изд. М., Недра, 648 с.
5. Годовиков А.А. (1983). Смешанные соли и их место в систематике
минералов Геология и геофизика, № 12, сс.3 – 15.
6. Годовиков А.А. (1984). Галогеносоли - определение, особенности
структуры, место в минералогической систематике, общие черты генезиса.
Геология и геофизика, № 7, сс. 42 – 54.
7. Годовиков А.А. (1989). О связи свойств элементов со структурой и
свойствами минералов. М., Наука, 118 с.
8. Годовиков А.А. (1993). Использование электроотрицательностей при
систематике минералов и неорганических веществ. Журн.неорг.химии, т. 38,
№ 9, сс. 1468 – 1482.
Слайд 142
9. Годовиков А.А. (1997). Структурно-химическая систематика минералов. М.

РАН.
Минмузей им. А.Е. Ферсмана. 247 с.
10. Годовиков
А.А., Ненашева С.Н. (2007). Структурно-химическая систематика минералов. М. Изд-во Экост. 296 с.
РАН. Минмузей им. А.Е. Ферсмана.
11. Ким А.А., Заякина Н.В., Лаврентьев Ю.Г. (1982). Яфсоанит (Zn1,38 Ca1,36
Pb0,26)3 TeO6 - новый минерал теллура. ЗВМО, вып. 1, сс. 118 – 121.
12. Лазаренко Е.К. (1971). Курс минералогии. М., Высшая школа, 608 с.
13. Лурье Ю.Ю. (1979). Справочник аналитической химии. М., Химия, 480 с.
14. Номенклатурные правила ИЮПАК по химии. (1979). М., ВИНИТИ, т. 1,
полутом 1.
15. Поваренных А.С. (1966). Кристаллохимическая классификация
минеральных видов. Киев, Наукова Думка, 548 с. Transl. Povarennykh A.S.
Crystal chemical classification of minerals. N.Y. - L., Plenum Press. 1972. V.1, 1 –
458 p., V.2, 459 - 766 p.
16. Щукарев С.А. (1970 - 1974). Неорганическая химия. М., Высшая школа, т. 1, 352 с.,
т. 2, 382 с.
17. Clark A.M. Hey,s mineral index, 3-rd Ed.. L., Chapman and Hall, 1993, 852 p.
18. Dana E.S. (1892). The system of mineralogy of James Dwight Dana 1837 - 1868. N.Y.,
John Wiley & Sons, Inc. L., Chapman & Hall, Ltd.

































![Систематика минералов Класс: хроматы.Хроматы простые безводные. Подкласс. I. С изолированными группами [СгО4]-2: группа крокоита.С](/img/tmb/12/1108374/7b2cd1b164feb7657d5871fe066625b5-720x.jpg)


![Систематика минералов С комплексными анионами: группа ганксита.С кристаллизационной водой. Типа A′′n[SO4]p·х ОН·qН2О: группа вернадскита—натрохальцита.](/img/tmb/12/1108374/277eae7b6805dddf7c4e201af7526dd6-720x.jpg)











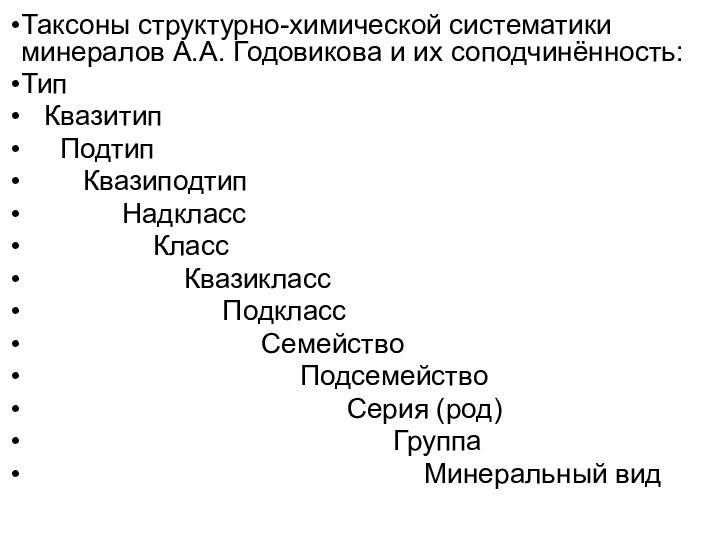











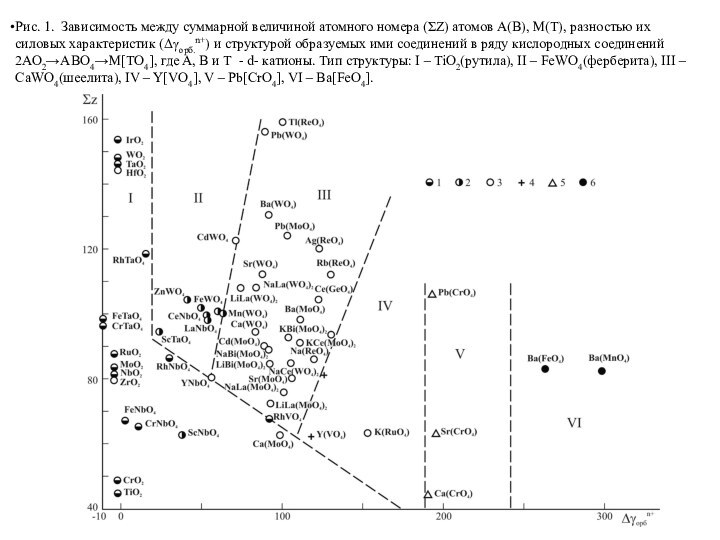

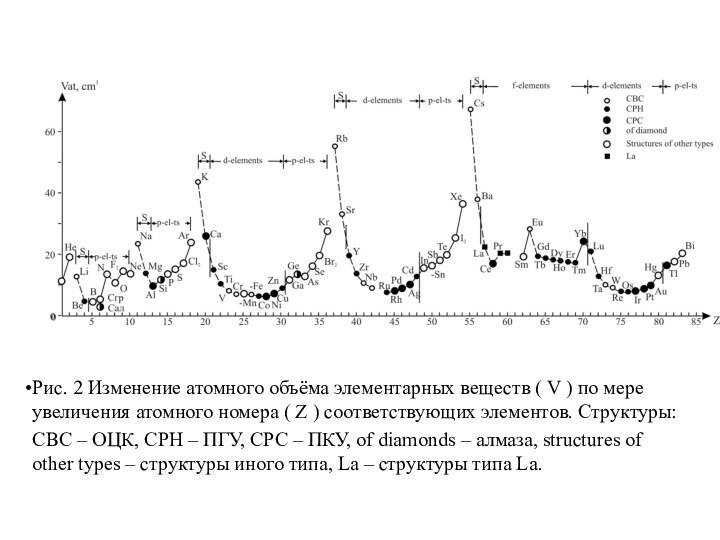



















![Систематика минералов Класс (4)-Ванадаты (3,74; H3[VO4])Класс (4)-Молибдаты (2,54; H2[MoO4])Класс (4)-Вольфраматы (2,20; H2[WO4]) Класс (4)-Хроматы](/img/tmb/12/1108374/bb3fc25029128917eeb84da520e893c2-720x.jpg)




![Систематика минералов Класс (6)-Арсениты (9,23; H3AsO3)Класс (4)-Германаты (9,10; H2[GeO4]) – рассматриваются вслед за силикатами](/img/tmb/12/1108374/8d90d5e9d10c30e9561f07c9185ef47f-720x.jpg)












![Систематика минералов Все это однозначно свидетельствует в пользу солевой природы галогеносолей [6]. Непонимание этого](/img/tmb/12/1108374/c2a429cdad28173fa9b9c0ef53831fd9-720x.jpg)