№247 орта мектеп
10 – сынып
Химия пәнінің мұғалімі: Байжанова Жанар
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






















5). Темірдің құймасы
С ы н а п
М ы с
Х р о м
А л т ы н
Ш о й ы н
ІІ. Мырыштың жалпы сипаттамасы:
+30 Zn 1 s 2 2s 2 2p 6 3s 2 sp6 3d 10 4s2
Графиктік түрі
IV
IIІ
II
I
S P d
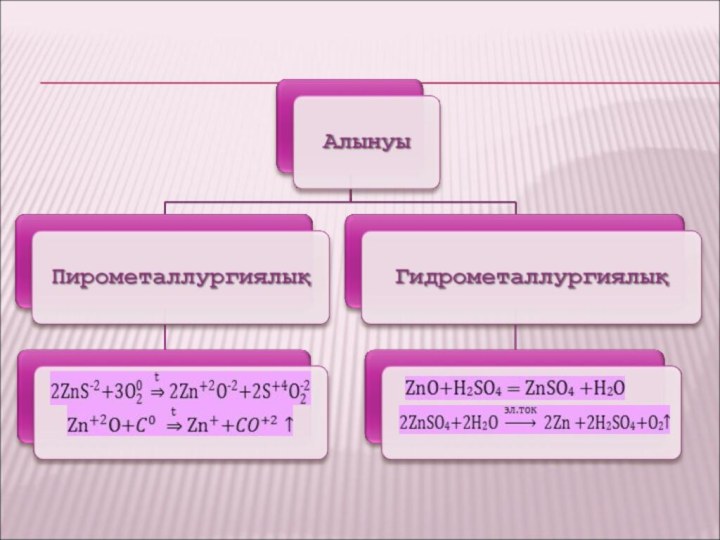
ІҮ. Алынуы
Кенді өртеу арқылы:
2ZnS + 3O2 → 2ZnO + 2SO2
Көміртекпен тотықсыздандыру:
ZnO+ C → Zn + CO
Гидрометалургия арқылы:
ZnO + H2SO 4 → ZnSO4 + H2O
Электролиз кезінде түзімді:
2ZnSO4 + 2H2O →3Zn + 2H2SO4 + O2↑
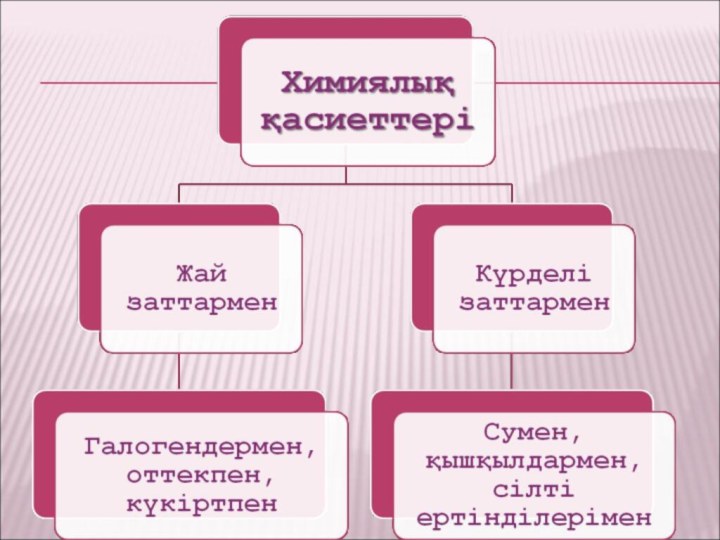
VI Химиялық қасиеттері
Жай заттармен әрекеттесуі
Zn + Cl 2 → Zn Cl2
2Zn + O2 → 2 ZnO
Zn + S → ZnS
Күрделі заттармен әрекеттесуі
Zn + H2 O → ZnO + H2 ↑
Zn +2H Cl → ZnCl 2 + H2 ↑
Мырыш екідайлы қасиет көрсетеді,
ол қышқылдармен де, сілтімен де
әрекеттеседі ол қышқылдармен де,
сілтімен де әрекеттеседі:
Zn + 2 Na OH→ Na 2 ZnO2 + H2
(крист ) натрий цинкаты
2 – топ
Мына өзгерістерді жүзеге асырыңдар:
↓
/4 ұпай/
6,5 г мырыштың тұз қышқылымен әрекеттесуінен алынған сутек газы қанша грамм мыс(ІІ)оксидін тотықсыздандырады?
/5 ұпай/
- 2
+ 2
+ 4
+ 3
+ 1
4. Мырыш гидроксиді мен әрекеттесетін заттар қатары
CO2, Ca(OH)2
ZnSO3, Fe2O3
H2SO4,ROH
P2O5, Cu(OH)2
5. 6,5 г мырыш пен 6,5 күкірт қыздыру нәтижесінде түзідген мырыш сульфидінің массасы
8,7 г
7,6 г
9,6 г
9,7 г
8,6 г
8. өзгерістеріндегі “х” , “ү” заты
Х – NO, y-H2O
X – HNO3 , y – CH4
X - HNO3, y – K2CO3
x – N2, y - C
X – NH3, y-CO
9. ZN + S ⟶ZnS реакция теңдеуі бойынша күкіртпен 5г мырыш әрекеттескенде қанша грамм мырыш сульфиді түзіледі?
7,46 г
6,46 г
5,46 г
3,46 г
2,46 г
10. 2 моль мырыш тұз қышқылымен толығымен әрекеттескенде қаша грамм тұз түзіледі.Мырыш сульфидін түзетін заттар
372
272
172
472
572