Слайд 3
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки играют фундаментальную роль в
формировании и поддержании структуры и функций живых организмов.
Это
высокомолекулярные азотсодержащие вещества, состоящие из аминокислот, связанных между собой пептидными связями.
Белки иначе называют протеинами (от греч. proteos – первостепенный);
Слайд 4
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки составляют значительную часть тканей
живого организма: до 25% сырой и до 50% сухой
массы;
Они содержат 50-59% углерода; 6,5-7,3% водорода;
15-18% азота; 21-24% кислорода; до 2,5% серы.
В составе некоторых белков есть фосфор, железо, цинк, медь и др. микроэлементы.
Слайд 5
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Считают, что в составе организма
взрослого человека:
- примерно 2% - углеводы;
- минеральные вещества
– 4,9%;
- БЕЛКИ – 19,6%;
- жиры – 14,7%;
- вода – 58,8%.
Суточная норма потребления белка 1,2-1,6 г/кг веса, т.е. 60-120гр. – в зависимости от возраста, пола, характера труда (в т.ч. Белка животного происхождения – 55%).
Слайд 6
В организме человека около 10 000 разных белков
Слайд 7
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки – это полимеры.
Роль мономеров
– кирпичиков, из которых состоят белки – выполняют аминокислоты;
Аминокислоты
в составе белков соединены в генетически детерминированной последовательности, которая и определяет как структуру, так и функции данных макромолекул.
Таким образом, белки являются тем инструментом, при помощи которого геном управляет всеми реакциями клеточного метаболизма.
Слайд 8
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Большинство аминокислот, участвующих в биохимических
превращениях, являются карбоновыми кислотами, содержащими карбоксильную и аминную группы,
которые находятся у одного и того же углеродного атома.
В организме человека найдено 70 аминокислот.
Двадцать из них входят в состав белков. Это так называемые протеиногенные аминокислоты.
Слайд 9
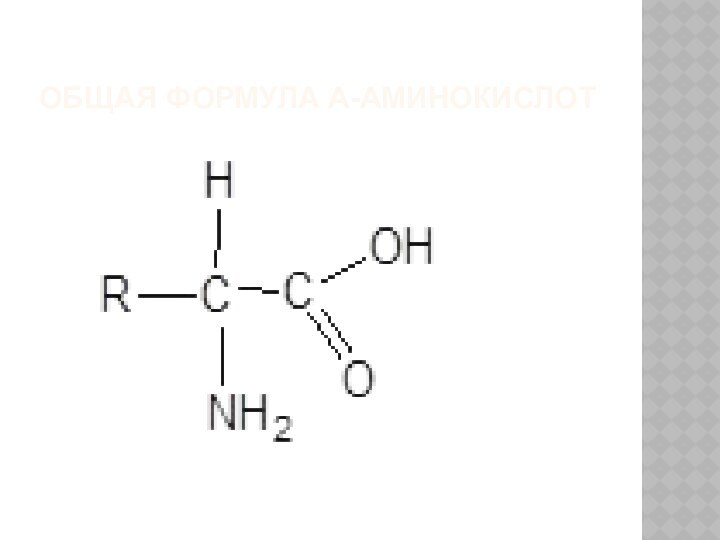
ОБЩАЯ ФОРМУЛА Α-АМИНОКИСЛОТ
Слайд 10
Неизменным для всех аминокислот является т.н. аминокислотный блок.
Аминокислоты
отличаются друг от друга структурой боковых групп, которые в
формуле обозначены - R;
Эти группы (радикалы) имеют различную химическую структуру, а следовательно, придают аминокислотам разные физико-химические свойства.
Слайд 11
Для аминокислот, прежде всего, характерна изомерия положения аминогруппы.
В
биологии и химии широко распространены названия аминокислот, в которых
взаимное расположение аминогруппы по отношению к карбоксильной группе обозначается греческими буквами.
Так, если аминогруппа и карбоксил находятся у одного и того же атома углерода, то такая аминокислота называется α-аминокислотой.
В β-аминокислотах функциональные группа разделены двумя атомами углерода, в γ- - тремя и т.д.
Слайд 12
Белки нашего организма образованы только из α-аминокислот;
Но
в организме встречаются и другие аминокислоты.
Например γ-аминомасляная кислота
(ГАМК):
CH2(NH2)-CH2-CH2-COOH
ГАМК играет важную роль в механизме передачи нервного импульса.
Слайд 13
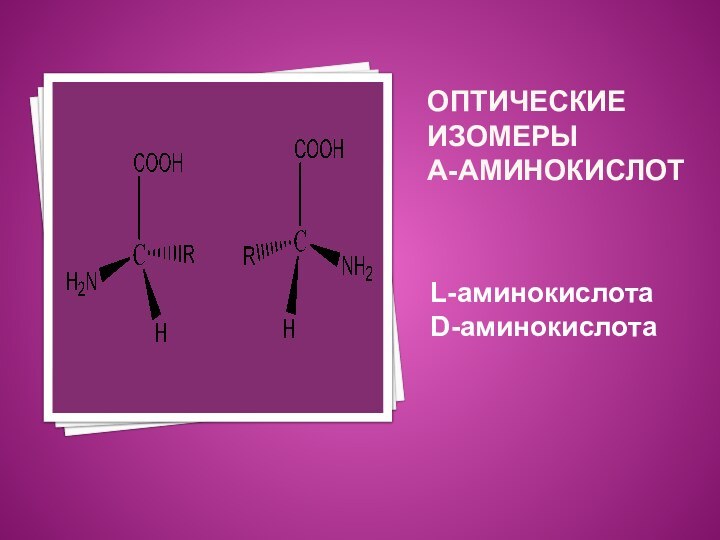
α-Аминокислоты характеризуются наличием оптической активности,
т. е. они
могут вращать плоскость поляризованного света вправо или влево.
Все
α-аминокислоты образуют оптические изомеры (или - зеркальные, т. е. которые нельзя совместить).
Оптические изомеры принято обозначать латинскими буквами. L- (от лат. Louvus – левый) и D- (от лат dexter – правый).
Считают, что кислота относится к L-ряду, если аминогруппа расположена слева.
Все природные аминокислоты, входящие в состав белков, относятся к L-ряду.
Слайд 14
ОПТИЧЕСКИЕ ИЗОМЕРЫ
Α-АМИНОКИСЛОТ
L-аминокислота D-аминокислота
Слайд 15
Вся белковая жизнь на земле – «левая».
D-аминокислоты
встречаются в природе крайне редко.
Они присутствуют в оболочке
бактерии- возбудителя сибирской язвы.
Именно поэтому оболочка бактерии не разрушается ферментами, разрывающими белковые цепи L-аминокислот и сибиреязвенная палочка чрезвычайно устойчива во внешней среде.
Слайд 16
Сибиреязвенная бактерия вне организма при доступе кислорода воздуха образует споры, вследствие
чего обладает большой устойчивостью:
- споры бактерий на пастбище,
заражённом испражнениями и мочой больных животных, могут сохраняться долгие годы.
- гибнут при кипячении - через 40 минут
- сухой жар при температуре 140 °C убивает споры через 2,5—3 ч.
- прямые солнечные лучи выдерживают в течение 10—15 суток.
Слайд 17
МИКРОФОТОГРАФИЯ БАЦИЛЛ СИБИРСКОЙ ЯЗВЫ
Слайд 18
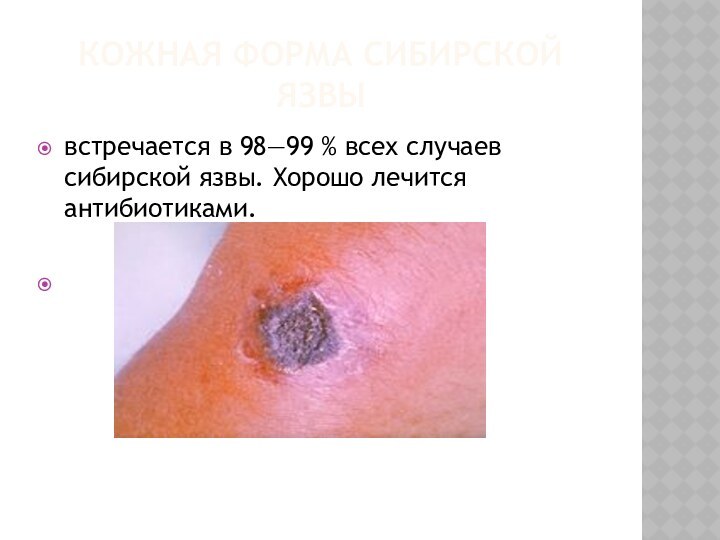
КОЖНАЯ ФОРМА СИБИРСКОЙ ЯЗВЫ
встречается в 98—99 % всех случаев
сибирской язвы. Хорошо лечится антибиотиками.
Слайд 19
При отсутствии соответствующего лечения кожной формы летальность составляет
10—20 %.
При лёгочной форме заболевания в зависимости от штамма
возбудителя летальность даже при соответствующем лечении может превышать 90—95 %,;
Кишечная форма — летальность около 50 %.
Сибиреязвенный менингит — 90 %.
Слайд 20
ПИСЬМО НА ИМЯ АМЕРИКАНСКОГО СЕНАТОРА ТОМА ДЭШЛА, СОДЕРЖАВШЕЕ СПОРЫ СИБИРСКОЙ ЯЗВЫ, ОКТЯБРЬ 2001 ГОДА
Слайд 21
СИБИРСКАЯ ЯЗВА НА ЯМАЛЕ
Олени не смогли рассказать, что
они уже заболели.
Почти через 75 лет давно забытая болезнь снова
показала свое коварство: на Ямале от сибирской язвы: погибло более 2300 животных, в Ямальском районе введен карантин (2.08.2016).
Со стоянки оленеводов эвакуированы более 160 человек, в том числе свыше 90 детей. В понедельник власти ЯНАО заявили, что диагноз "сибирская язва" предварительно подтвердился у 8 человек, в том числе у троих детей. Один ребенок скончался.
Слайд 22
СИБИРСКАЯ ЯЗВА НА ЯМАЛЕ
Вспышка этой болезни произошла из-за
необычно жаркого для этих краев лета (в течение месяца на Ямале
держалась аномальная жара - до 35 градусов)
В связи с чем оттаяли скотомогильники, где во время последней вспышки сибирской чумы были закопаны останки погибших от болезни животных. Лед тает, обнажаются трупы животных, олени, которые бродят по тундре, наткнулись на них и заразились
Слайд 23
Из Салехардской окружной клинической больницы выписаны 22 тундровика
(в том числе 16 детей), госпитализированные из очага сибирской
язвы в Ямальском районе.
Лечение антибиотиками получают 706 человек, из них 139 детей. Провакцинировано 1087 человек, из них 74 подростка старше 14 лет.
Всего в арктическом регионе от "проснувшейся" сибирской язвы погибли 2,3 тысячи оленей, из очага распространения заболевания были госпитализированы 96 кочевников. 1 августа от кишечной формы болезни скончался 12-летний мальчик. 5 августа из стационара выписали первых госпитализированных для профилактического лечения тундровиков.
По данным на 8 августа, привито порядка 90 тысяч оленей. Вакцинация животных продолжается. Случаев падежа нет. Специалисты Минобороны ликвидировали около 1300 павших животных
Слайд 26
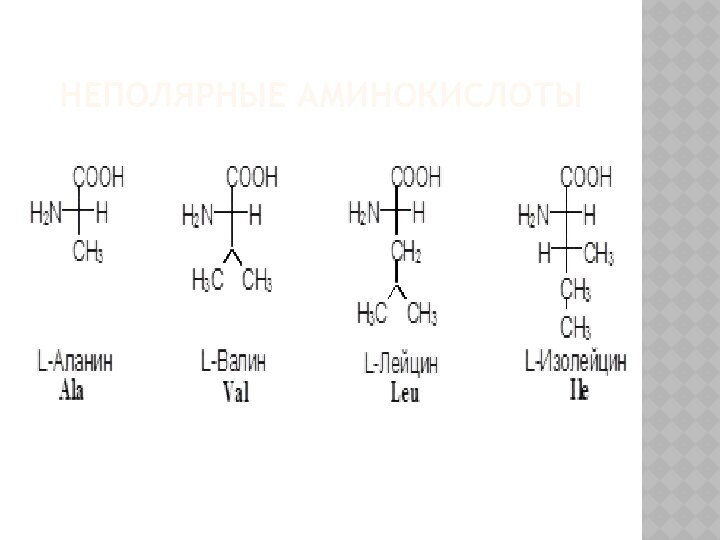
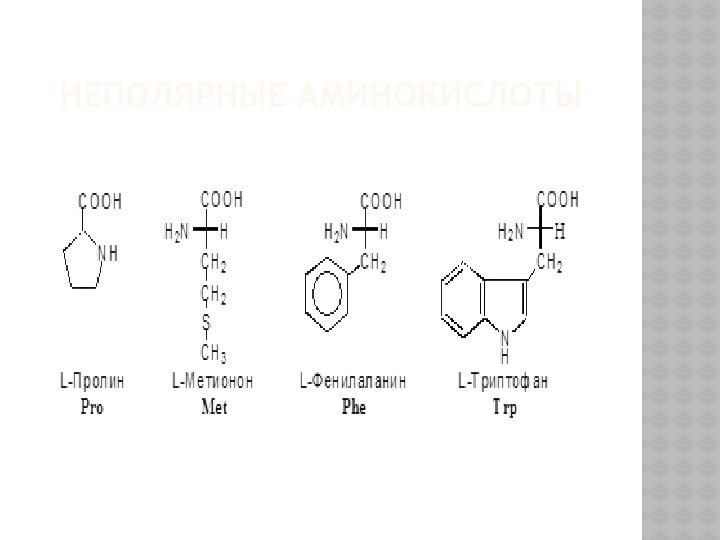
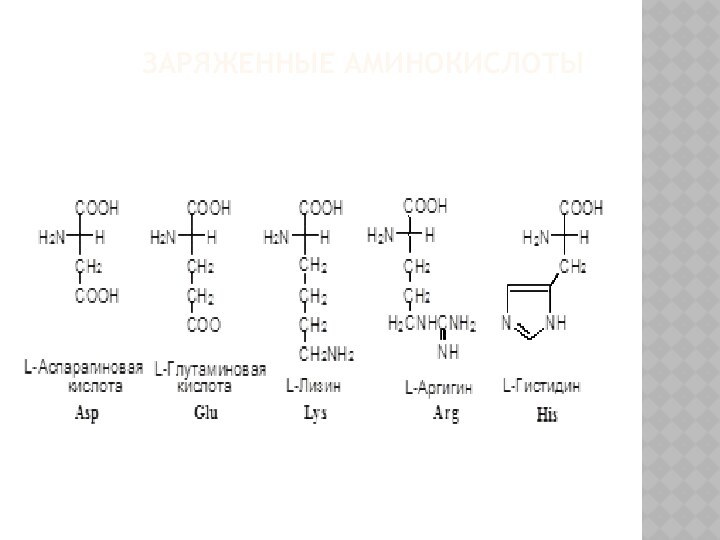
КЛАССИФИКАЦИЯ Α-АМИНОКИСЛОТ
I. В зависимости от строения бокового радикала
аминокислоты подразделяют на:
1) неполярные (гидрофобные), содержат неполярный гидрофобный радикал
(линейную или разветвленную углеводородную цепочку или ароматическое кольцо);
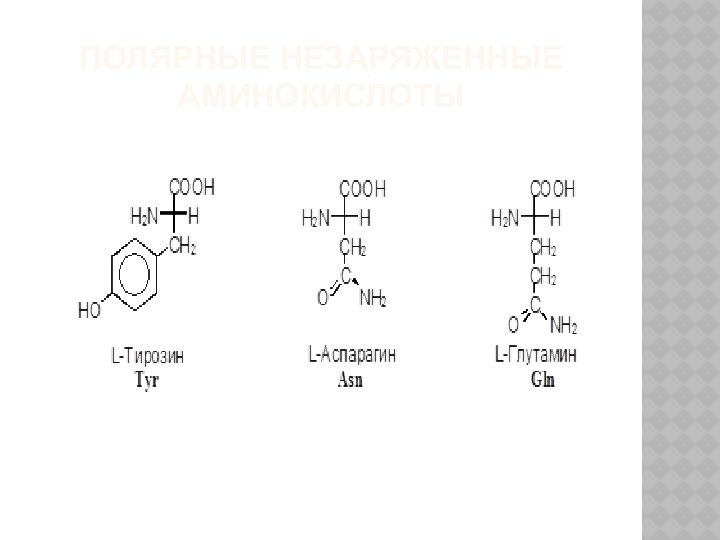
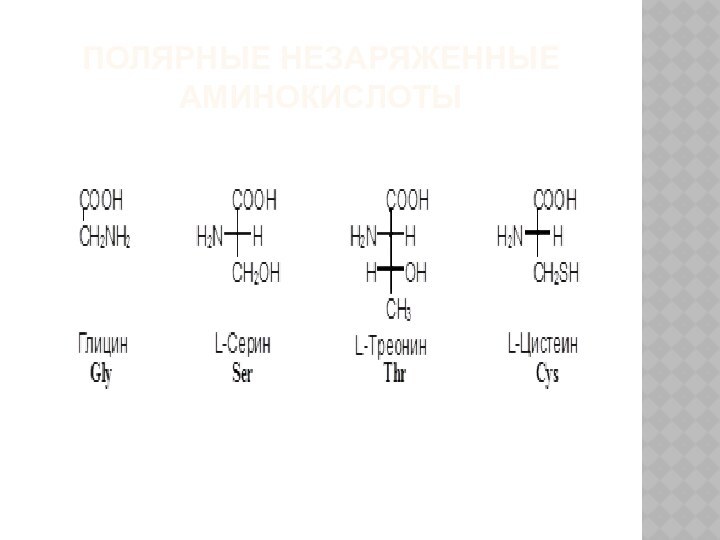
2) полярные (гидрофильные) незаряженные, содержат полярный гидрофильный радикал (полярные группы: -OH; -NH2; -SH);
3) полярные заряженные, содержат заряженный боковой радикал (заряженные группы : -NH3+ и -COO-).
Слайд 29
ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ
Слайд 30
ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ
Слайд 32
КЛАССИФИКАЦИЯ Α-АМИНОКИСЛОТ
II. По биологическому значению Аминокислоты подразделяются
на:
1) незаменимые – их 8:
валин, лейцин, изолейцин, треонин,
метионин, фенилаланин, триптофан, лизин;
2) частично заменимые – их 2:
аргинин и гистидин;
3) заменимые – их 10:
аланин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, тирозин, цистеин.
Слайд 33
Незаменимые аминокислоты не синтезируются в организме человека, но
необходимы для нормальной жизнедеятельности. Они должны поступать в организм
с пищей. При их недостатке задерживается рост и развитие организма.
Заменимые аминокислоты синтезируются в организме человека.
Частично заменимые аминокислоты синтезируются, но в незначительных количествах.
Слайд 34
МНЕМОНИЧЕСКОЕ ПРАВИЛО
Лиза Метнула Фен в Трибуну, Трезвый Лейтенант Валялся в Изоляторе с Аргентинским Гитаристом (лизин, метионин, фенилаланин, триптофан,
треонин, лейцин, валин, изолейцин, аргинин, гистидин).
Слайд 35
Некоторые природные аминокислоты не участвуют в построении белков
но очень важны для жизнедеятельности организма;
Это ГАМК – нужна
для передачи нервного импульса;
Тироксин - является основным гормоном щитовидной железы; образуется при йодировании аминокислоты - тирозина.
Слайд 36
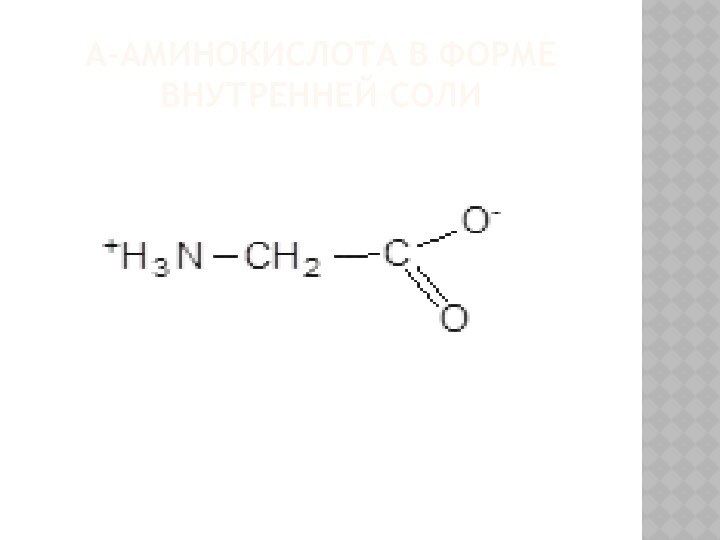
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
В молекуле аминокислоты одновременно присутствуют две
функциональные группы противоположного химического характера:
основная -NH2 – аминогруппа;
кислотная
-COOH - карбоксильная группа.
Эти группы способны к взаимодействию друг с другом, т. е. способны к внутримолекулярной нейтрализации.
В связи с этим аминокислоты правильнее представлять в виде так называемых внутренних солей.
Слайд 37
Α-АМИНОКИСЛОТА В ФОРМЕ ВНУТРЕННЕЙ СОЛИ
Слайд 38
Эта особенность определяет физические и химические свойства аминокислот.
Аминокислоты – твердые, кристаллические вещества, растворимые в воде и
мало растворимые в органических растворителях;
Некоторые аминокислоты обладают сладким вкусом.
Слайд 39
Так как аминокислоты имеют в своем составе как
кислотную, так и основную группы, они способны реагировать и
с кислотами, и с основаниями (являются амфотерными органическими соединениями);
Могут участвовать в реакциях:
реакции окисления-восстановления – по –SH- и -S-S-группам;
реакции алкилирования (взаимодействия с гидроксильными группами спиртов) и ацилирования по NH2-, OH- и COOH-группам;
реакция фофорилирования - по OH-группам
Слайд 40
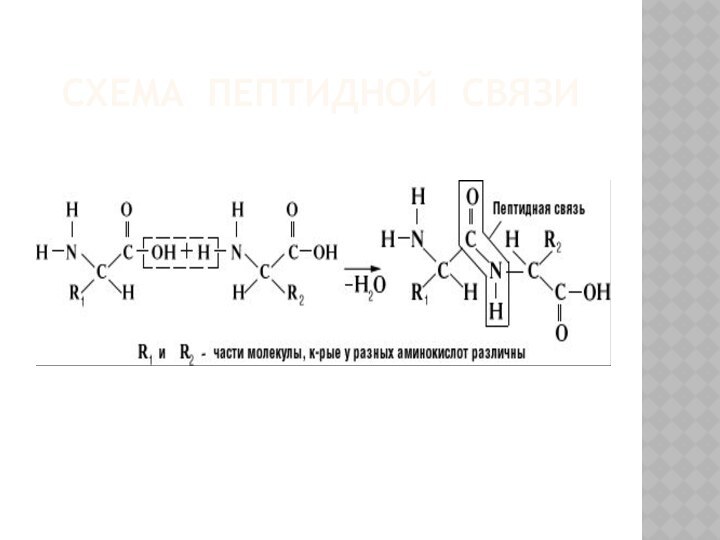
ПЕПТИДЫ
Соединения из нескольких аминокислот называют пептидами;
А связь между
ними – пептидной.
Она возникает под воздействием определенных ферментов;
Пептидная связь
возникает в результате взаимодействия:
α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой.
Слайд 42
В зависимости от количества аминокислот, связанных между собой
выделяют ди-, три, тетра-, пента- или полипептиды – они
содержат от 6-10 до нескольких десятков аминокислот;
В состав многих белков входит 300-500 аминокислотных остатков, есть и более крупные белки (с молекулярной массой от 5000 до многих миллионов);
Различия белков определяются:
- числом аминокислотных остатков;
- их составом;
- последовательностью их чередования в полипептидной цепи.
Слайд 43
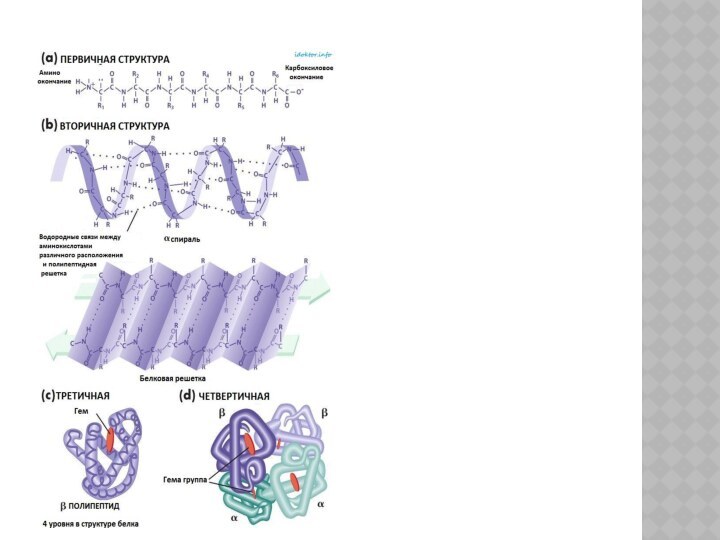
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Выделяют 4 уровня организации белковых
молекул:
1.Первичная структура – это порядок чередования аминокислотных остатков в
полипептидной цепи (или нить из аминокислот, связанных пептидными связями);
Первичная структура каждого белка уникальна и детерминирована генами;
На сегодня расшифрована первичная структура более тысячи белков, в т.ч. организма человека.
Слайд 44
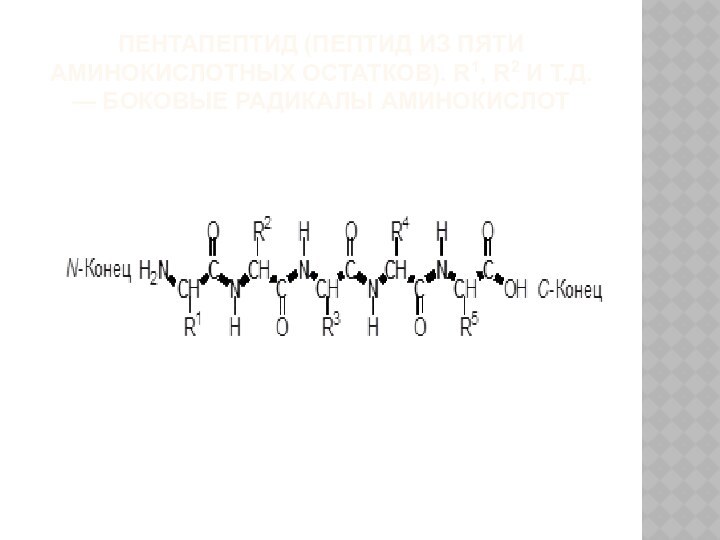
ПЕНТАПЕПТИД (ПЕПТИД ИЗ ПЯТИ АМИНОКИСЛОТНЫХ ОСТАТКОВ). R1, R2
И Т.Д. — БОКОВЫЕ РАДИКАЛЫ АМИНОКИСЛОТ
Слайд 45
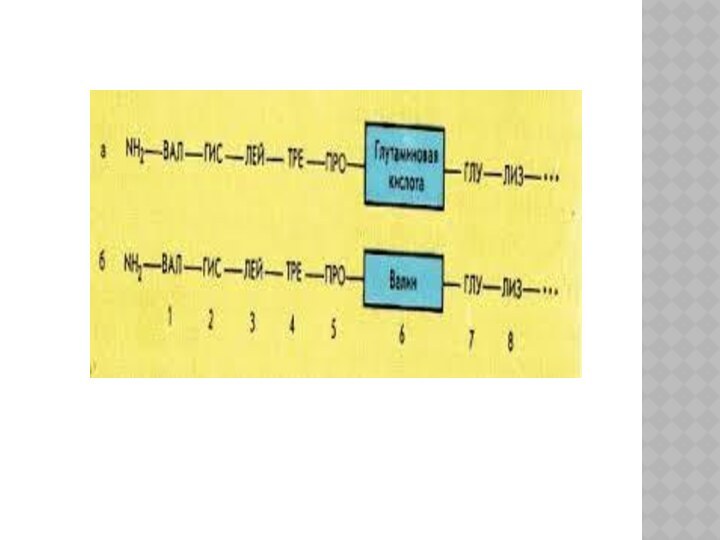
Первичная структура определяет свойства белка.
Замена только одной аминокислоты
в цепи достаточно для негативных последствий:
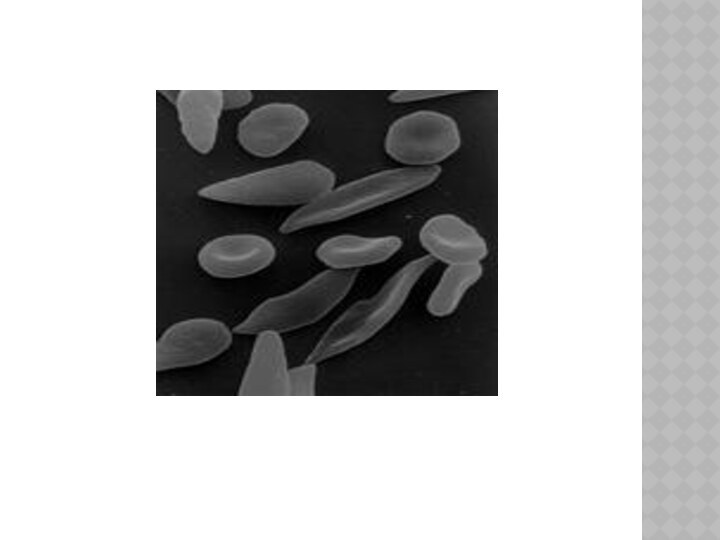
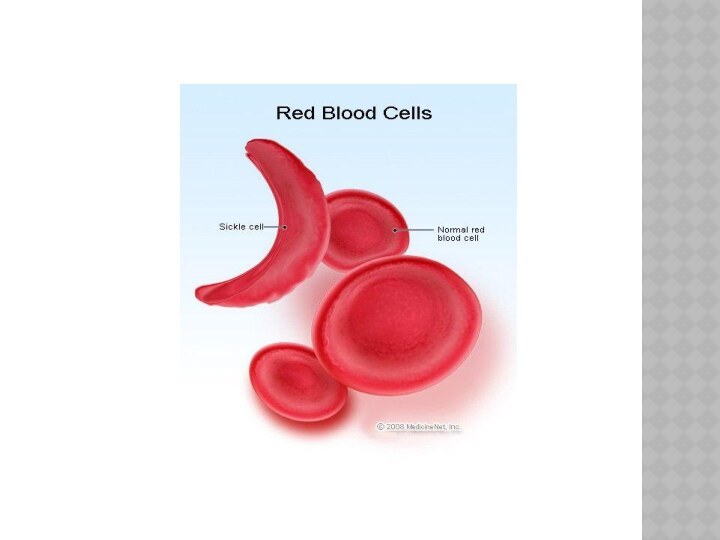
у ГЕМОГЛОБИНА замена в
одном положении глутаминовой кислоты на валин приводит к невозможности переносить кислород – развивается
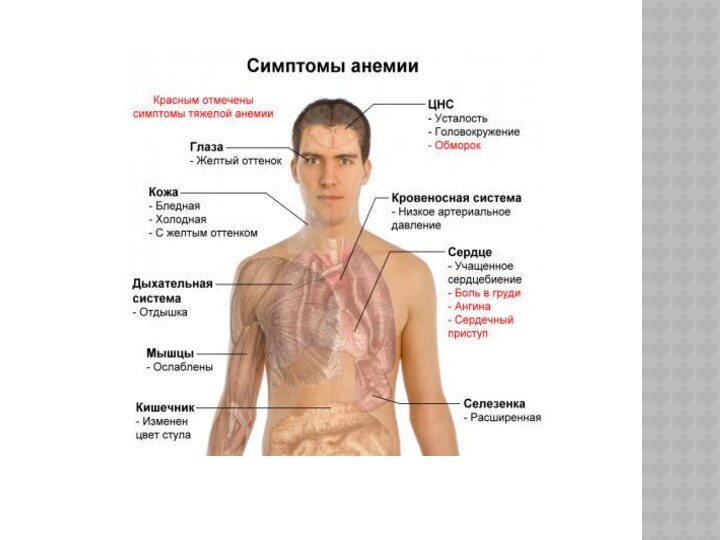
СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ.
Слайд 49
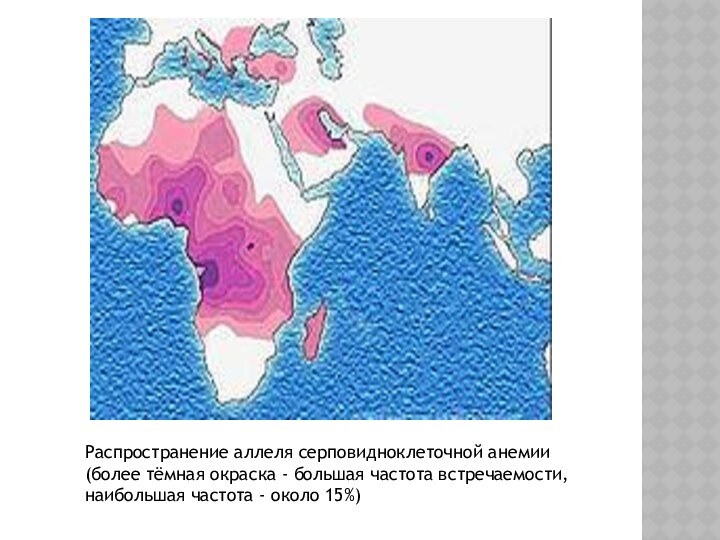
Распространение аллеля серповидноклеточной анемии (более тёмная окраска -
большая частота встречаемости, наибольшая частота - около 15%)
Слайд 50
ПРИЗНАКИ БОЛЕЗНИ
Из-за хрупкости красных клеток крови всегда наблюдается
анемия, которая делает больного менее выносливым и может вызвать
желтуху (связанную с чрезмерным распадом гемоглобина).
В периоды гемолитических кризисов отмечается резкое падение уровня гемоглобина, которое сопровождается высокой температурой и черным цветом мочи. У больных серповидной анемией меняется и внешний вид: отмечается высокий рост, худоба, удлиненность туловища, искривление позвоночника, башенный череп и измененные зубы.
Слайд 52
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Пептидная цепь имеет одно направление
и два разных конца N-конец, несущий свободную аминогруппу первой
аминокислоты, и С-конец, несущий свободную карбоксильную группу последней аминокислоты.
В пептидах аминокислотные остатки связаны в цепочку последовательно.
Цепочку амидных групп и α-углеродных атомов называют пептидным остовом молекулы.
Слайд 53
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Есть пептиды небелковой природы.
В настоящее
время из природных источников выделено более сотни индивидуальных пептидов,
детально изучено их строение, свойства и биологическая активность.
Пример: глутатион – один из наиболее широко распространённых внутриклеточных пептидов, принимающий участие в переносе аминокислот через мембрану, в окислительно-восстановительных и других процессах в клетке.
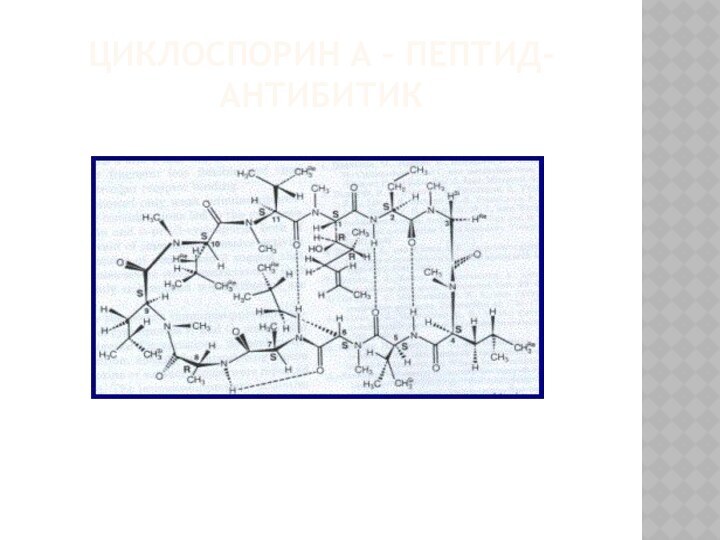
Некоторые природные пептиды-антибиотики (синтезируются микроорганизмами). Они имеют циклическое строение: грамицидин S, циклоспорин А.
Слайд 54
ЦИКЛОСПОРИН А – ПЕПТИД-АНТИБИТИК
Слайд 55
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Роль пептидов в процессе жизнедеятельности
организмов многообразна:
- они служат гормонами: инсулин, глюкагон, гормон
роста и др.;
- некоторые являются сильнейшими ядами (яды змей, пауков, насекомых, грибов);
- антибиотиками;
- регуляторами психической деятельности.
Значительное число природных пептидов удалось синтезировать. Искусственным путём получены сотни аналогов природных пептидов с более сильным биологическим действием.
Слайд 56
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Вторичная структура (организации белковых молекул)
– это способ укладки полипептидной цепи в упорядоченную структуру:
- a – спираль (с симметричными витками);
- b – складчатый слой;
Вторичная структура белка определяется первичной – т.е. какие аминокислотные остатки в ней находятся.
Есть белки, где есть одновременно обе структуры.
Слайд 58
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Третичная структура – спираль, которая
далее свертывается, образуя:
- клубок – глобулу;
- пучок нитей –
фибриллу;
Они специфичны для каждого белка.
Слайд 59
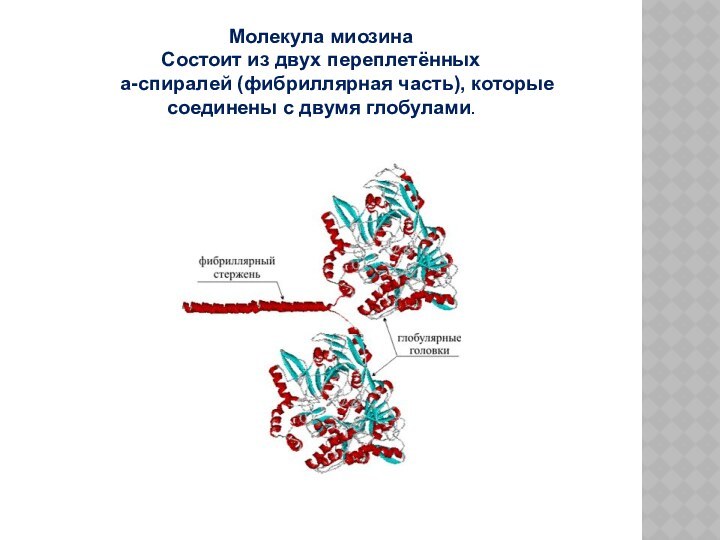
Молекула миозина
Состоит из двух переплетённых
a-спиралей (фибриллярная часть), которые соединены с двумя глобулами.
Слайд 60
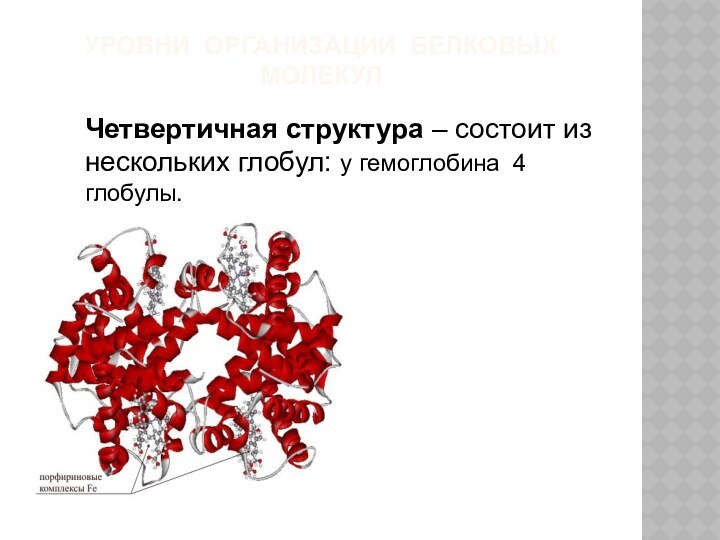
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Четвертичная структура – состоит из
нескольких глобул: у гемоглобина 4 глобулы.
Слайд 61
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Четвертичная структура - способ укладки
в пространстве отдельных полипептидных цепей, обладающих одинаковой или разной
третичной структурой.
Каждая отдельно взятая полипептидная цепь, получившая название протомера или субъединицы, чаще всего не обладает биологической активностью.
Биологическая активность белка проявляется только при наличии третичной или четвертичной структуры.
Слайд 62
КЛАССИФИКАЦИЯ БЕЛКОВ
I. По сложности строения белки делят на
простые и сложные:
- простые (однокомпонентные) белки состоят только из
белковой части и распадаются на аминокислоты;
- сложные (двухкомпонентные): в их состав входит протеин и добавочная группа небелковой природы – простетическая группа.
В ее качестве могут выступать липиды – обр-ся липопротеиды; углеводы – гликопрортеиды;
нуклеиновые кислоты – нуклеопротеиды; ионы металла – металлопротеиды (белок ферритин в селезенке содержит 20% железа).
Слайд 63
КЛАССИФИКАЦИЯ БЕЛКОВ
II. По форме белковой молекулы белки разделяют
на:
глобулярные (корпускулярные);
фибриллярные (волокнистые);
Слайд 64
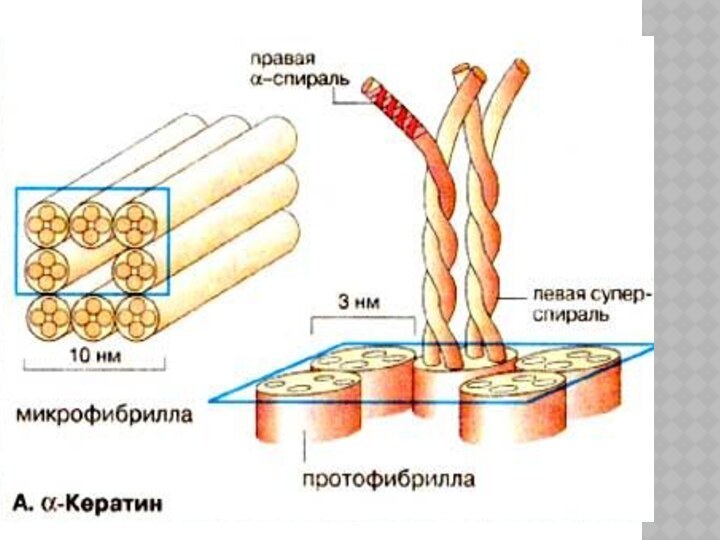
ФИБРИЛЛЯРНЫЕ БЕЛКИ
Молекулы фибриллярных белков нитевидные по форме и
собраны в пучки, образующие волокна;
Они выполняют защитную функцию образуя
наружный слой нашей кожи;
Участвуют в образовании соединительной ткани, включая хрящевую и сухожилия мышц.
Слайд 66
ГЛОБУЛЯРНЫЕ БЕЛКИ
Их подавляющее большинство среди белков;
Они имеют более
сложную пространственную структуру;
Выполняют более разнообразные функции:
- катализируют химические реакции
в клетке;
- обеспечивают растворимость белка в воде и др.
Слайд 67
КЛАССИФИКАЦИЯ БЕЛКОВ
III. По растворимости в воде и растворах
солей выделяют:
- альбумины;
- глобулины.
Альбумины – очень хорошо растворяются в
воде и в концентрированных солевых растворах;
Молекула альбуминов состоит из одной полипептидной цепи и насчитывает до 600 аминокислотных остатков;
Это альбумин белка куриного яйца, альбумин сыворотки крови, альбумин мышечной ткани.
Выполняют транспортные и питательные функции.
Слайд 68
КЛАССИФИКАЦИЯ БЕЛКОВ
Глобулины – не растворяются в воде и
в умеренно концентрированных растворах солей (или выпадают в осадок
при их высокой концентрации).
Но в очень слабых растворах солей растворимы.
Это фибриноген, глобулин сыворотки крови, глобулин мышечной ткани, глобулин белка куриного яйца.
Выполняют транспортную и защитную функцию.
Слайд 69
ФУНКЦИИ БЕЛКОВ В ОРГАНИЗМЕ
1. Каталитическая: белки-ферменты ускоряют химические
реакции;
Ежесекундно в клетках протекает множество химических реакций, причём почти
все они катализируются при помощи ферментов. В настоящее время выделено и идентифицировано более 2 тысяч ферментов, катализирующих протекание разнообразных реакций в клетках и тканях.
2. Строительная: белки участвуют в образовании всех клеточных мембран и органоидов клеток;
К структурным белкам относятся белки межклеточного вещества: коллаген и ретикулин. Одним из основных компонентов связок является эластин, а кожи – коллаген. Волосы и ногти в основном состоят из очень прочного белка – кератина.
Слайд 70
ФУНКЦИИ БЕЛКОВ В ОРГАНИЗМЕ
3. Двигательная: обеспечивают сокращение гладких
и поперечно-полосатых мышц (за счет сократительных белков актина и
миозина);
4.Транспортная: переносят различные соединения (кислород – гемоглобином; гормоны и лекарства – белками плазмы крови);
5. Регуляторная: участвуют в регуляции обмена веществ (инсулин, гормон роста и др.);
Слайд 71
ФУНКЦИИ БЕЛКОВ В ОРГАНИЗМЕ
6. Рецепторная. Рецепторные белки играют
важную роль при передаче нервного или гормонального сигнала в
клетку. Рецепторы локализованы в мембранах, и механизм передачи информации связан в основном с изменением конформации белка, поглощением или выделением энергии и т. д.
7. Защитная: антитела (g-глобулины) распознают и уничтожают чужеродные вещества: вирусы, бактерии, белки и пр.