Дополнительные сведения по теме раздела находятся в приложении
Основные
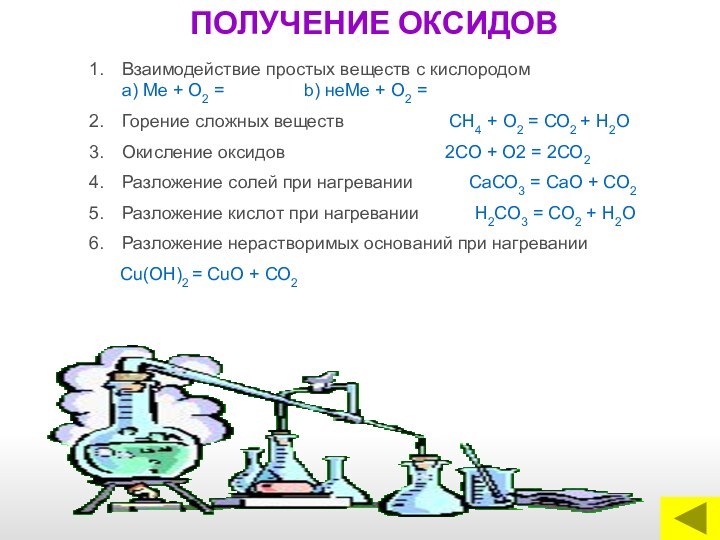
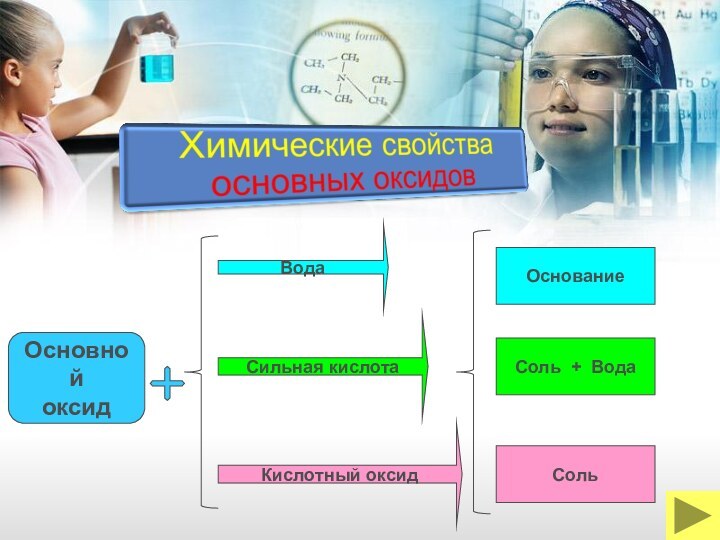
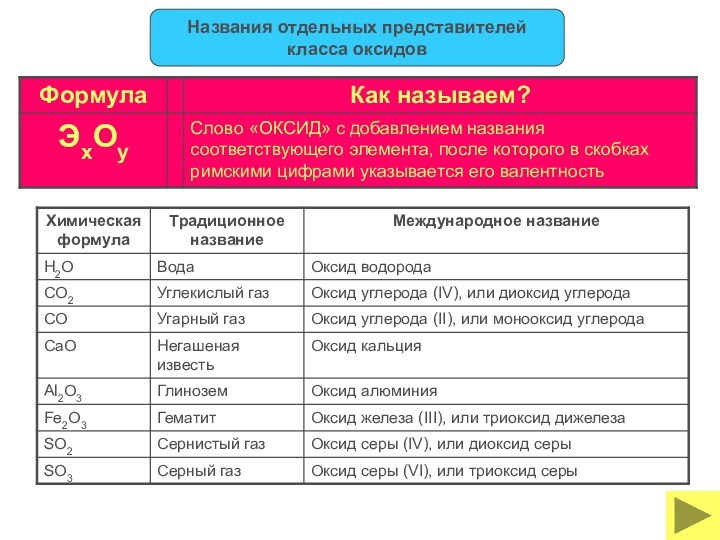
классы неорганических соединений ОКСИДЫ
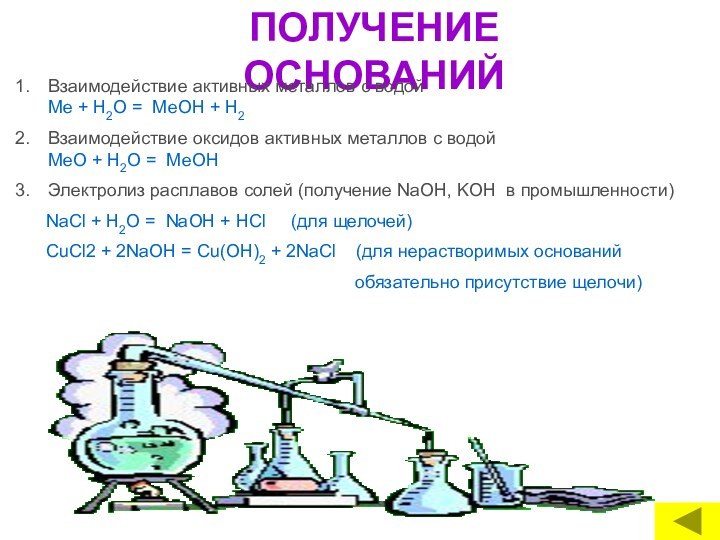
ОСНОВАНИЯ
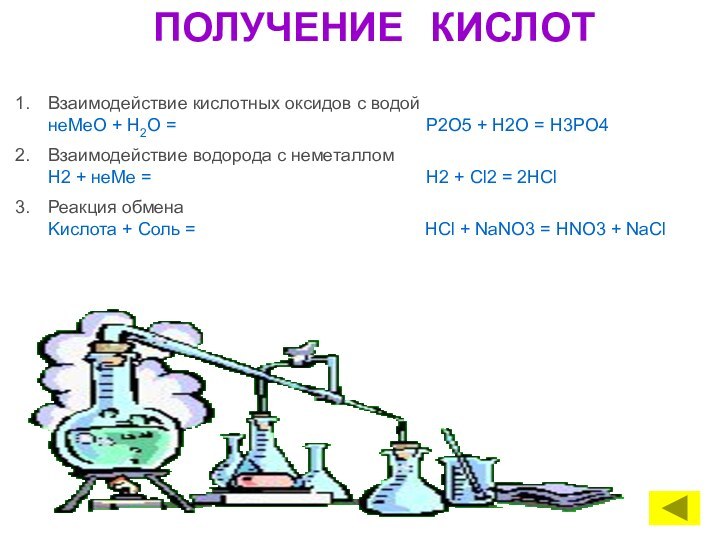
КИСЛОТЫ
СОЛИ
Приложения
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





![Основные классы неорганических соединений Классификация солей по составуСОЛИКислыеNaHCO3СмешанныеCaClBrДвойныеKNaSO4СредниеBaSO4ОсновныеAl(OH)2ClКомплексные[Ag(NH3)2]Cl](/img/tmb/15/1429238/6e0fa66cf1f0cbc1eba6810c976507c8-720x.jpg)

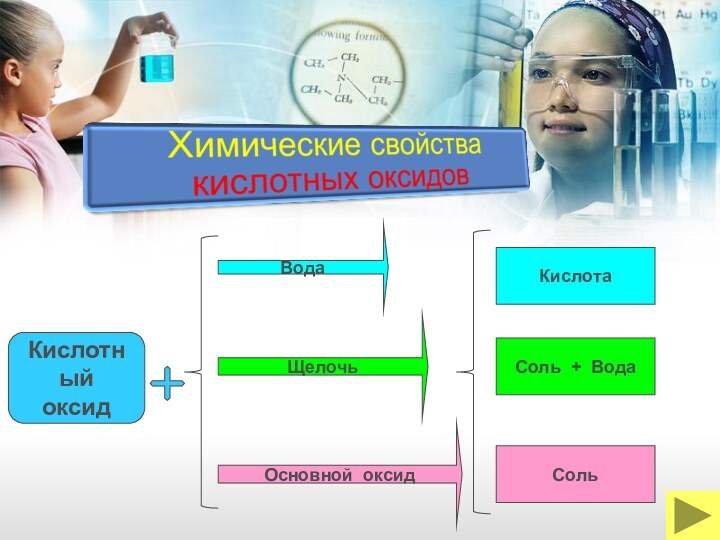

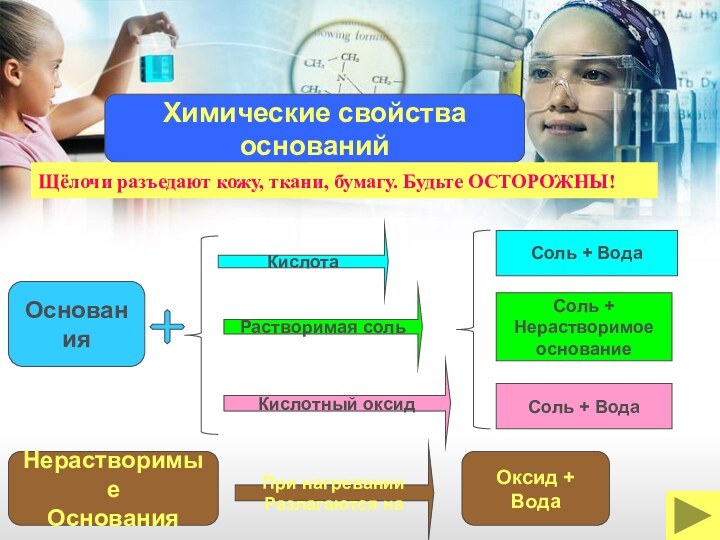
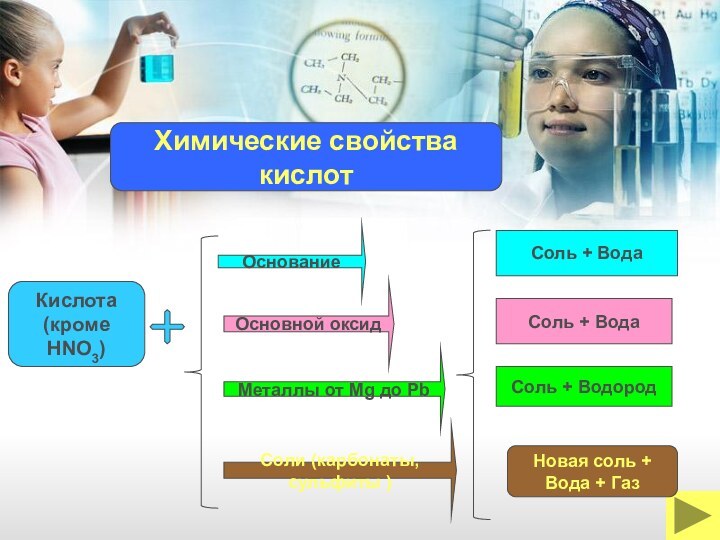

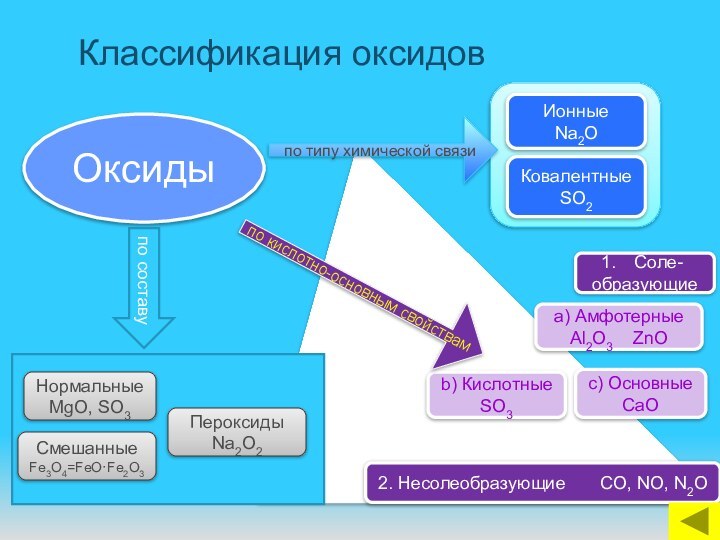
ОКСИДЫ
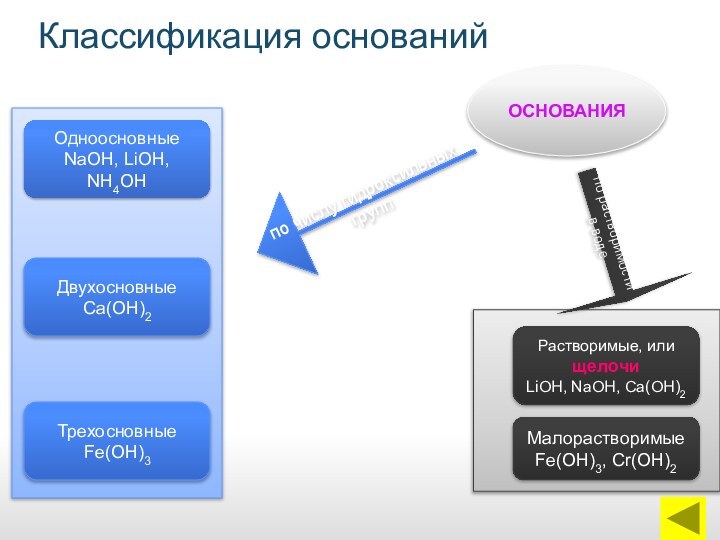
ОСНОВАНИЯ
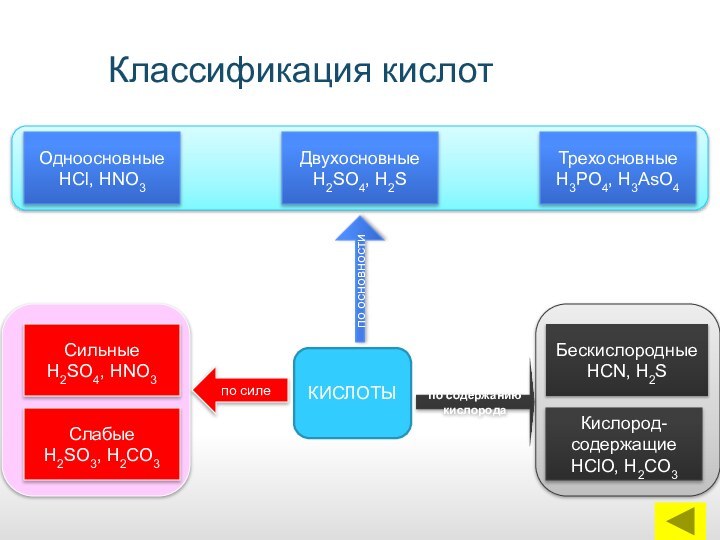
КИСЛОТЫ
СОЛИ
Приложения
NaCl
CaCO3
NaHCO3
по кислотно-основным свойствам
по составу
Соле-
образующие
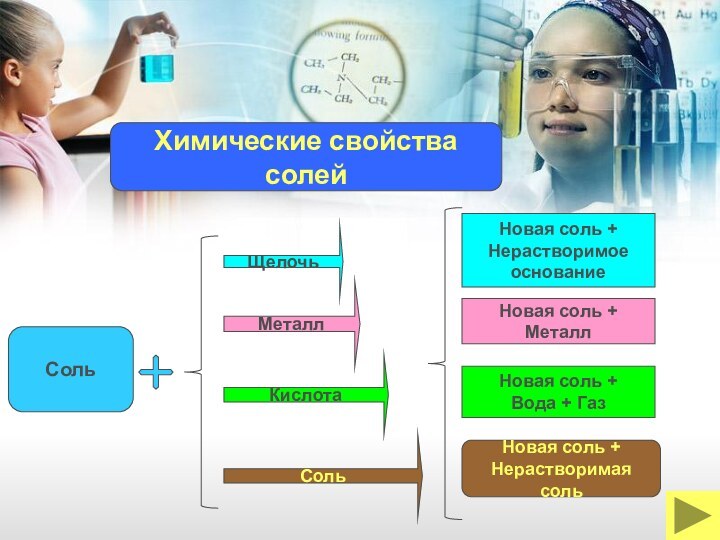
Новая соль +
Вода + Газ
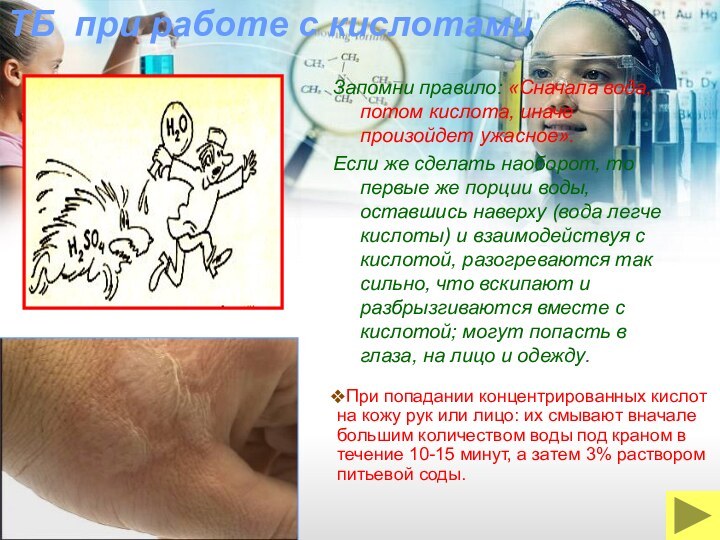
При попадании концентрированных кислот на кожу рук или лицо: их смывают вначале большим количеством воды под краном в течение 10-15 минут, а затем 3% раствором питьевой соды.
Соль
Новая соль +
Нерастворимая соль