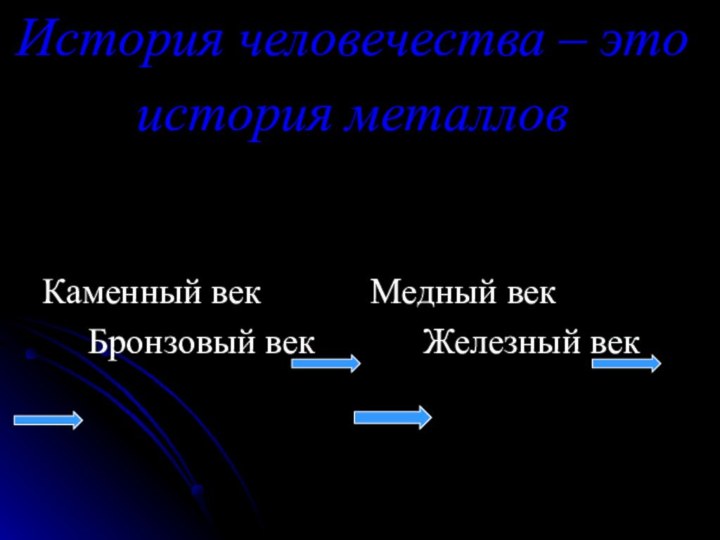
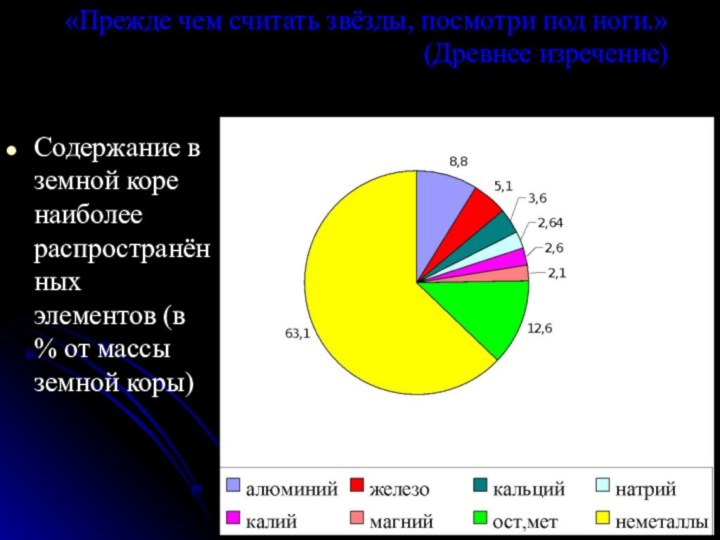
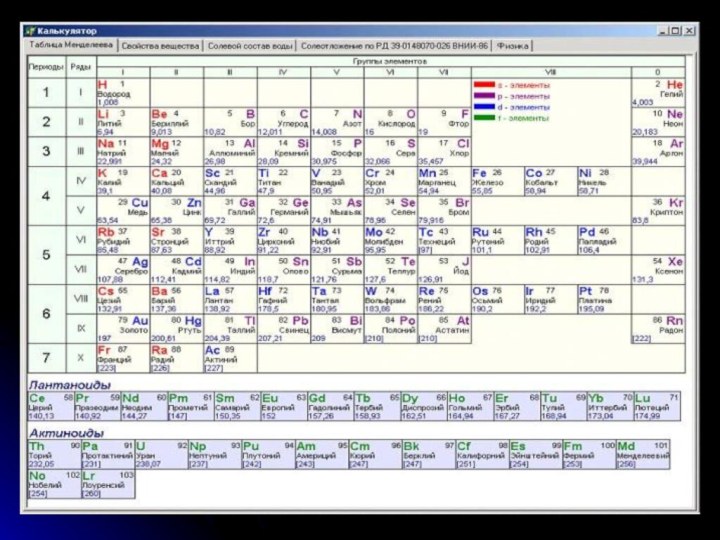
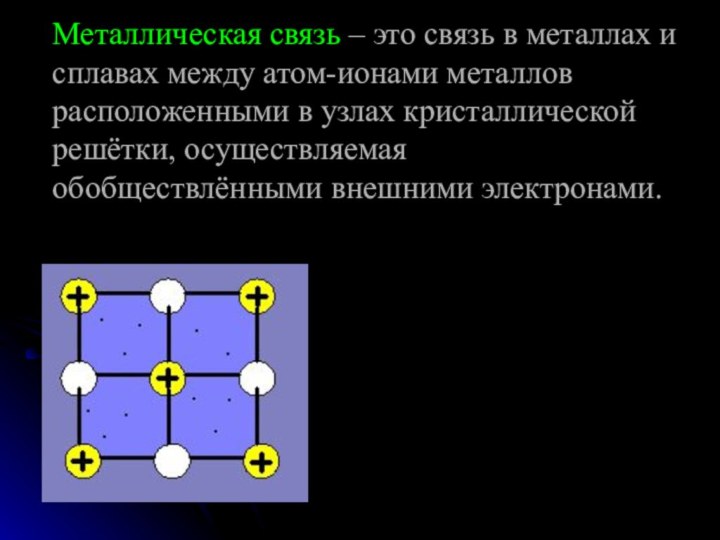
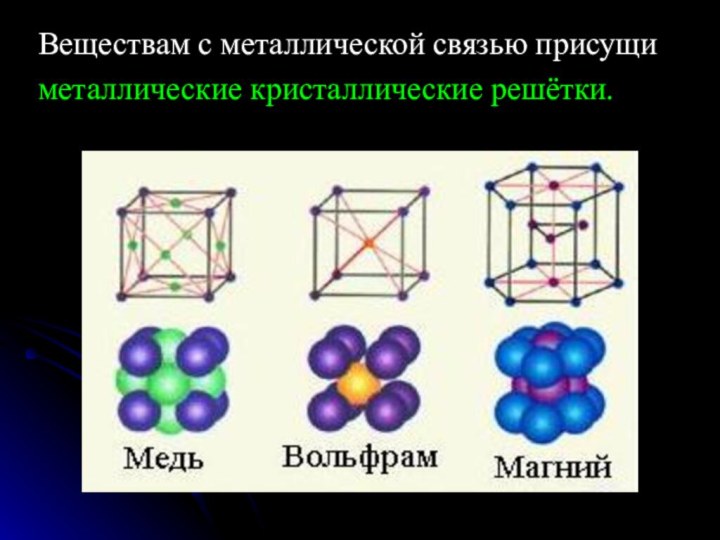
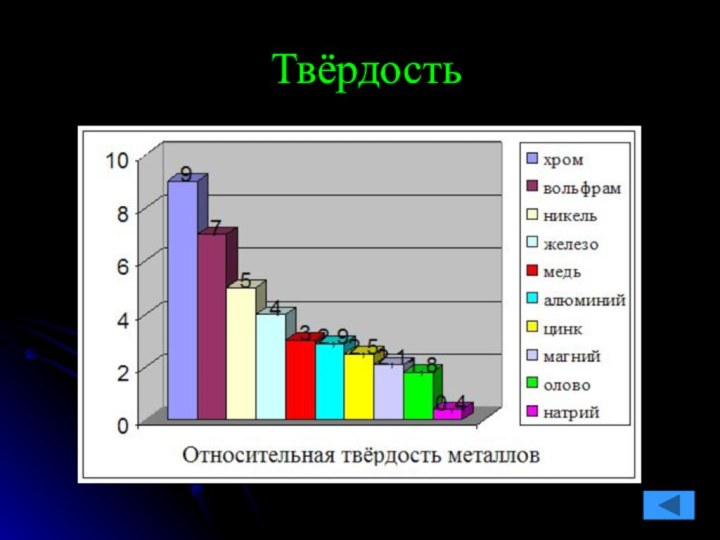
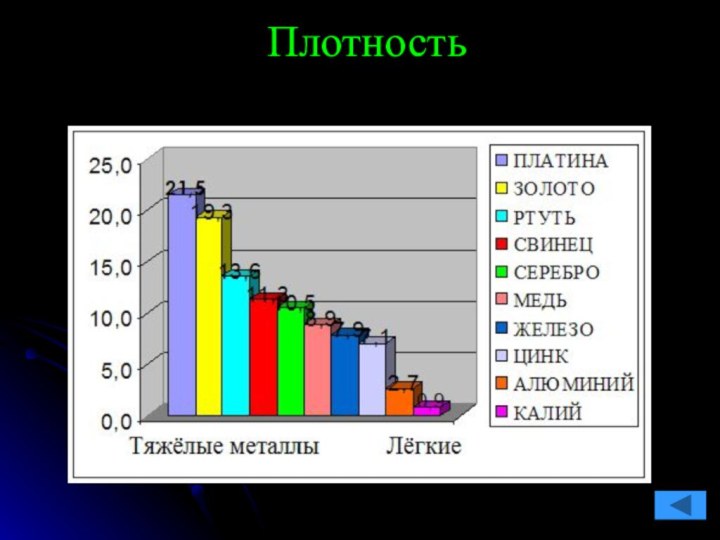
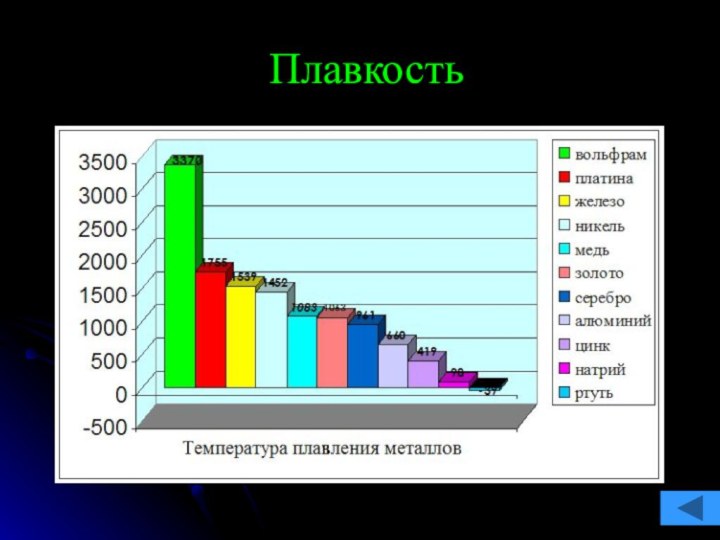
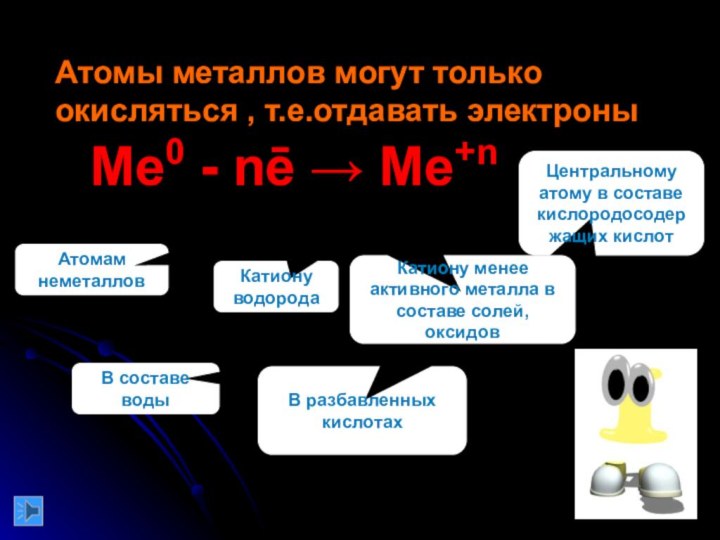
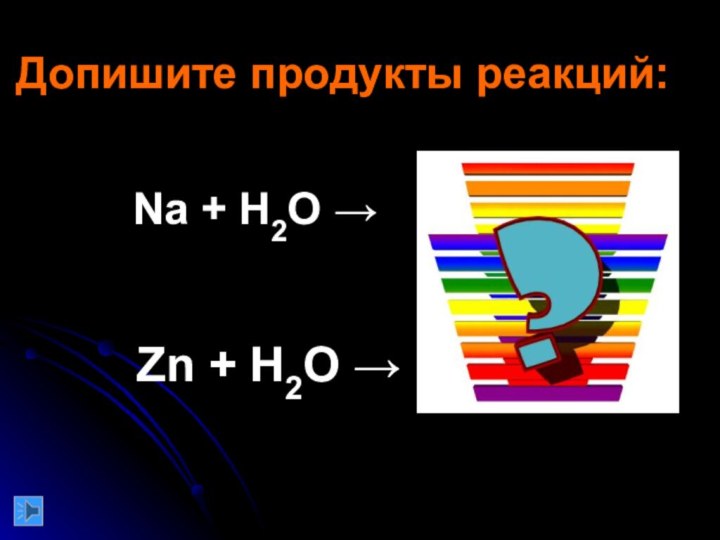
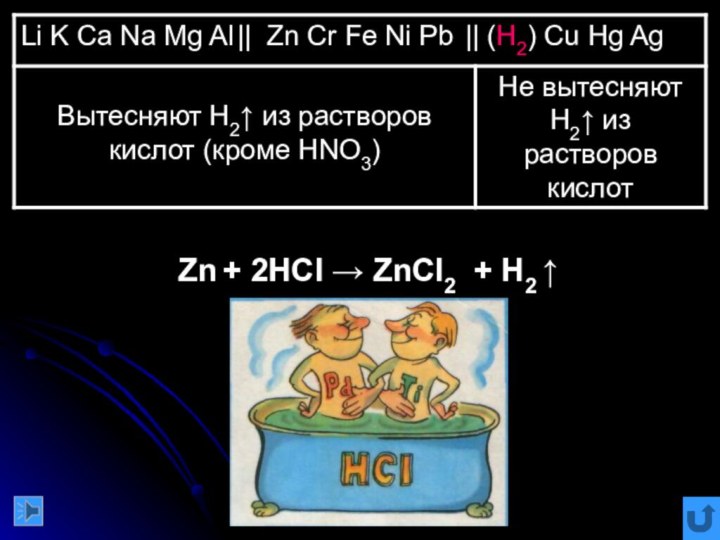
команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не
присталоЗаслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.