- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Типы химических реакций
Содержание
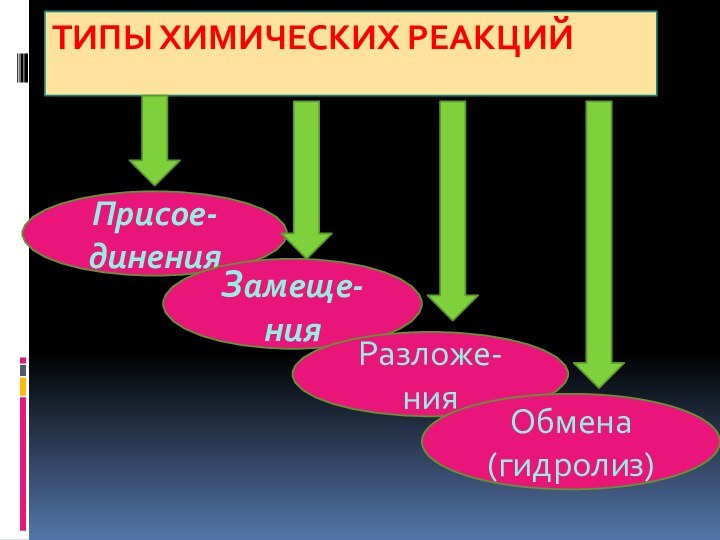
- 2. Типы химических реакций Присое-диненияЗамеще-нияРазложе-нияОбмена (гидролиз)
- 3. Классификация химических реакцийПо направлениюОбратимые НеобратимыеПо тепловому эффектуЭндотермическиеЭкзотермическиеПо использованию катализатораКаталитическиеНекаталитические
- 4. Примеры экзотермимеских реакцийCH4+2O2 = CO2+2H2O+QПримеры эндотермимеских реакцийMg(OH)2=MgO+H2O-Q
- 5. По использованию катализаторов Каталитические (ферментативные) реакции, идущие
- 6. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- 7. Текст надписи Электролиз – разложение веществ под
- 9. 2. Реакции замещения 2K+2H2O=2KOH+H2
- 10. Видеоопыт
- 11. Реакц А + В →
- 13. О2+Н2= 2Н2О
- 14. 4. Реакции обменаГидролиз- реакция обменного разложения некоторых веществ с водойCaH2+2H2O=Ca(OH)2+H2
- 15. Видеоопыт
- 16. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- 17. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- 19. Скачать презентацию
- 20. Похожие презентации
Типы химических реакций Присое-диненияЗамеще-нияРазложе-нияОбмена (гидролиз)




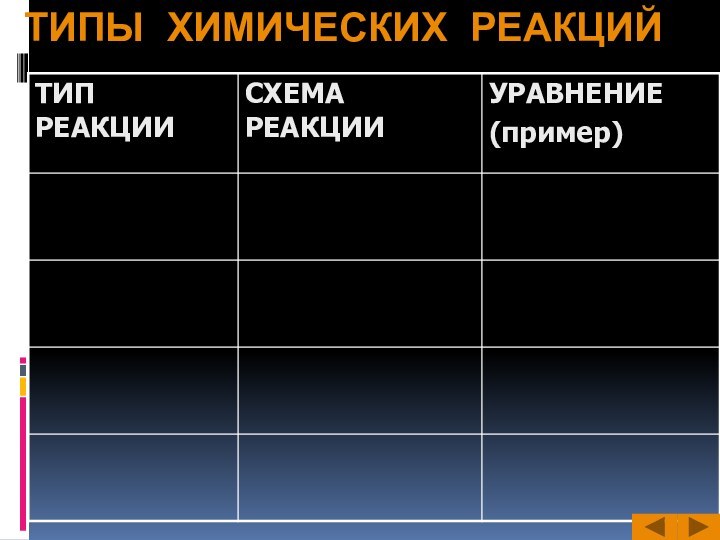













Слайд 3
Классификация химических реакций
По направлению
Обратимые
Необратимые
По тепловому эффекту
Эндотермические
Экзотермические
По использованию
катализатора
Слайд 4
Примеры экзотермимеских реакций
CH4+2O2 = CO2+2H2O+Q
Примеры эндотермимеских реакций
Mg(OH)2=MgO+H2O-Q
Слайд 5
По использованию катализаторов
Каталитические (ферментативные) реакции, идущие с
участием катализатора
MnO2 2 KClO3 = 2 KCI + 3 O2
Некаталитические реакции, идущие без участия катализатора
HgO = 2 Hg + O2
Слайд 7 Текст надписи Электролиз – разложение веществ под действием электрического
тока
Реакция разложения воды
2Н2О = 2Н2+О2
Слайд 11
Реакц А + В → АВ
простое простое
сложноевещество вещество вещество
Между простыми или сложными веществами в результате которых образуется только одно сложное вещество
РЕАКЦИИ СОЕДИНЕНИЯ





























