- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Типы химических связей
Содержание
- 2. АТОМЫNa0 - 1s22s22p63s1Mg0 - 1s22s22p63s2F0 -
- 3. ИОНЫNa1+ - 1s22s22p63s0Mg2+ - 1s22s22p63s0F1- -
- 4. ИОНЫ – заряженные частицы, которые образуются в
- 5. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЭО атома, условная величина, характеризующая способность атома
- 6. Ионная связьобразовавшаяся электронная пара полностью принадлежит более
- 7. Физические свойства веществ с ионным типом связи:
- 8. Металлическая связьвозникает в результате движения свободных электронов,
- 9. Физические свойства.Валентные электроны принадлежат одновременно всем атомам
- 10. Ковалентная связьнаиболее общий вид химической связи, возникающий
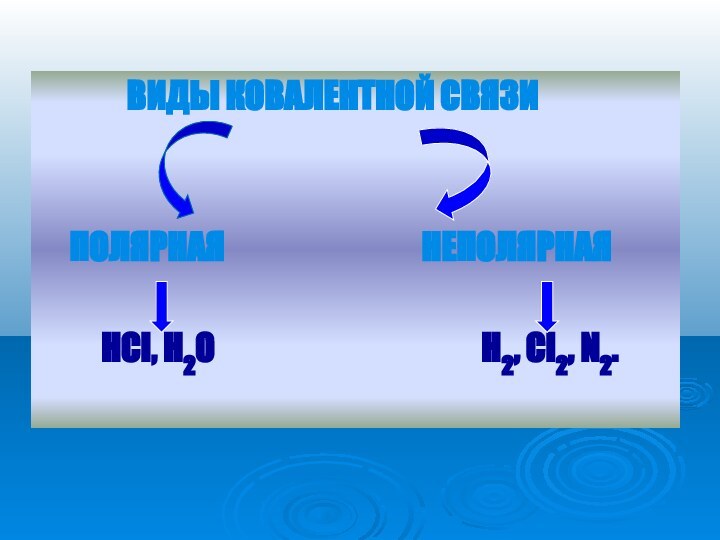
- 12. Образование полярной и неполярной связи.
- 13. Ковалентная полярная связь образуется между атомами различных
- 14. ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙАЛМАЗ(С), КРЕМНИЙ (Si),
- 15. ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙВ УЗЛАХ –
- 16. ВОДОРОДНАЯ СВЯЗЬвид химической связи типа
- 17. Образование межмолекулярной водородной связи.
- 18. Образование внутримолекулярной водородной связи.
- 19. Скачать презентацию
- 20. Похожие презентации
АТОМЫNa0 - 1s22s22p63s1Mg0 - 1s22s22p63s2F0 - 1s22s22p5 Cl0 - 1s22s22p63s23p5число протонов и электронов одинаковое количество, атом нейтрален.


















Слайд 3
ИОНЫ
Na1+ - 1s22s22p63s0
Mg2+ - 1s22s22p63s0
F1- - 1s22s22p6
Cl1- - 1s22s22p63s23p6
Число протонов
и электронов разное – это ионы.Слайд 4 ИОНЫ – заряженные частицы, которые образуются в результате
присоединения или отдачи электронов.
Если е - отдаются – ион
заряжается положительно.Если е - присоединяются – ион заряжается отрицательно.
Слайд 5
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
ЭО атома, условная величина, характеризующая способность атома в
молекуле притягивать электроны.
ЭО в периоде увеличивается
ЭО в
группе возрастаетСАМЫЙ электроотрицательный элемент фтор.
Слайд 6
Ионная связь
образовавшаяся электронная пара полностью принадлежит более электроотрицательному
атому.
ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения.
Например:
Na1+ и Cl1-, Li1+ и F1-••
Na1+ + Cl1- = Na( :Cl:)
• •
Слайд 7 Физические свойства веществ с ионным типом связи: твердые,
тугоплавкие, не имеющие запаха, часто хорошо растворимые в воде.
Вещества
с ионном связью, образуют ионную кристаллическую решетку.
Слайд 8
Металлическая связь
возникает в результате движения свободных электронов, которые
достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с
положительно заряженными ионами.
Слайд 9
Физические свойства.
Валентные электроны принадлежат одновременно всем атомам металла,
свободно перемещаясь по всему кристаллу.
Образуя единое электронное облако
(«электронный газ»). Электроны обладают свойствами волны, они «размазаны» по всему куску металла.
В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск
Слайд 10
Ковалентная связь
наиболее общий вид химической связи, возникающий за
счет образования общей электронной пары
обменный механизм - когда
каждый из взаимодействующих атомов поставляет по одному электрону донорно-акцепторный механизм - электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Слайд 13 Ковалентная полярная связь образуется между атомами различных неметаллов.
Схема образования ковалентной полярной связи:
•• •• H* + •Cl:=H : Cl: •• ••
Слайд 14
ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ
(SiO2).
Они состоят из атомов, связанных друг с другом
в бесконечный трехмерный каркас.Атомный каркас обладает высокой прочностью.
Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.
Слайд 15
ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
В УЗЛАХ – НАХОДЯТСЯ
МОЛЕКУЛЫ.
УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ.
ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ
ЗАПАХ. ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА,БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)