углеводороды, молекулы которых содержат двойную связь.
Общая формула ряда
алкенов: 13.05.2014
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

















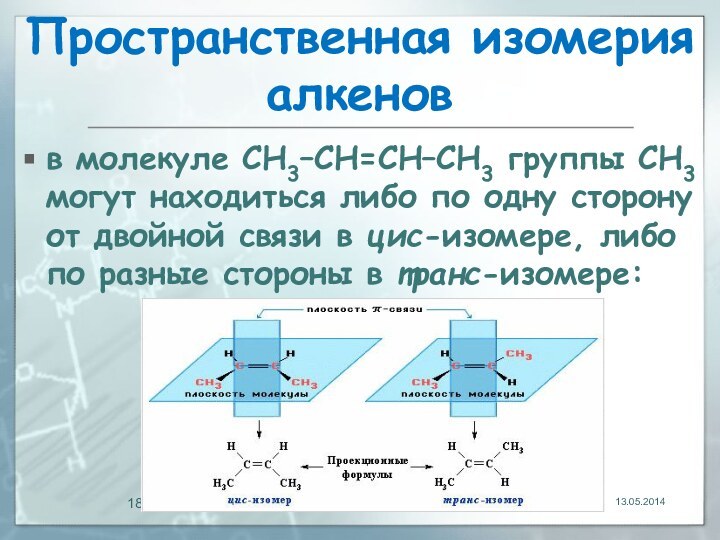


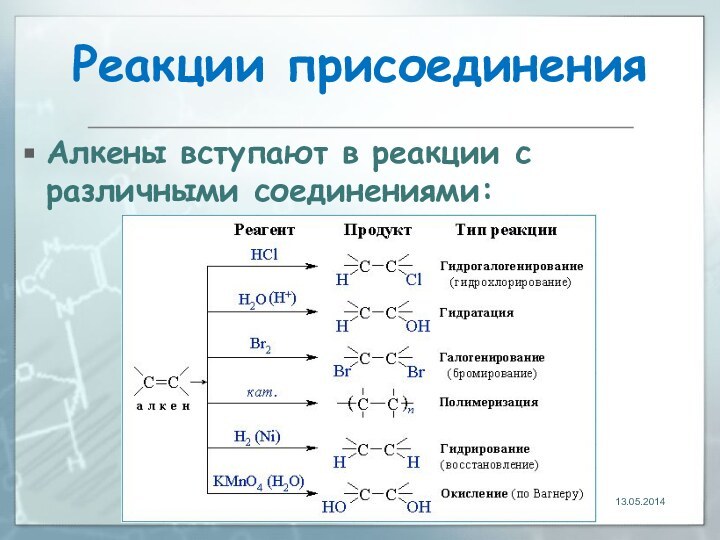






























13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014
13.05.2014