Слайд 3
Вода — весьма распространенное на Земле

вещество. Почти 3/4 поверхности
земного шара покрыты водой, образующей
океаны, моря, реки и озера. Много воды
находится в газообразном состоянии в виде паров в атмосфере; в виде огромных
масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных
странах. В недрах земли также находится вода, пропитывающая почву и горные
породы.
Природная вода не бывает совершенно чистой. Наиболее чистой является
дождевая вода, но и она содержит незначительные количества различных примесей,
которые захватывает из воздуха.
Количество примесей в пресных водах обычно лежит в пределах от 0,01 до 0,1% (масс.).
Морская вода содержит 3,5% (масс.) растворенных веществ, главную
массу которых составляет хлорид натрия (поваренная соль).
Вода, содержащая значительное количество солей кальция и магния,
называется жесткой в отличие от мягкой воды, например, дождевой. Жесткая вода
дает мало пены с мылом, а на стенках котлов образует накипь.
Чтобы освободить природную воду от взвешенных в ней частиц, ее фильтруют
сквозь слой пористого вещества, например, угля, обожженной глины и т. п. При
фильтровании большого количества воды пользуются фильтрами из песка и гравия.
Фильтры задерживают также большую часть бактерий. Кроме того, для
обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды
требуется не более 0,7 г хлора на 1 т воды.
Фильтрованием можно удалить из воды только нерастворимые примеси.
Растворенные вещества удаляют из нее путем перегонки (дистилляции) или ионного
обмена.
Вода имеет очень большое значение в жизни растений, животных и человека.
Согласно современным представлениям, само происхождение жизни связывается с
морем. Во всяком организме вода представляет собой среду, в которой протекают
химические процессы, обеспечивающие жизнедеятельность организма; кроме того,
она сама принимает участие в целом ряде биохимических реакций.
Слайд 5
Чистая вода представляет собой бесцветную прозрачную

жидкость. Плотность
воды при переходе ее из твердого состояния
в жидкое не уменьшается, как почти у
всех других веществ, а возрастает. При нагревании воды от 0 до 4 °С плотность ее
также увеличивается. При 4 °С вода имеет максимальную плотность, и лишь при
дальнейшем нагревании ее плотность уменьшается
Большое значение в жизни природы имеет и тот факт, что вода. обладает
аномально высокой теплоемкостью, Поэтому. в ночное время, а также при переходе
от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так
же медленно нагревается, являясь, таким образом, регулятором температуры на
земном шаре.
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей
формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения
ее растворов в других растворителях, оказывается более высокой. Это
свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е.
соединение их в более сложные агрегаты. Такой вывод подтверждается и
аномально высокими значениями температур плавления и кипения воды.
Ассоциация молекул воды вызвана образованием между ними водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в
образовании двух водородных связей с соседними молекулами воды. Образование
водородных связей приводит к такому расположению молекул воды, при котором они
соприкасаются друг с другом своими разноименными полюсами.
Молекулы образуют слои, причем каждая из них связана с тремя молекулами,
принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда
принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры
которых несколько превышают размеры молекулы H2O.
При плавлении льда его структура разрушается. Но и в жидкой воде
сохраняются водородные связи между молекулами: образуются ассоциаты — как
бы обломки структуры льда, — состоящих из большего или меньшего числа молекул
воды. Однако в отличие ото льда каждый ассоциат существует очень короткое
время: постоянно происходит разрушение одних и образование других агрегатов. В
пустотах таких “ледяных” агрегатов могут размещаться одиночные молекулы воды;
при этом упаковка молекул воды становится более плотной. Именно поэтому при
плавлении льда объем, занимаемый водой, уменьшается, а ее плотность
возрастает.
По мере нагревания воды обломков структуры льда в ней становится все
меньше, что приводит к дальнейшему повышению плотности воды. В интервале
температур от 0 до 4 °С этот эффект преобладает над тепловым расширением, так
что плотность воды продолжает возрастать. Однако при нагревании выше 4 °С
преобладает влияние усиления теплового движения молекул, и плотность воды
уменьшается. Поэтому при 4 °С вода обладает максимальной плотностью.
При нагревании воды часть теплоты затрачивается на разрыв водородных
связей (энергия разрыва водородной связи в воде составляет примерно 25
кДж/моль). Этим объясняется высокая теплоемкость воды.
Водородные связи между молекулами воды полностью разрываются только
при переходе воды в пар.
Слайд 7
Молекулы воды отличаются большой устойчивостью к нагреванию.

Однако при
температурах выше 1000 °С водяной пар начинает
разлагаться на водород и
кислород: 2Н О 2Н +О . Процесс разложения вещества в результате его
нагревания называется термической диссоциацией. Термическая диссоциация воды
протекает с поглощением теплоты. Поэтому, согласно принципу Ле Шателье, чем
выше температура, тем в большей степени разлагается вода. Однако даже при 2000
°С степень термической диссоциации воды не превышает 2%, т. е. равновесие
между газообразной водой и продуктами ее диссоциации — водородом и
кислородом — все еще остается сдвинутым в сторону воды. При охлаждении же
ниже 1000 °С равновесие практически полностью сдвигается в этом направлении.
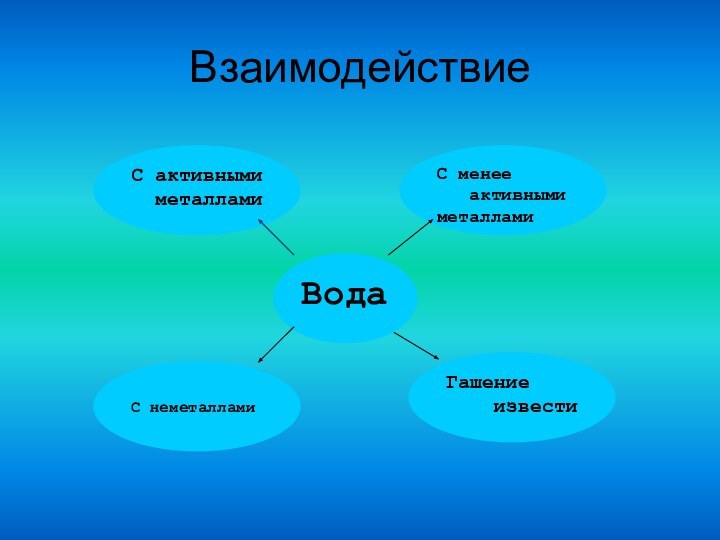
Вода — весьма реакционноспособное вещество. Оксиды многих металлов и
неметаллов соединяются с водой, образуя основания и кислоты; некоторые соли
образуют с водой кристаллогидраты; наиболее активные металлы взаимодействуют
с водой с выделением водорода.
Вода обладает также каталитической способностью. В отсутствие следов влаги
практически не протекают некоторые обычные реакции; например, хлор не
взаимодействует с металлами, фтороводород не разъедает стекло, натрий не
окисляется в атмосферы воздуха.
Вода способна соединяться с рядом веществ, находящихся при обычных
условиях в газообразном состоянии, образуя при этом так: называемые гидраты
газов. Примерами могут служить соединения Хе 6 H2O, CI 8 H2O, С Н 6Н
О, С Н 17Н О, которые выпадают в виде кристаллов при температурах от 0 до
24 °С (обычно при повышенном давлении соответствующего газа). Подобные
соединения возникают в результате заполнения молекулами газа (“гостя”)
межмолекулярных полостей, имеющихся в структуре воды (“хозяина”); они
называются соединениями включения или клатратами
В клатратных соединениях между молекулами “гостя” и “хозяина” образуются
лишь слабые межмолекулярные связи; включенная молекула не может покинуть
своего места в полости кристалла преимущественно из-за пространственных
затруднений. Поэтому клатраты — неустойчивые соединения, которые могут
существовать лишь при сравнительно низких температурах.
Клатраты используют для разделения углеводородов и благородных газов. В
последнее время образование и разрушение клатратов газов (пропана и некоторых
других) успешно применяется для обессоливания воды. Нагнетая в соленую воду при
повышенном давлении соответствующий газ, получают льдоподобные кристаллы
клатратов, а соли остаются в растворе. Похожую на снег массу кристаллов отделяют
от маточного раствора и промывают, Затем при некотором повышении температуры
или уменьшении давления клатраты разлагаются, образуя пресную воду и исходный
газ, который вновь используется для получения клатрата. Высокая экономичность и
сравнительно мягкие условия осуществления этого процесса делают его
перспективным в качестве промышленного метода опреснения морской воды.
Слайд 9
С активным металлом:
2Na + 2H2O = 2NaOH +
H2↑
Слайд 10
С менее активным металлом:
3Fe + H2O = 4H2
+ Fe3O4
Слайд 11
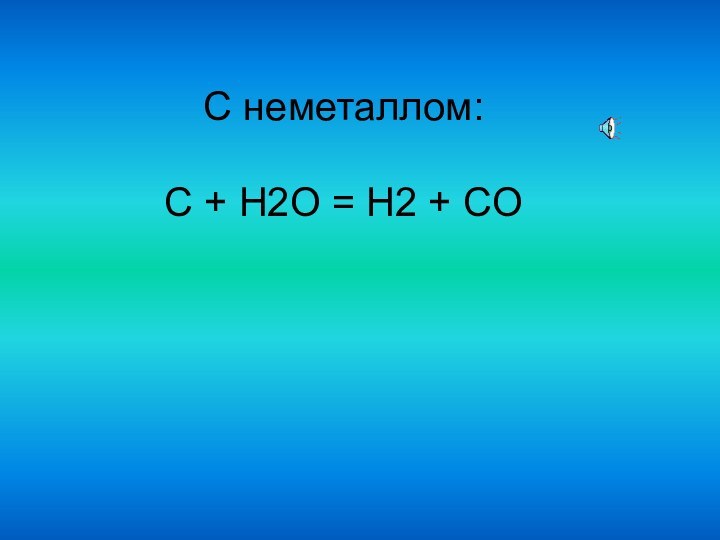
С неметаллом:
C + H2O = H2 + CO