Слайд 2
2.1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
1. Основные химические понятия и законы.

Закон эквивалентов.
2. Атом. Планетарная модель строения атомов. Элементарные
частицы. Атомное ядро. Изотопы, изобары.
3. Атомные орбитали. Квантовые числа (главное, орбитальное, магнитное, спиновое). Физический смысл квантовых чисел.
4. Электронное строение атомов элементов.Принцип минимальной энергии, принцип Паули, правила Гунда, Клечковского.
5. Возбужденное и ионизированное состояние атомов. Электронные переходы между уровнями.
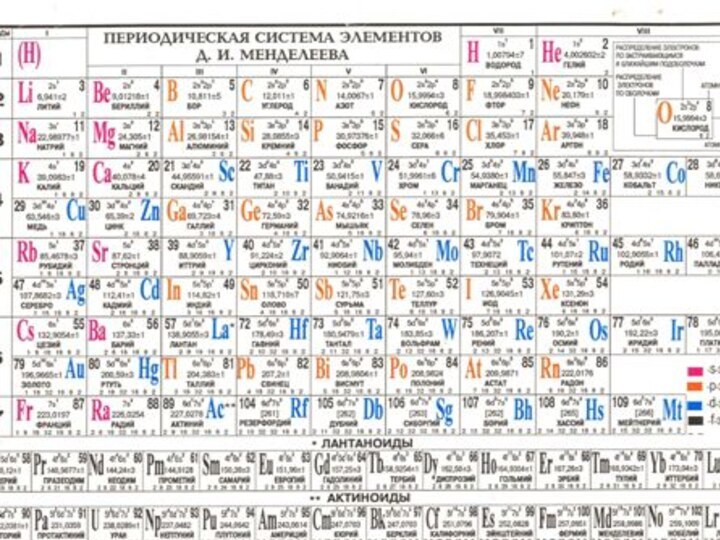
6. Периодический закон и Периодическая система элементов Д. И. Менделеева. Формулировка Периодического закона по Д. И. Менделееву и современная формулировка. Периодическое изменение свойств элементов и их соединений. 7. Структура периодической системы и ее связь с электронным строением атомов. Периодически изменяемые свойства элементов. Энергия ионизации, сродство к электрону и электроотрицательность как характеристика металлических и неметаллических свойств элементов. Изменение этих характеристик в периодической таблице Менделеева.
8. Основные классы неорганических соединений: оксиды, кислоты, основания (методы получения и химические свойства).
9. Основные, кислые, средние и двойные соли (методы получения и химические свойства).
10. Комплексные соединения. Комплексообразователи и лиганды. Структура и строение комплексных соединений, виды химических связей в комплексных соединениях.
Слайд 3
24. Диссоциация воды. Ионное произведение воды, рН растворов.
25.

Реакции ионного обмена. Три признака реакций ионного обмена. Гидролиз
солей.
26. Растворы неэлектролитов. Закон Рауля. Криоскопия. Эбулиоскопия. Закон Вант-Гоффа. Изотонический коэффициент. Осмос.
27. Окислительно-восстановительные реакции. Степень окисления. Определение степени окисления элементов в сложных соединениях. Окислители и восстановители. Процессы окисления и восстановления в окислительно-восстановительных реакциях. Зависимость окислительно-восстановительных свойств элементов от их расположения в таблице Менделеева и степени окисления.
28.Классификация окислительно-восстановительных реакций. Метод электронного баланса для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
29. Метод ионных полуреакций для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
30. Электрохимические процессы. Гетерогенные окислительно-восстановительные реакции. Явление на границе металл – водный раствор электролита. Возникновение скачков потенциалов на границе раздела фаз. . Механизм образования двойного электрического слоя.
31. Гальванический элемент (Якоби-Даниэля). Процессы, протекающие в гальваническом элементе. Электродвижущая сила.
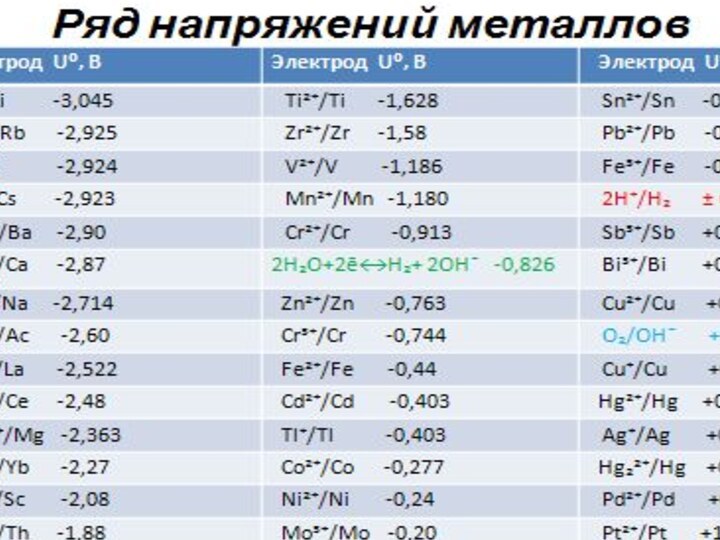
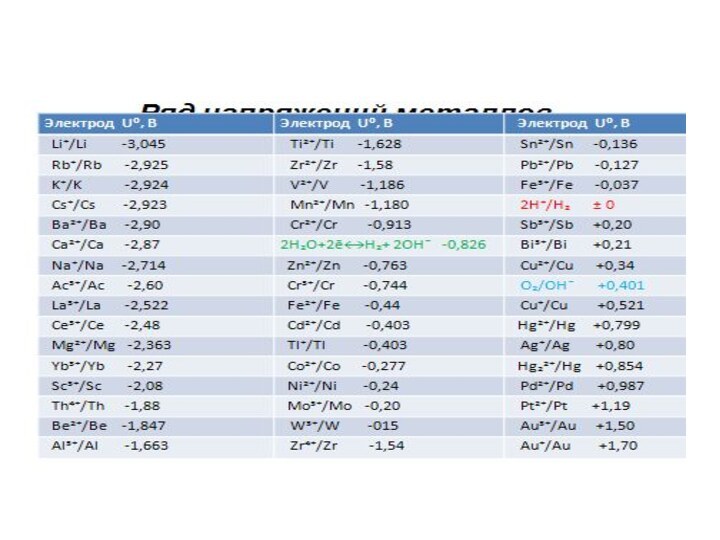
32. Сравнение электрохимических свойств металлов. Стандартный водородный электрод. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Основные выводы из ряда напряжений.
33. Типы электродов. Зависимость величины электродных потенциалов от концентрации растворов. Уравнение Нернста. Вычисление ЭДС гальванических элементов. Анодная и катодная поляризация.
34. Устройство и принцип работы аккумуляторов. Сернокислотный аккумулятор.
35. Электролиз водных растворов и расплавов солей. Электролиз с растворимым и не растворимым анодами. Последовательность процессов, протекающих на электродах. Особенности анодного и катодного процессов. Количественные законы электролиза Фарадея. Выход по току.
36. Коррозия металлов. Виды коррозии по характеру разрушения и механизму реализации. Химическая коррозия. Газовая коррозия. Электрохимическая коррозия с кислородной и водородной деполяризацией. Виды электрохимической коррозии.
Слайд 4
24. Диссоциация воды. Ионное произведение воды, рН растворов.
25.

Реакции ионного обмена. Три признака реакций ионного обмена. Гидролиз
солей.
26. Растворы неэлектролитов. Закон Рауля. Криоскопия. Эбулиоскопия. Закон Вант-Гоффа. Изотонический коэффициент. Осмос.
27. Окислительно-восстановительные реакции. Степень окисления. Определение степени окисления элементов в сложных соединениях. Окислители и восстановители. Процессы окисления и восстановления в окислительно-восстановительных реакциях. Зависимость окислительно-восстановительных свойств элементов от их расположения в таблице Менделеева и степени окисления.
28.Классификация окислительно-восстановительных реакций. Метод электронного баланса для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
29. Метод ионных полуреакций для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
30. Электрохимические процессы. Гетерогенные окислительно-восстановительные реакции. Явление на границе металл – водный раствор электролита. Возникновение скачков потенциалов на границе раздела фаз. . Механизм образования двойного электрического слоя.
31. Гальванический элемент (Якоби-Даниэля). Процессы, протекающие в гальваническом элементе. Электродвижущая сила.
32. Сравнение электрохимических свойств металлов. Стандартный водородный электрод. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Основные выводы из ряда напряжений.
33. Типы электродов. Зависимость величины электродных потенциалов от концентрации растворов. Уравнение Нернста. Вычисление ЭДС гальванических элементов. Анодная и катодная поляризация.
34. Устройство и принцип работы аккумуляторов. Сернокислотный аккумулятор.
35. Электролиз водных растворов и расплавов солей. Электролиз с растворимым и не растворимым анодами. Последовательность процессов, протекающих на электродах. Особенности анодного и катодного процессов. Количественные законы электролиза Фарадея. Выход по току.
36. Коррозия металлов. Виды коррозии по характеру разрушения и механизму реализации. Химическая коррозия. Газовая коррозия. Электрохимическая коррозия с кислородной и водородной деполяризацией. Виды электрохимической коррозии.
Слайд 5
37. Методы защиты от коррозии. Защитные покрытия: металлические

(анодные, катодные) и неметаллические. Электрохимическая защита металлов от коррозии:
протекторная, катодная. Изменение свойств коррозионной среды. Легирование.
38. Дисперсные системы. Коллоидные растворы. Классификация. Свойства. коллоидных растворов. Строение мицеллы. Способы получения и разрушения коллоидных растворов. Правила Панета-Фаянса, Шульце-Гарди.
39. Поверхностные явления. Сорбция. Классификация сорбционных процессов.
40. Строение и свойства органических соединений. Теория Бутлерова. Особенности свойств органических соединений. Гомологические ряды. Изомерия.
41. Классификация органических соединений. Углеводороды и галогенопроизводные. Кислород- и азотсодержащие органические соединения.
42. Высокомолекулярные соединения (ВМС) . Свойства. Получение ВМС. Полимеризация. Поликонденсация. Белки. Структура белков.
43. Идентификация неорганических веществ. Качественный и количественный анализ. Методы анализа. Групповые реактивы.
Слайд 6
2.2. ПРАКТИЧЕСКАЯ ЧАСТЬ
Задачи
– составление электронных конфигураций атомов элементов;
–

определение типа химической связи в молекуле и ее полярности;
–
определение изменения скорости химической реакции при изменении температуры, концентрации реагирующих веществ;
– определение направления смещения химического равновесия;
– определение теплового эффекта и энтропии реакции;
– определение возможности протекания реакции при различных условиях;
– определение константы и степени диссоциации;
– составление уравнений реакции гидролиза и определение характера среды при протекании гидролиза;
– составление уравнений реакций ионного обмена в молекулярной и ионной формах;
– подбор коэффициентов в уравнениях ОВР методом электронного баланса;
– расчет ЭДС гальванического элемента, составление схемы гальванического элемента, уравнений анодного и катодного процессов, протекающих при работе гальванического элемента;
– составление уравнений анодного и катодного процессов, протекающих при электролизе водных растворов солей;
– определение деполяризатора при электрохимической коррозии, составление схемы коррозионного гальванического элемента. Составление уравнения реакции коррозионного разрушения металла;
– расчет концентрации (молярной, нормальной, массовой доли ) водных растворов кислот, щелочей и солей;
– составление формул коллоидных частиц;
– определение изменения температуры кипения и замерзания растворов неэлектролитов.
Слайд 7
2.3. ПРИМЕР БИЛЕТА ДЛЯ ИТОГОВОГО КОНТРОЛЯ ЗНАНИЙ
Билет №

Пример
1. Для окислительно-восстановительного уравнения реакции подберите коэффициенты методом электронного
баланса. Укажите окислитель, восстановитель, процессы окисления и восстановления.
KMnO4+Na2SO3+H2SO4=MnSO4+Na2SO4 +K2SO4 +H2O
2. Определите символ элемента, его положение в таблице Д. И. Менделеева (период, группа, семейство). Опишите химические свойства элемента на примере кратких электронных и электронно-графических формул в нормальном (основном) , возбужденном и (или) ионизированном состоянии.
3Э
3. Дайте название комплексному соединению. Укажите внешнюю, внутреннюю сферы, комплексообразователь, лиганды, координационное число, донор, акцептор. Напишите реакции диссоциации комплекса в водном растворе и выражение константы нестойкости. Поясните характер химических связей в комплексе.
К3[Fe(CN)6]
4. Напишите выражение закона действующих масс для данного процесса. Укажите каким (какими) фактором (ами) можно сместить равновесие процесса в прямом или обратном направлениях.
C(k)+O2 (г) → CO2(г)
5. Напишите уравнение электролитической диссоциации соли, формулы кислоты и основания, образующих данную соль с указанием их силы. Укажите тип гидролиза. Напишите краткие ионные и ионно-молекулярные уравнения гидролиза (по первой ступени) по всем ступеням. Укажите реакцию среды (рН) и условия протекания гидролиза до конца.
Na2CO3
6. Напишите электродные реакции электролиза раствора соли с инертным анодом. Укажите, как можно определить массу выделяющегося вещества.
NaCl
7. Составьте схему гальванического элемента. Укажите направление движения электронов. Напишите уравнения анодного и катодного процессов, составьте суммарное ионное уравнение окислительно-восстановительной реакции в ГЭ и уравнение процесса электрохимической коррозии на основе этой гальванопары во влажном воздухе и кислой среде.
Zn/Cu
Слайд 9
1). Записать уравнение в следующем порядке:
окислитель, восстановитель, среда,→, продукт восстановления окислителя, продукт окисления восстановителя, побочные продукты, среда
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
Слайд 10
2).Рассчитать степени окисления всех атомов в молекулах реагирующих
веществ
+1+7-2 +1+4-2 +1+6-2 +2+6-2
+1+6-2 +1+6-2 +1-2
KMnO₄ + Na₂SO₃ + H₂SO₄ → MnSO₄ + Na₂SO₄ + К₂SO₄ + H₂O
+1+7-8 +2+4-6 +2+6-8 +2+6-8 +2+6-8 +2+6-8 +2-2
Слайд 11
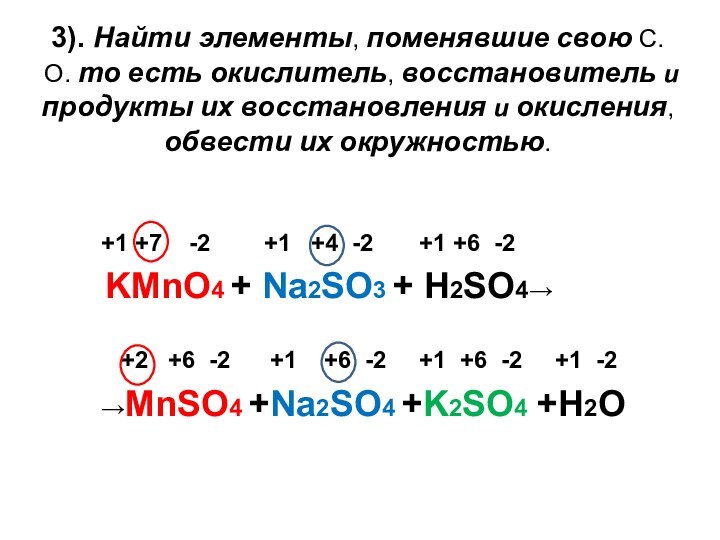
3). Найти элементы, поменявшие свою С.О. то есть
окислитель, восстановитель и продукты их восстановления и окисления, обвести
их окружностью.
+1 +7 -2 +1 +4 -2 +1 +6 -2
KMnO4 + Na2SO3 + H2SO4→
+2 +6 -2 +1 +6 -2 +1 +6 -2 +1 -2
→MnSO4 +Na2SO4 +K2SO4 +H2O
Слайд 12
4).Выписать найденные элементы отдельно в том количестве, в
котором они входят в состав молекулы. Если слева и
справа получилось разное число атомов, уравнять их.
+7 +2
(о-ль) Mn +5ē → Mn (в-е)
+4 +6
(в-ль) S -2ē → S (о-е)
Слайд 13
5).Подобрать такое количество окислителя и восстановителя, чтобы электроны,
теряемые восстановителем, полностью поглощались окислителем
+7 +2
(о-ль) Mn +5ē → Mn 2 (в-е)
+4 +6 10
(в-ль) S -2ē → S 5 (о-е)
Слайд 14
6).Полученные коэффициенты перенести в основное уравнение и расставить
перед окислителем, восстановителем и продуктами их взаимодействия
2KMnO4 +5Na2SO₃ +H2SO4→ 2MnSO4 + 5Na2SO4 +K2SO4 +H2O
Слайд 15
7). Уравнять число катионов, не поменявших свою степень
окисления (С.О.)
2КMnO4 + 5Na2SO₃ +
H2SO4 → 2MnSO4 +5Na2SO4 +1К₂SO4 +H2O
Слайд 16
8).Уравнять число анионов, не изменивших свою степень окисления
(С.О.)
2КMnSO4 + 5Na2SO3
+3H2 SO₄→ 2MnSO₄+5Na2SO4 +1K2 SO4 +H2O
Слайд 17
9).Уравнять число атомов водорода и по кислороду проверить
правильность расстановки коэффициентов. Слева и справа должно быть одинаковое
число атомов кислорода
2KMnO4 + 5Na2SO3 + 3H2SO4=
2MnSO4 + 5Na2SO4 + 1K2SO4 + 3H2О
O = O
8+15+12=35 8+20+4+3=35
Слайд 18
Задание №2
Строение атома,
таблица элементов,
химическая связь
Слайд 20
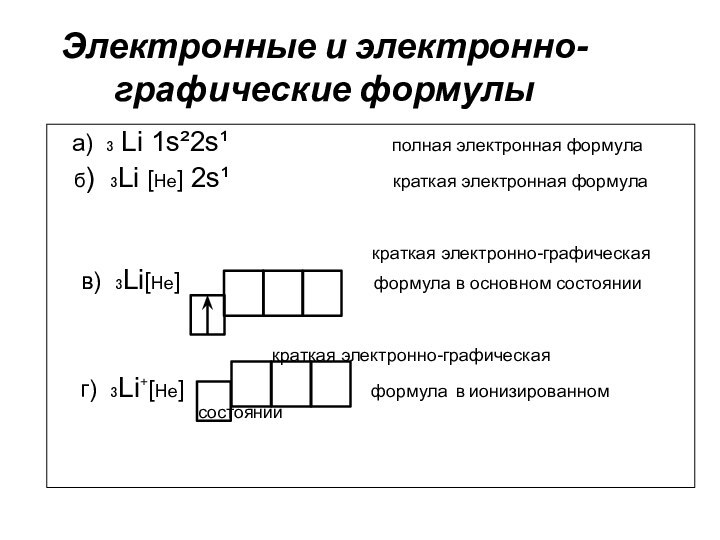
Электронные и электронно-графические формулы
а) ₃ Li
1s²2s¹
полная электронная формула
б) ₃Li [He] 2s¹ краткая электронная формула
краткая электронно-графическая в) ₃Li[He] формула в основном состоянии
краткая электронно-графическая
г) ₃Li⁺[He] формула в ионизированном состоянии
Слайд 21
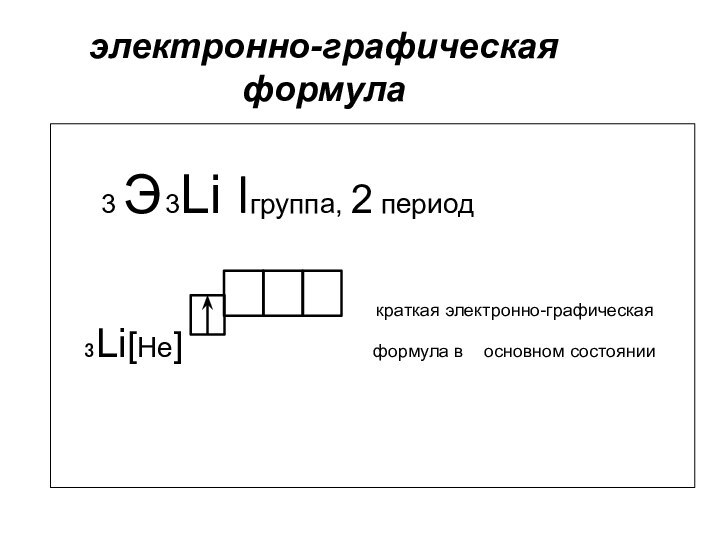
электронно-графическая формула
3 Э 3Li lгруппа, 2
период
краткая электронно-графическая ₃Li[He] формула в основном состоянии
Слайд 22
Задание № 3
Комплексные соединения
Слайд 23
Анализ комплекса
К₃[Fe(CN)₆]
Гексацианоферрат (lll) калия
3K⁺ -
внешняя сфера
[Fe(CN)₆]³¯- внутренняя сфера
Fe³⁺ - комплексообразователь
CN¯ - лиганды
6 - координационное число
Слайд 24
Задание № 4
химическая кинетика
Слайд 25
Закон действующих масс (ЗДМ)
1864 г. Н.Н.Бекетов, 1867г.
Гульдберг, Вааге.
2А+В→С
Vх.р.= К∙[A]²∙[B]
K
– константа скорости
[А] – молярная концентрация вещества А Скорость химической реакции пропорциональна произведению концентрации реагирующих веществ в степенях равных их стехиометрическим коэффициентам
Слайд 26
Пример кинетического уравнения
С₍к₎ + О₂₍г₎ → CO₂₍г₎
V→K[O₂]
Слайд 28
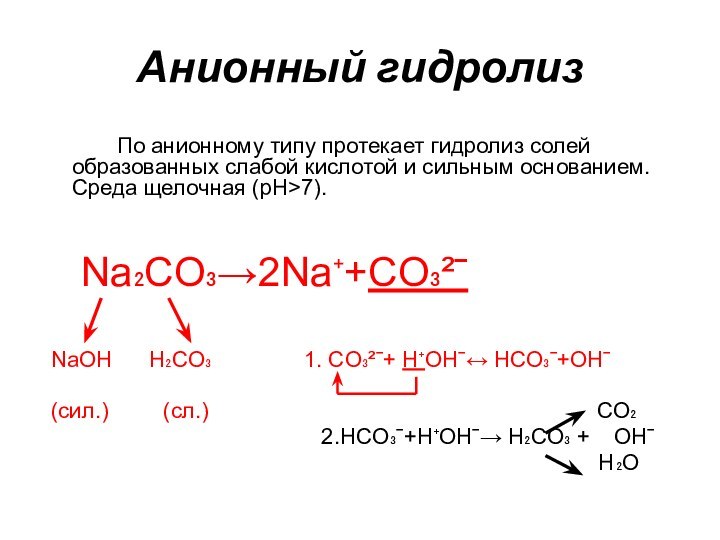
Анионный гидролиз
По анионному типу протекает гидролиз солей образованных
слабой кислотой и сильным основанием. Среда щелочная (рН>7).
Na₂CO₃→2Na⁺+CO₃²ˉ
NaOH H₂CO₃ 1. CO₃²ˉ+ H⁺OHˉ↔ HCO₃ˉ+OHˉ
(сил.) (сл.) CO₂
2.HCO₃ˉ+H⁺OHˉ→ H₂CO₃ + OHˉ
H₂O
Слайд 31
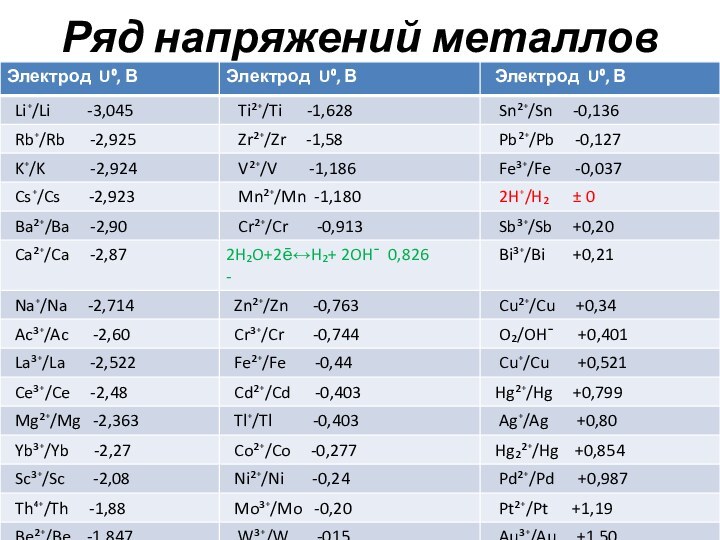
Характеристики ряда напряжений
Металлы в ряду напряжений расположены в
порядке возрастания значения стандартного электродного потенциала.
Металл, стоящий в ряду
напряжения до водорода вытесняет его из разбавленных растворов кислот (искл. азотная).
Металл, стоящий в ряду напряжения выше (левее) вытесняет из раствора соли металл, стоящий в ряду напряжения ниже (правее)
Металл, стоящий в ряду напряжения выше (левее) в ГЭ будет анодом, а металл, стоящий в ряду напряжения ниже (правее)-катодом.
Чем дальше в ряду напряжений будут отстоять друг от друга металлы, тем больше будет величина ЭДС в ГЭ.
Слайд 32
Схема электролиза
Катодный процесс
1.Группa (от Li до Al) U⁰Meⁿ⁺/Me
2H₂O+2ē→H2+2OH⁻
2. Группа (от Al до Н)
U⁰Al³⁺/Al < U⁰Meⁿ⁺/Me < < U⁰2H⁺/H₂
2H₂O+2ē→H₂+2OH⁻ Meⁿ⁺+nē→Me⁰
3. Группа (от Н до Au) U⁰Meⁿ⁺/Me>U⁰2H⁺/H₂
Meⁿ⁺+nē→Me⁰
Анодный процесс
На инертном аноде (С, Рt)
1.Бескислородные анионы
Cl⁻, Br⁻, S²⁻, H₂O
2Br⁻ - 2ē → Br₂
2. Кислородсодержащие анионы
NO₃⁻, SO₄²⁻, H₂O
2H₂O- 4ē → O₂ + 4H⁺
На активном аноде (Ме )
Ме – nē→Меⁿ⁺
Слайд 34
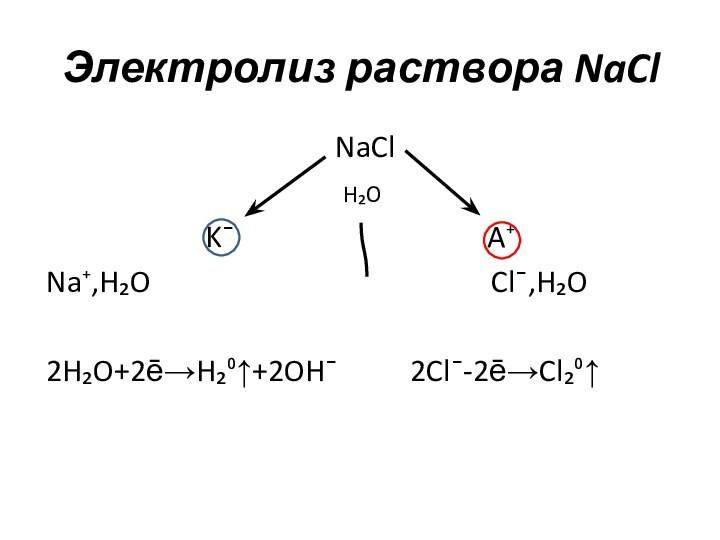
Электролиз раствора NaCl
NaCl
H₂O
K¯ A⁺
Na⁺,H₂O Cl¯,H₂O
2H₂O+2ē→H₂⁰↑+2OH¯ 2Cl¯-2ē→Cl₂⁰↑
Слайд 35
Задание №7
Гальванический элемент и коррозия металлов
Слайд 36
Схема и работа гальванического элемента
Zn/Cu
U⁰Zn²⁺/Zn= - 0,76 В
U⁰Cu²⁺/Cu=
+ 0,34 В
А⁻ Zn|Zn²⁺||Cu²⁺|Cu К⁺
А: Zn
– 2ē → Zn²⁺ (окисление)
К: Cu²⁺ + 2ē → Cu (восстановление)
Слайд 37
Схема ГЭ, работа ГЭ
A¯ Zn Zn²⁺ Cu²⁺ Cu K⁺
A: Zn-2e→Zn²⁺(окисление)
K: Cu²⁺+2e→Cu (восстановление)
ЭДС = Ек-Еа
ЭДС = +0,34-(- 0,76)= 1,1 В
Слайд 39
Задание № 1 (ОВР)
Для окислительно-восстановительного уравнения реакции подберите
коэффициенты методом электронного баланса. Укажите окислитель, восстановитель, процессы окисления
и восстановления.
KBr+KBrO3+H2SO4→Br2+K2SO4+H2O
Слайд 40
Задание № 2 (СА)
2. Определите символ элемента, его
положение в таблице Д. И. Менделеева (период, группа, семейство). Напишите краткую
электронно-графическую формулу элемента в нормальном (основном) состоянии.
92Э
Слайд 43
Задание № 3 (КС)
3. Дайте название комплексному соединению.
Укажите внешнюю, внутреннюю сферы, комплексообразователь, лиганды, координационное число.
[Со(Н₂О)₂(NН₃)₄]СI₃
Слайд 44
Задание № 4 (ХК)
4. Напишите выражение закона действующих
масс для данного процесса.
Fе+СО₂↔FеО+СО
Слайд 45
Задание № 5 (ГС)
5. Напишите уравнение электролитической диссоциации
соли, формулы кислоты и основания, образующих данную соль с
указанием их силы. Укажите тип гидролиза. Напишите краткое ионное уравнение гидролиза по первой ступени. Укажите реакцию среды (рН).
АI₂(SО₄)₃
Слайд 48
Задание № 6 (Электролиз)
6. Напишите электродные реакции электролиза
раствора соли с инертным анодом.
Nа₂SО₄


















![Вопросы к экзамену по химии Анализ комплекса К₃[Fe(CN)₆]Гексацианоферрат (lll)](/img/tmb/13/1259660/6e51a482fb1eb7111044662803e03279-720x.jpg)


![Вопросы к экзамену по химии Пример кинетического уравнения С₍к₎ + О₂₍г₎ → CO₂₍г₎ V→K[O₂]](/img/tmb/13/1259660/476bd8cb8bf2e9202e419b6b43f7b258-720x.jpg)