- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Задания на ЕГЭ
Содержание
- 2. А1(2004 г., 38%) Восьмиэлектронную внешнюю оболочку имеет ион1) P3+ 2) S2- 3) Cl5+ 4) Fe3+
- 3. А19 (2004, 13,3%) Верным является высказывание 1)
- 4. A9 (2004г, 7%) Верны ли следующие суждения
- 5. А13 (2005, 32%) Гидроксид цинка реагирует с
- 6. A15 (2005г, 17%) Карбонат натрия не реагирует
- 7. А24 (2005, 34%) Под скоростью химической реакции
- 8. A15 (2005г, 17%) Карбонат натрия не реагирует
- 9. А23 (2004, 23%) Для увеличения скорости реакции2AgNO3(тв)
- 10. А24 (2005, 46%) Для увеличения скорости реакции4Fe(тв.)
- 11. A24 (2004г, 22%) Экзотермической является реакция1) MgCO3
- 12. A24 (2004г, 22%) Экзотермической является реакция1) MgCO3
- 13. A27 (2004г, 12,2%) Взаимодействию сульфата меди и
- 14. A25 (2005г, 49%) В системе СН3СООН +
- 15. A19(2005, 57%) В молекуле пропина атом углерода
- 16. A30 (2005, 47%) Для получения бутена-2 из
- 17. А31 (2004, 19,6%) При взаимодействии бутина-1 с
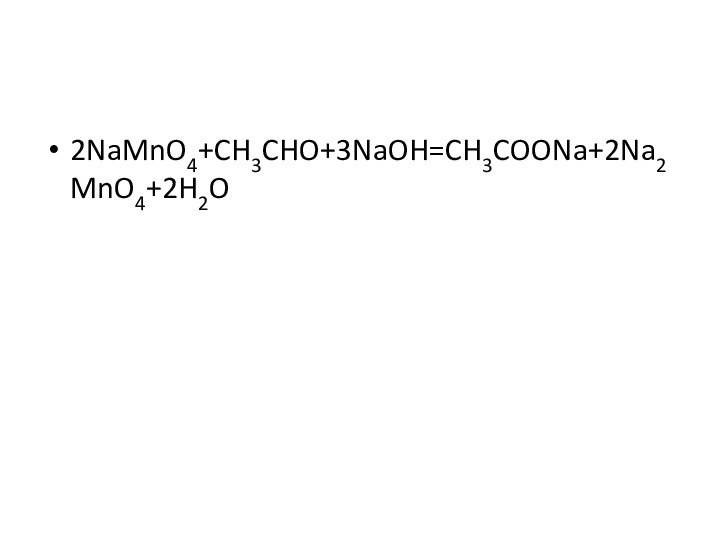
- 18. 2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
- 19. Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:Mg+MgCl2+2H2O=2MgOHCl+H2
- 20. окислительных свойствах солей трехвалентного железа:2FeCl3+Cu=CuCl2+2FeCl2
- 21. Амфотерные гидроксиды растворяются в водных растворах щелочей:A1(OH)3 + 3KOH = K3[A1(OH)6]A1(OH)3 + KOH = K[Al(OH)4]
- 22. Традиционно вызывают затруднения, связанные с проявлением основных
- 23. Пример взаимного гидролиза солей:A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
- 24. Число σ-связей в молекуле ацетона равно:
- 25. Могут пригодиться знания об аммиачных комплексах:CuSO4+4NH3=[Cu(NH3)4]SO4AgCl+2NH3=[Ag(NH3)2]Cl
- 26. растворы амфотерных гидроксидов в избытке щелочи обладают
- 27. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:MgSO4+Na2CO3=MgCO3+Na2SO42MgSO4+2Na2CO3+H2O=(MgOH)2CO3+2Na2SO4+CO22MgSO4+2Na2CO3+2H2O=2Mg(OH)2+2Na2SO4+2CO2
- 28. А31 (2004, 19,6%) При взаимодействии бутина-1 с
- 29. А16 (2004, 14,4%) Этанол взаимодействует с 1)
- 30. А17(2004, 32,3%) Олеиновая кислота совмещает в себе
- 31. А32 (2005, 39%) Метиламин реагирует с каждым
- 32. А31 (2004, 32%) Амфотерными свойствами обладает1) метиламин 2) глицин 3) анилин 4) фенол
- 33. А31 (2005, 46%) В оцинкованном сосуде нельзя хранить раствор1) Na2SO4 2) MgCl2 3) С2Н5ОН 4) СН3СООН
- 34. А34 (2005, 22%) В производстве серной кислоты
- 35. Для спиртов характерны реакции: 1полимеризации
- 36. В перечне названий метаналь
- 37. Используя метод электронного баланса, составьте уравнение SO2
- 38. А34 (2005, 35%) Сырье для получения метанола
- 39. Степени окисления кислорода возрастают в ряду веществ:
- 40. К одному классу неорганических соединений принадлежат вещества,
- 41. Графит и алмаз — это:
- 42. А34 (2004, 16,8%) Из каменноугольной смолы получают1) этанол 2) кокс 3) бензол 4) бензин
- 43. Скачать презентацию
- 44. Похожие презентации
А1(2004 г., 38%) Восьмиэлектронную внешнюю оболочку имеет ион1) P3+ 2) S2- 3) Cl5+ 4) Fe3+



















![Задания на ЕГЭ Амфотерные гидроксиды растворяются в водных растворах щелочей:A1(OH)3 + 3KOH = K3[A1(OH)6]A1(OH)3 + KOH = K[Al(OH)4]](/img/tmb/15/1406451/7fc22b2cd7d4cf104026b52727b5028e-720x.jpg)



![Задания на ЕГЭ Могут пригодиться знания об аммиачных комплексах:CuSO4+4NH3=[Cu(NH3)4]SO4AgCl+2NH3=[Ag(NH3)2]Cl](/img/tmb/15/1406451/6721a56e0f7de5ba04b85a76ab8eddcd-720x.jpg)


















Слайд 3
А19 (2004, 13,3%) Верным является высказывание
1) глюкоза
– это пятиатомный альдегидоспирт
2) фруктоза – это шестиатомный спирт
3)
крахмал – это полисахарид, состоящий из остатков фруктозы4) сахароза – это дисахарид, состоящий из двух молекул глюкозы
Слайд 4
A9 (2004г, 7%) Верны ли следующие суждения о
неметаллах?
А. В периодической системе неметаллы расположены в правой,
преимущественно верхней части.Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
Слайд 5
А13 (2005, 32%) Гидроксид цинка реагирует с каждым
из двух веществ:
1) НС1 и MgSO4
2) NaOH и H2SO4
3)
NaOH и KNO34) MgCl2 и HNO3
Слайд 6
A15 (2005г, 17%) Карбонат натрия не реагирует с
1) гидроксидом бария 2) гидроксидом калия
3) серной кислотой
4) углекислым газом
Слайд 7
А24 (2005, 34%) Под скоростью химической реакции понимают
изменение
1) концентрации реагента в единицу времени
2) количества вещества реагента
в единицу времени3) количества вещества реагента в единице объема
4) количества вещества продукта в единице объема
Слайд 8
A15 (2005г, 17%) Карбонат натрия не реагирует с
1) гидроксидом бария 2) гидроксидом калия
3) серной кислотой
4) углекислым газом
Слайд 9
А23 (2004, 23%) Для увеличения скорости реакции
2AgNO3(тв) =
2Ag(тв) + 3O2(г) + 2NO2(г) - 157 кДж необходимо
1)
увеличить концентрацию AgNO32) уменьшить давление в системе
3) увеличить степень измельченности AgNO3
4) уменьшить температуру
Слайд 10
А24 (2005, 46%) Для увеличения скорости реакции
4Fe(тв.) +
3О2(газ) = 2Fe2O3(тв) + Q следует
1) уменьшить температуру
2) увеличить
температуру3) уменьшить концентрацию кислорода
4) увеличить количество железа
Слайд 11
A24 (2004г, 22%) Экзотермической является реакция
1) MgCO3 =
MgO + CO2
2) Fe2O3 + 2Al = 2Fe +
Al2O33) C + CO2 = 2CO
4) 2CH4 = C2H2 + 3H2
Слайд 12
A24 (2004г, 22%) Экзотермической является реакция
1) MgCO3 =
MgO + CO2
2) Fe2O3 + 2Al = 2Fe +
Al2O33) C + CO2 = 2CO
4) 2CH4 = C2H2 + 3H2
Слайд 13
A27 (2004г, 12,2%) Взаимодействию сульфата меди и сероводорода
отвечает сокращенное ионное уравнение:
1) Cu2+ + Н2S = CuS
+ 2Н+ 2) CuSO4 + 2Н+ = Cu2+ + Н2SO4
3) CuSO4 + S2– = CuS + SO42–
4) Cu2+ + S2– = CuS
Слайд 14
A25 (2005г, 49%) В системе СН3СООН + СН3ОН
« СН3СООСН3 + Н2О
смещению химического равновесия в сторону образования
сложного эфира будет способствовать1) добавление метанола
2) повышение давления
3) повышение концентрации эфира
4) добавление гидроксида натрия
Слайд 15
A19(2005, 57%) В молекуле пропина атом углерода при
тройной связи образует:
1) 4 s-связи
2) 2 s- и 2 p-связи3) 3 s- и p-связь 4) 1 s- и 3 p-связи
Слайд 16
A30 (2005, 47%) Для получения бутена-2 из 2-бромбутана
следует использовать
1) водный раствор серной кислоты
2) водный раствор гидроксида
калия3) спиртовой раствор гидроксида калия при нагревании
4) никелевый катализатор
Слайд 17
А31 (2004, 19,6%) При взаимодействии бутина-1 с водой
в присутствии солей ртути образуется преимущественно
1) бутанол-1 2)
бутанол-2 3) бутаналь 4) бутанон
Слайд 19
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза,
способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
Слайд 21
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 +
3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
Слайд 22
Традиционно вызывают затруднения, связанные с проявлением основных свойств
раствором аммиака. В результате чего могут протекать обменные реакции
в водных растворах:MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
Слайд 25
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Слайд 26
растворы амфотерных гидроксидов в избытке щелочи обладают всеми
свойствами щелочей. Они способны вступать в реакции с кислотами
и кислотными оксидами Na[Al(OH)4]+HCl=NaCl+Al(OH)3+H2ONa[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3
Слайд 27
Так для взаимодействия раствора сульфата магния с карбонатом
натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2+2Na2SO4+2CO2
Слайд 28
А31 (2004, 19,6%) При взаимодействии бутина-1 с водой
в присутствии солей ртути образуется преимущественно
1) бутанол-1 2)
бутанол-2 3) бутаналь 4) бутанон
Слайд 29
А16 (2004, 14,4%) Этанол взаимодействует с
1) метанолом
2) бромной водой 3) водородом 4) медью
Слайд 30
А17(2004, 32,3%) Олеиновая кислота совмещает в себе свойства
карбоновой кислоты и
1) амина 2) алкена 3) алкина 4)
спирта
Слайд 31
А32 (2005, 39%) Метиламин реагирует с каждым из
двух веществ:
1) O2 и N2 2) FeCl2 и NH3
3) НС1 и NaCl 4) Н2O и H2SO4
Слайд 33
А31 (2005, 46%) В оцинкованном сосуде нельзя хранить
раствор
1) Na2SO4 2) MgCl2 3) С2Н5ОН 4) СН3СООН
Слайд 34
А34 (2005, 22%) В производстве серной кислоты для
поглощения оксида серы (VI) используют
1) Н2О 2) H2SO3 3)
Н2SО4(конц.) 4) Н2SО4(разб)
Слайд 35
Для спиртов характерны реакции:
1полимеризации 2 этерификации
3дегидратации
4гидратации 5 гидрирования 6 дегидрирования
Слайд 36
В перечне названий
метаналь
метанол
метановая кислота
этаналь
этанол
этановая кислота
к соединениям, вступающим в реакцию серебряного
зеркала, относятся те, которые обозначены цифрами:
1,3,6
1,3,4
3,4,6
1,4,5
Слайд 37
Используя метод электронного баланса, составьте уравнение
SO2 + K2Cr2O7
+ … → K2SO4 + …+ H2O
P + HNO3
+… → NO +…
Слайд 38
А34 (2005, 35%) Сырье для получения метанола в
промышленности служат
1) СН3Cl и NaOH 2) HCHO и H2
3) CO и Н2 4) НCOOH и NaOH
Слайд 39
Степени окисления кислорода возрастают в ряду веществ:
Na2SO3,
Na2S2O3, Na2SO4
Na2O, Na2O2, O2F2
O3, OF2, Cl2O
CaO2,CaO,Ca(ClO)2
Слайд 40
К одному классу неорганических соединений принадлежат вещества, формулы
которых:
NaOH, CuOH, Cu(OH)2, FeSО4·7H2О;
K2О, NO, P2О5, OF2;
HCN,
CH3COOH, H2SО4, HNО2;
Ca3N2, BaSО4, Fe2(SО4)3, NaCl
Слайд 41
Графит и алмаз — это:
разные химические элементы;
одно и то же вещество;
аллотропные видоизменения одного химического
элемента;
разные агрегатные состояния одного вещества





























