- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Содержание
- 2. Сегодня мы с вами должны вспомнить, чем
- 3. Давайте вспомним:1.Основной закон, описывающий состояние газовназывают законом
- 4. Проверьте друг друга.1.Авогадро, 2.22,4 л/моль,
- 5. Попробуй реши:
- 6. Сверьте ответы… 1 ВариантЗадача
- 7. План изучения новой темыФизические Свойства Воды3Особенности Жидкостей1Жесткость воды4Вода в природе2
- 8. Особенности жидкого состояния вещества.1.Молекулы находятся непосредственно
- 9. Вода в природе.Важнейшим жидким веществом является вода,
- 10. Чем уникальна вода?Физические свойства воды обусловлены строением
- 11. Вода имеет аномально высокую температуру плавления и
- 12. Ещё одна аномалия воды:Лёд благодаря водо-родным связям
- 13. Бывает ли вода «жесткой»?Жесткость природных вод может
- 14. Виды жесткости. Общая жесткость состоит из временной
- 15. ВИДЫ ЖЕСТКОСТИ.КАРБОНАТНАЯ жесткость зависит от содержания
- 16. Что такое «жесткая» вода?Жесткая вода- это накипь
- 17. Устранение жесткости.Кипячение переводит растворимые гидрокарбо -наты в
- 18. Как я усвоил материал?.. Ключ к тесту.
- 19. Подведем итоги.Подсчитайте свои баллы (каждый правильный ответ
- 20. Если Вы получили:
- 21. Скачать презентацию
- 22. Похожие презентации
Сегодня мы с вами должны вспомнить, чем отличаются жидкости от газов, и узнать, почему вода бывает «жесткой».Цель урока:


















Слайд 2 Сегодня мы с вами должны вспомнить, чем отличаются
жидкости от газов, и узнать, почему вода бывает «жесткой».
урока:
Слайд 3
Давайте вспомним:
1.Основной закон, описывающий состояние газов
называют законом _______.
2.Один
моль любого газа занимает объём _____.
3.Атмосферный воздух состоит в
основном из __ и ____.4.Аллотропной модификацией кислорода является ____.
5.Самый легкий газ -______ получают в аппарате Кипа.
6.Углекислый газ получают в промышленности обжигом
_______.
7. Аммиак распознают по изменению окраски влажной
лакмусовой бумаги с красного на ______.
Слайд 4
Проверьте друг друга.
1.Авогадро,
2.22,4 л/моль,
3.Азот, кислород,
4.Озон,
5.Водород,6.Известняка,
7.Синюю.
За каждый правильный ответ – 1 балл.
Слайд 5
Попробуй реши:
1
вариант.
Задача №1.
Какой объём ( при н.у.) будут занимать 2
моль углекислого газа. Задача №2.
Человек выдыхает в сутки 1300 г углекислого газа.
Определите его объём при н.у.
2 вариант
Задача №1.
Какое количество вещества азота содержится в 6,72 л этого газа?
Задача №2.
При дыхании человек потребляет за час около
56 л кислорода (н.у.).
Какое количество вещества кислорода человек потребляет за сутки?
Слайд 6
Сверьте ответы…
1 Вариант
Задача №1.
Ответ:
44,8 л (1 Б)
Задача №2.
Ответ:661,8 л.(2Б)
2 Вариант.Задача №1.
Ответ: 0,3 моль.(1 Б)
Задача №2.
Ответ: 60 моль.(2 Б)
Слайд 7
План изучения новой темы
Физические
Свойства
Воды
3
Особенности
Жидкостей
1
Жесткость воды
4
Вода
в природе
2
Слайд 8
Особенности жидкого
состояния вещества.
1.Молекулы находятся непосредственно друг возле
друга, поэтому жидкости – малосжимаемы, в
отличие от газов;
2.
Текучи,т.е. не имеют формы , а принимают форму сосуда, в котором находятся;3.В состоянии невесомости принимают форму шара
или круглой капли.
Слайд 9
Вода в природе.
Важнейшим жидким веществом является вода, которая
покрывает 2/3 поверхности Земли. 97,2 % общего запаса приходится
на воды Мирового океана. Запас пресной воды на Земле всего 2,8%,но из них пригодна к использованию лишь 0,3% водных ресурсов. Животные, растения и человек на 70-80 % состоят из воды, потеря 15-20 % массы тела в результате обезвоживания приводит к гибели организма. Благодаря круговороту воды в природе её запасы практически неисчерпаемы. Круговорот воды состоит из 2 процессов: испарения и конденсации.
Слайд 10
Чем уникальна вода?
Физические свойства воды обусловлены строением её
молекул, а также межмолекулярными связями.
Молекулы воды имеют угловую форму,
величина угла НОН равна 104 0. Это приводит к появлению в молекуле 2 полюсов. Электронная плотность смещается к атому кислорода. Полярность молекулы воды делает её универсальным растворителем.
Слайд 11
Вода имеет аномально высокую температуру плавления и кипения.
Сравните
молекулярные массы воды и других гидридов элементов
6 А группы с их температурами кипения.Н2О – М(Н2О) = 18 г/ моль
+100 0 Жидкость !
Н2S- M(H2S) = 34 г/ моль
-50 0 Газ
Н2Se- M (H2Se)= 81г/ моль
- 420 Газ
Н2Те- М(Н2Те) = 130 г/ моль
0 0 Газ
Вывод: В группах с увеличением молекулярной массы соединений увеличиваются температуры кипения и плавления веществ.
Причина аномально высокой температуры кипения воды наличие межмолекулярных водородных связей.
Слайд 12
Ещё одна аномалия воды:
Лёд благодаря водо-
родным связям имеет
ячеистое строение и поэтому легче воды. Плотность его 0,92
г/ см3.
Слайд 13
Бывает ли вода «жесткой»?
Жесткость природных вод может меняться
в зависимости от года: она понижается зимой, а летом
–повышается.Природная вода, содержащая в растворе большое количество солей кальция и магния называется жесткой водой.
Содержание солей кальция и магния в воде зависит и от состава почвы в водоносных слоях.
Слайд 14
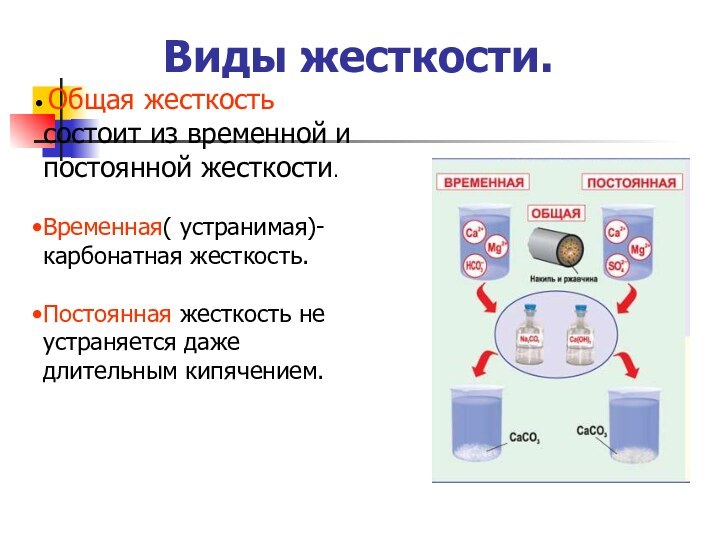
Виды жесткости.
Общая жесткость состоит из временной и
постоянной жесткости.
Временная( устранимая)- карбонатная жесткость.
Постоянная жесткость не устраняется даже
длительным кипячением.
Слайд 15
ВИДЫ ЖЕСТКОСТИ.
КАРБОНАТНАЯ жесткость зависит от
содержания в
воде гидрокарбонатов кальция и магния Са(НСО3)2, Mg(HCO3)2.
Некарбонатная жесткость
вызвана присутствием в воде других солей, например сульфатов кальция и магнияСаSO4, MgSO4
Кислые соли- продукт неполного замещения атомов водорода в кислоте.
Слайд 16
Что такое «жесткая» вода?
Жесткая вода- это накипь на
деталях бытовой техники , стенках котлов и радиаторов.
В жесткой
воде плохоразваривается мясо.
В жесткой воде не мылится мыло.
Слайд 17
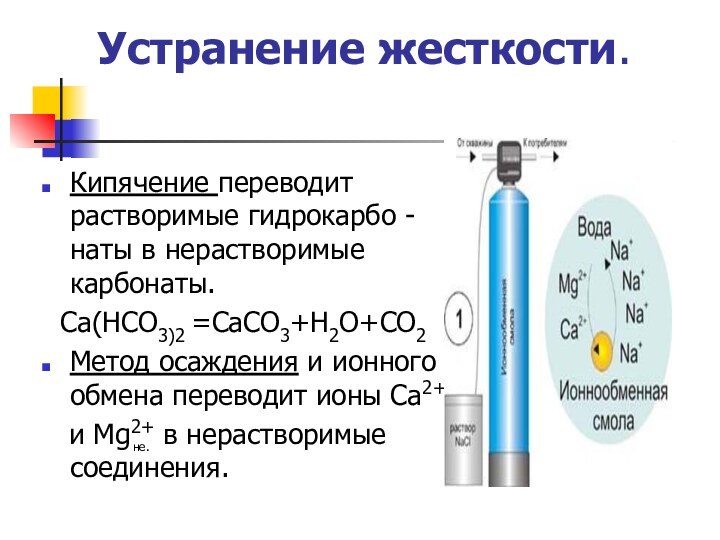
Устранение жесткости.
Кипячение переводит растворимые гидрокарбо -наты в нерастворимые
карбонаты.
Са(НСО3)2 =СаСО3+Н2О+СО2
Метод осаждения и ионного обмена переводит ионы
Са2+и Мg2+ в нерастворимые соединения.
не.
Слайд 19
Подведем итоги.
Подсчитайте свои баллы (каждый правильный ответ теста-
1балл)
Поставьте себе оценку:
12-11 баллов- «пять»
10-9 баллов- «четыре»8-6 баллов- «три»
менее 6 баллов- « два»!
Слайд 20
Если Вы получили:
«5»-§ 9, №11, кроссворд;
«4»-§ 9,
№ 7,10;«3»-§ 9, № 1,3, повторить § 8.
Домашнее задание.





























