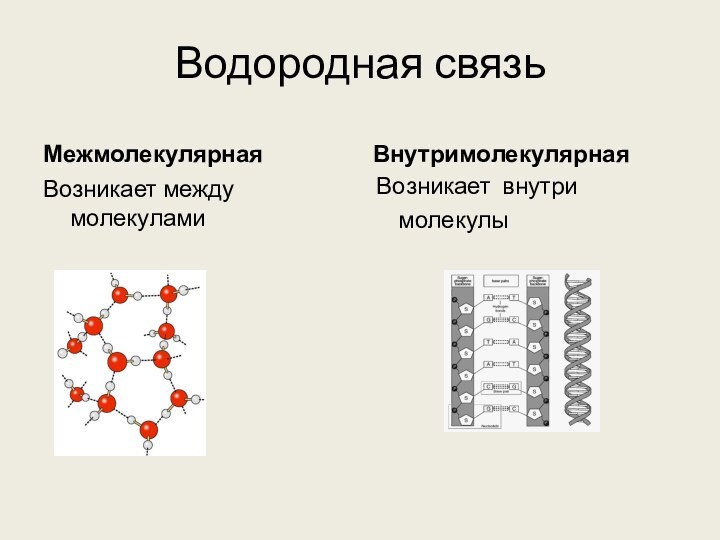
её части) и атомами наиболее электоротрицательных элементов (фтор, кислород,
азот) другой молекулы (или её части) называют водородной.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



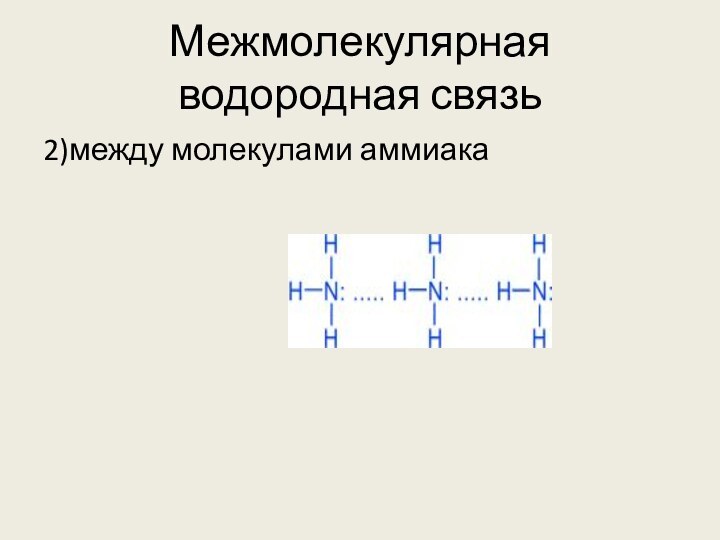

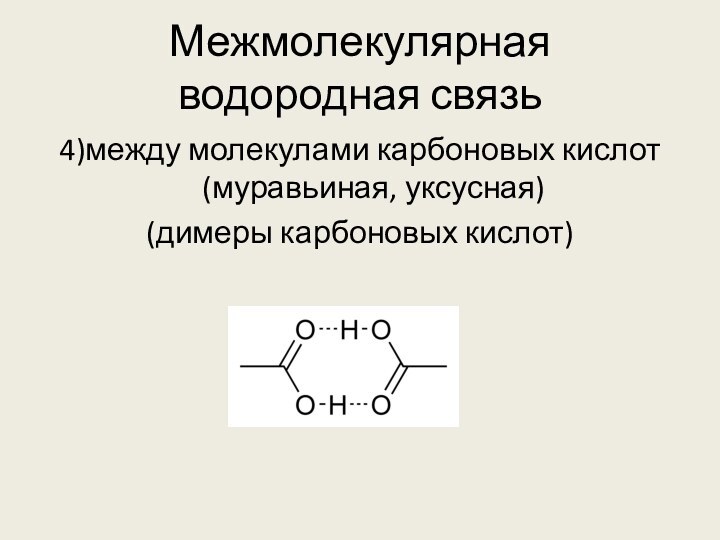










Н δ+ – Fδ⁻ . . . Hδ+ – F δ-
Донорно-акцепторное взаимодействие между почти свободной орбиталью атома водорода и неподеленной электронной парой атома кислорода (фтора или азота)