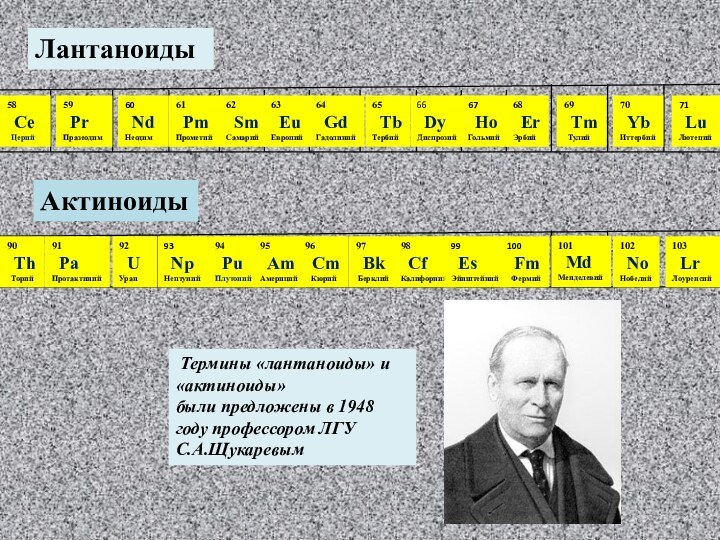
He
2 элемента
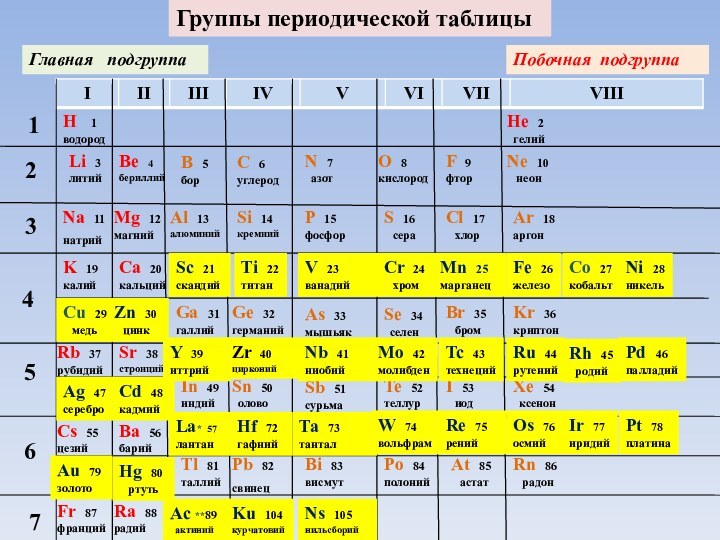
Схема периодов периодической таблицы
II период:
Li Ne 8 элементов
III период: Na Ar
Малые периоды
8 элементов
IV период: K Kr
18 элементов
V период: Rb Xe
18 элементов
VI период: Сs Rn
32 элемента
VII период: Fr не завершен
Большие периоды