Слайд 2
гемопоэз
Более 30 млн клеток в минуту образуется в
кроветворных органах, а в течение жизни человека это составляет
около 7 тонн.
Образующиеся в костном мозге клетки по мере созревания равномерно поступают в кровеносное русло, время циркуляции их постоянно - эритроциты циркулируют 110-130 суток, тромбоциты - около 10 суток, нейтрофилы - менее 10 ч.
Каждый день теряется 1 ×1011 клеток крови, но эти потери постоянно восполняются клеточной фабрикой - костным мозгом - в течение всей жизни человека.
Слайд 3
гемопоэз
Кроветворение (гемопоэз) - многостадийный процесс дифференцировки клеточных элементов,
в результате которого образуются эритроциты, лейкоциты, тромбоциты, составляющие в
норме около 40% объема крови.
Развитие кроветворения происходит со сменой преимущественной локализации его в различные периоды жизни человека, а каждый из кроветворных органов играет особую роль в размножении и созревании гемопоэтических клеток.
Слайд 5
Клетки, способные восстанавливать гемопоэз после облучения или токсических
воздействий, носят название «стволовых клеток».
Впервые термин «стволовые
клетки» был введен в 1908 году
Максимов Александр Александрович
(04.02.1874 – 04.12.1928)
Слайд 6
«Из стволовых клеток можно вырастить любой орган ?»
Орган вырастить нельзя но клетки и ткани –вполне реально
Мифы
и реальность использования «стволовых клеток»
«Стволовые клетки – источник вечной молодости?»
Вечной молодости не будет, но можно улучшить состояние кожи (на время)
?
Слайд 7
способность к самообновлению
способность к дифференцировке
количество стволовых клеток
ограничено
Источники:
Костный мозг
Пуповинная кровь
Периферическая кровь
Cтволовые клетки. Свойства.
Слайд 8
Для лечения лейкозов и других заболеваний крови
При лечении
рассеянного склероза
Стволовые клетки кожи используются при восстановлении после
ожогов, мезенхимальные - для восстановления костной системы.
Стволовые клетки активно используются в тканевой инженерии.
Спектр применения гемопоэтических стволовых клеток расширяется с каждым днем, проводятся исследования в области ревматологии, (аутоиммунное заболевание ревматоидный артрит), кардиологии (ИБС), гепатологии, (токсические циррозы), онкологии, при ишемии конечностей. Даже разрабатывается подход к лечению СПИДа с применением стволовых клеток
Медицинское применение стволовых клеток
Слайд 9
Стволовые клетки
Кроветорные СК
Эмбриональные СК
Стромальные (индуцированные) СК
Слайд 10
Стволовые клетки взрослого организма мультипотентны или унипотентны.
А эмбриональные
стволовые клетки плюрипотентны.
Стволовые клетки по настоящему плюрипотенты только на
самых ранних стадиях развития эмбриона - до7-10 дней.
Эмбриональные стволовые клетки
Слайд 11
Уникальное свойство эмбриональных стволовых клеток — тотипотентность
Проблема №1:
как направить их по пути дифференцировки
Проблема №2: иммунологическая несовместимость
тканей трансплантата и реципиента
Проблема №3: онкогенность!
Проблема №4: этический барьер
«Уникальность и проблемы» эмбриональных стволовых клеток
Слайд 12
Костный мозг состоит из двух видов стволовых клеток:
гемопоэтические стволовые клетки
стромальные стволовые клетки
У новорожденного – на
10 тыс.КСК-1 стромальная СК
У подростков – на 100 тыс.КСК-1 стромальная СК
К 50 годам – на 500 тыс.КСК -1 стромальная СК
К 70 годам – на 1 млн КСК – 1 стромальная СК
Индуцированные (стромальные) стволовые клетки
Слайд 13
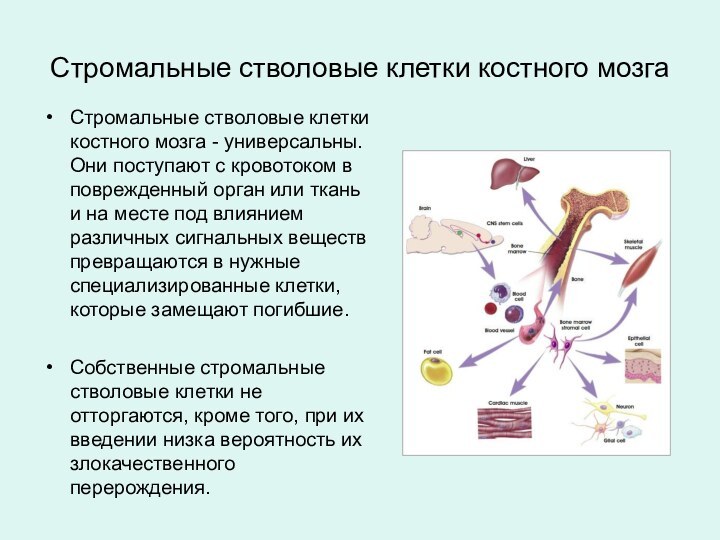
Стромальные стволовые клетки костного мозга - универсальны. Они
поступают с кровотоком в поврежденный орган или ткань и
на месте под влиянием различных сигнальных веществ превращаются в нужные специализированные клетки, которые замещают погибшие.
Собственные стромальные стволовые клетки не отторгаются, кроме того, при их введении низка вероятность их злокачественного перерождения.
Стромальные стволовые клетки костного мозга
Слайд 14
Выделены уникальные вещества: особые белки, вызывающие перерождение стромальных
клеток в клетки костной ткани (остеобласты). В США 91-летней
пациентке с незаживающим в течение 13 лет переломом вживили специальную коллагеновую пластинку с нанесенными на нее этими белками.
Американские исследователи вырастили стволовые клетки мышечной ткани (миобласты) из бедренных мышц 72-летнего пациента-инфарктника. Затем эти клетки ввели ему непосредственно в зону инфаркта, после чего у больного было отмечено значительное улучшение сократительной способности сердца.
Стромальные клетки в клинической практике - это уже реальность.
Слайд 15
В 2012 г. в Стокгольме объявили лауреатов Нобелевской
премии по физиологии и медицине. Награда присуждена Джону Гардону
(Sir John B. Gurdon) и Синъя Яманака (Shinya Yamanaka) за работы в области развития биологии и получения индуцированных стволовых клеток.
Слайд 16
Гемопоэз поддерживается в течение всей жизни за счёт
«стволовых клеток»
Нормальное кроветворение поликлональное, т. е. осуществляется одновременно многими
клонами.
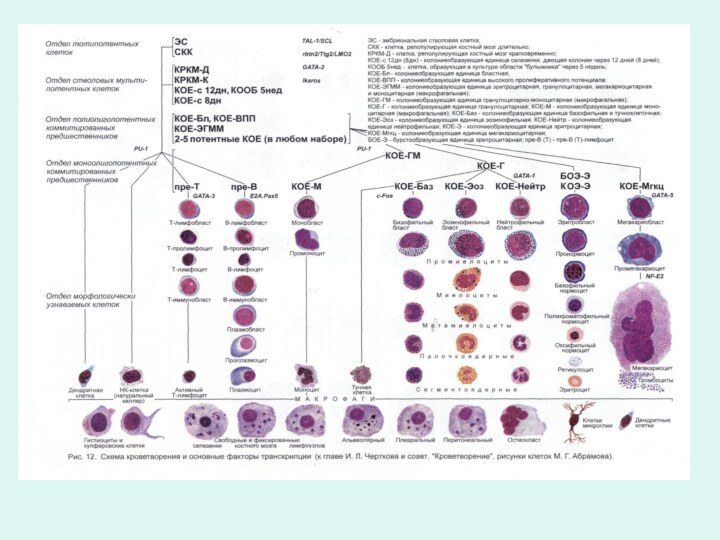
Клетки гемопоэза условно подразделены на 5-6 отделов, границы между которыми весьма размыты, а между отделами содержится много переходных, промежуточным форм.
В процессе дифференцировки происходит постепенное снижение пролиферативной активности клеток и способности развиваться сначала во все кроветворные линии, а затем во все более ограниченное количество линий.
Характеристики нормального гемопоэза
Слайд 18
Регуляция гемопоэза
Позитивные: КСФ, ИЛ-6, ИЛ-11, ИЛ-12
Негативные: TGF-β, MIP-1α,
ФНО-α, интерферон-α, интерферон-γ, кислые изоферритины, лактоферрин и др.
Слайд 19
Регуляция гемопоэза
1. Факторы, влияющие на ранние СКК: фактор
стволовых клеток (ФСК), гранулоцитарный колониестимулирующий фактор (Г-КСФ), интерлейкины (ИЛ-6,
ИЛ-11, ИЛ-12), а также ингибиторы, которые тормозят выход СКК в клеточный цикл из состояния покоя (MIP-la, TGF-в ФНО-а, кислые изоферритины и др.). Эта фаза регуляции СКК не зависит от запросов организма.
2. Линейно-неспецифические факторы - ИЛ-3, ИЛ-4, ГМ-КСФ (для гранулоцитомонопоэза).
3. Позднедействующие линейно-специфические факторы, которые поддерживают пролиферацию и созревание коммитированных предшественников и их потомков. К ним относятся эритропоэтин, тромбопоэтин, колониестимулирующие факторы (Г-КСФ, М-КСФ, ГМ-КСФ), ИЛ-5
Слайд 20
Последовательность ультраструктурных изменений в процессе некроза и
апоптоза
Слайд 21
Молекулярные механизмы апоптоза.
Выделяют два типа сигнальных путей,
вызывающих апоптоз, -
повреждение ДНК, радиация и другие факторы,
вызывающие активацию каспазы-9
сигналы, возникающие при активации Fas-рецептора с
последующей активацией каспазы-8.
Каспазы9 и 8 активируют каспазу-3 и вместе с другими каспазами, протеазами, ДНК-азами вызывают апоптоз.
Слайд 22
Бурстстимулиру-ющая активность
Витамин В12 , фолиевая кислота, железо, медь
Эритропоэз
Слайд 23
Иммунологический маркёр эритробластов – гликофорин А
Дифференцировка и созревание
эритроидных клеток от проэритробласта до эритроцита - в течение
9-14 дней
Способность к пролиферации сохраняется до ранних полихроматофильных эритробластов
В норме эритрокариоциты проходят 5 митозов, в результате чего из 1 эритробласта получается 32 эритроцита
Слайд 24
Синтез гемоглобина начинается на стадии проэритробласта
В норме ранний
полихроматофильный эритробласт подходит к последнему митозу с количеством гемоглобина
27пг. Если количество гемоглобина более 27 пг – теряется способность к делению – образуется крупный ретикулоцит, затем макроцит. Это – терминальное деление (в норме не более 5%).
Если количество гемоглобина более 27 пг на стадии базофильного эритробласта – завершение дифференцировки и апоптоз. Это – неэффективный эритропоэз. В норме 3-8% таких эритрокариоцитов (PAS-положительные эритрокариоциты).
При нехватке железа эритрокариоцит не достигает критической массы гемоглобина для деления и делится преждевременно, образуя микроциты.
Слайд 25
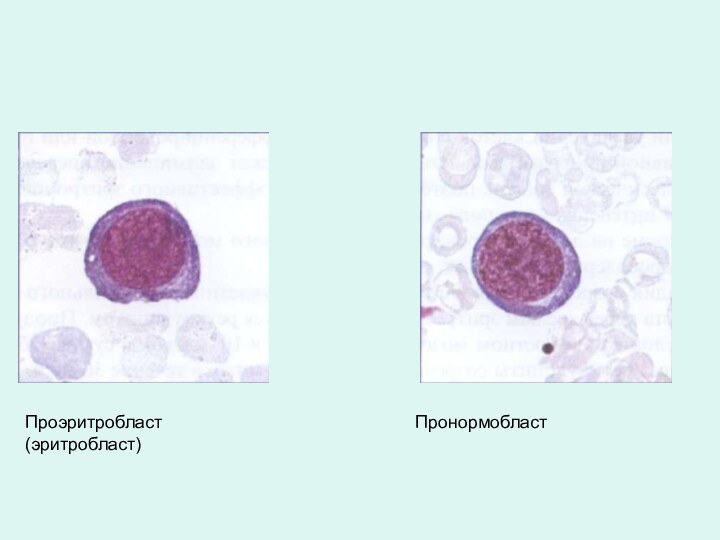
Проэритробласт (эритробласт)
Пронормобласт
Слайд 26
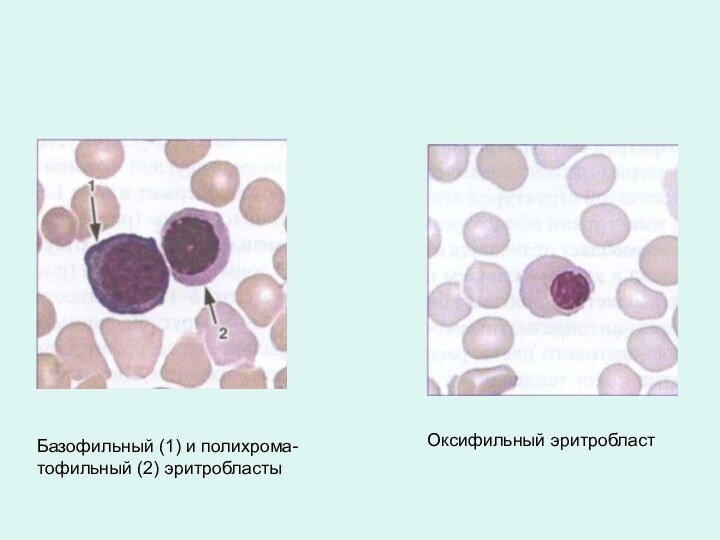
Оксифильный эритробласт
Базофильный (1) и полихрома- тофильный (2) эритробласты
Слайд 28
Распределение популяции ретикулоцитов по степени зрелости
Слайд 29
Диаметр – 7,2-8,0 мкм
Площадь поверхности – 140мкм2
Объём –
90мкм3
Нормохромные
Нормоцит-нормальный эритроцит
Слайд 30
Эритроциты в капилляре существенно
меняют форму за счет деформируемости
мембраны,
что позволяет им
проходить сквозь узкие места и увеличивает
способность к
газообмену с окружающей
тканью
Слайд 32
Функции эритроцитов
Участие в газообмене и поддержании буферного кислотно-основного
равновесия крови
Определяют реологию крови
Участвуют в гемостазе
Участвуют в иммунных процессах,
взаимодействуя с циркулирующими иммунными комплексами
Адсорбируют токсины, липиды, аминокислоты
Источник оксидантной и антиоксидантной систем
Слайд 33
Гранулоцитопоэз
В процессе созревания (в течение 10-13 дней)
происходит:
Уменьшение ядра
Конденсация хроматина
Исчезновение ядрышек
Сегментация ядра
Появление специфической зернистости (на стадии
поздних миелобластов и промиелоцитов)
Утрата базофилии и увеличение объёма цитоплазмы
Цитохимические маркёры: МП, ЩФ, липиды, хлорацетатэстераза. PAS-положит. субстанция
Слайд 34
Гранулогенез
Первичные гранулы – азурофильные. Маркёр – миелопероксидаза.
Содержат: лизоцим, катепсин, эластазу, миелопероксидазу, антибактериальные катионные белки, кислые
гидролазы.
Вторичные гранулы – базофильные. Маркёры: лактоферрин, катионный белок кателицидин, В12 – связывающий белок и др.
Третичные гранулы – желатиназа
Четвертичные гранулы – эндоплазматические органеллы: ЩФ, тетранектин, β2-микроглобулин.
Слайд 35
Миелоидный росток
Миелобласт
Промиелоцит
Слайд 37
сегментоядерные нейтрофилы,
Тельце Барра (1)
Слайд 38
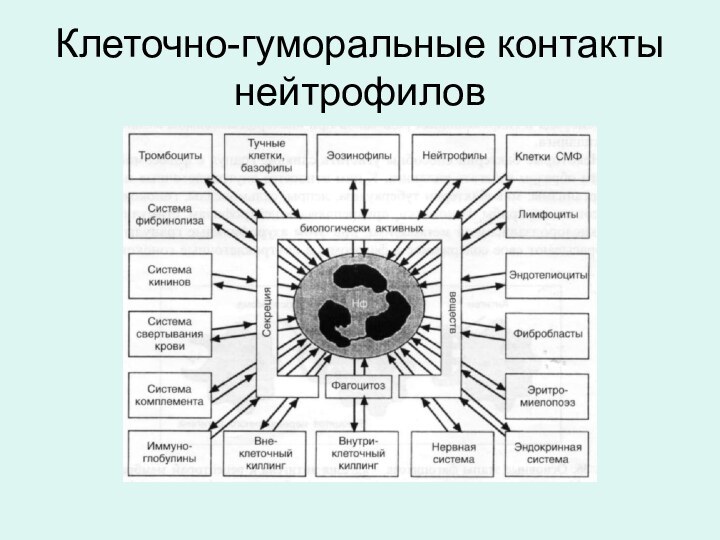
Клеточно-гуморальные контакты нейтрофилов
Слайд 39
Основные этапы фагоцитоза – хемотаксис, адгезия антигена к
рецепторам мембраны фагоцита, погружение в цитоплазму (эндоцитоз), образование фагосомы
и фаголизосомы,
переваривание антигена и дегрануляция
Слайд 40
Эозинофилы
На мембране есть рецепторы к Fc-фрагменту иммуноглобулинов,
рецепторы для компонентов комплемента, молекулы адгезии. CD52,CD69, CD40 и
др.
В специф. гранулах – катионный белок и перекиси, кислая фосфатаза, коллагеназа, эластаза, катепсин, арилсульфатаза, простагландины и др.
Инактивируют БАВ из базофилов и тучных клеток
Обуславливают внеклеточный цитолиз, участвуя в противогельминтном иммунитете
Секретируют ИЛ-2, ИЛ-3, ФНО-α, ИЛ-4, ИЛ-5
Слайд 41
Палочкоядерный эозинофил
эозинофил
Слайд 43
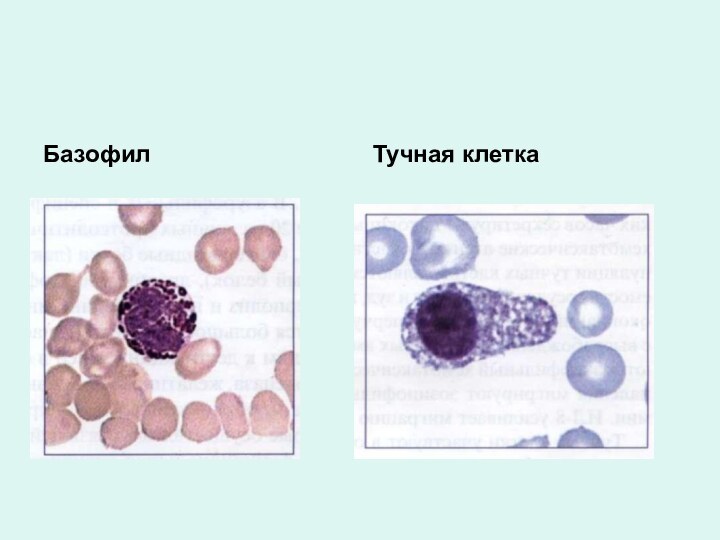
Базофилы
В гранулах: гистамин, гистидин, гепарин, серотонин, ферменты,
лейкотриены, тромбоксаны, простогландины, фактор хемотаксиса эозинофилов, фактор активации тромбоцитов,
фактор хемотаксиса нейтрофилов, интерлейкины 3,4,5,6 и др.
На мембране есть рецепторы для комплемента, высокой плотности рецепторы к IgЕ.
Слайд 44
Участие тучных клеток в реакции гиперчувствительности немедленного типа.
ПГ
- простагландины, ЛТ - лейкотриены, ЛТВ4 - лейкотриен В4
Слайд 45
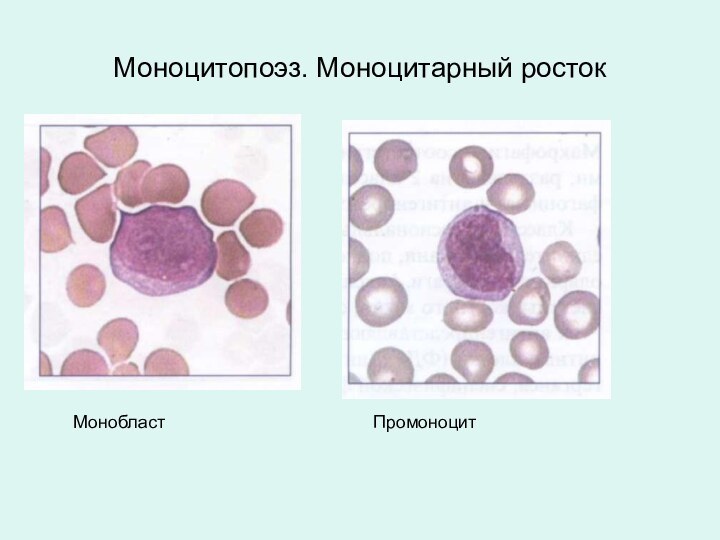
Моноцитопоэз. Моноцитарный росток
Монобласт
Промоноцит
Слайд 47
Цитохимические маркёры клеток моноцитарно-макрофагальной линии
Неспецифическая эстераза, подавляемая фторидом
натрия
Кислая фосфатаза
В процессе дифференцировки уменьшается активность миелопероксидазы
Незначительное содержание липидов
и гликогена
Слайд 48
Мононуклеарные фагоциты
Обновление тканевых макрофагов происходит за счёт
притока моноцитов крови
56% - макрофаги печени (клетки Купфера)
15% -
макрофаги в лёгких
15% - макрофаги в селезёнке
8% - в перитонеальной полости
6% - в других тканях
Слайд 49
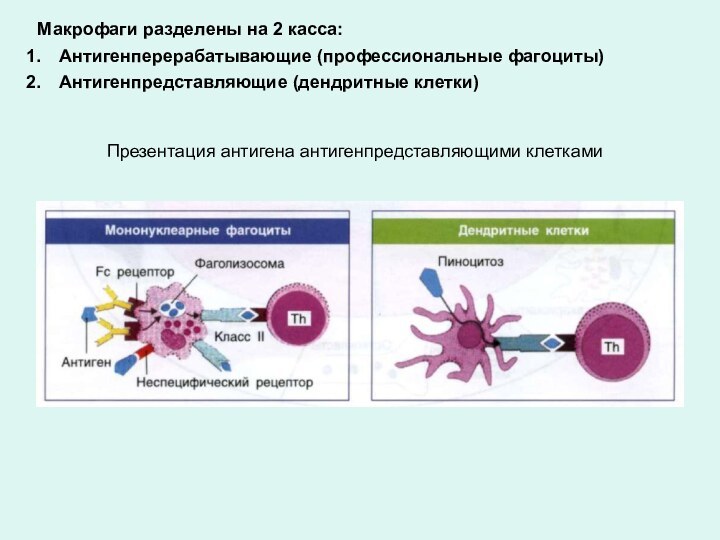
Презентация антигена антигенпредставляющими клетками
Макрофаги разделены на 2
касса:
Антигенперерабатывающие (профессиональные фагоциты)
Антигенпредставляющие (дендритные клетки)
Слайд 50
Фолликулярные дендритные клетки
Локализация:
В В-клеточных зонах лимфоузлов
В селезёнке
В мукозо-ассоциированной
лимфоидной ткани (MALT)
Представляют антиген В-лимфоцитам
ФДК – хранилище антигенов, обеспечивающие
длительное поддержание иммунологической памяти
Слайд 51
Интердигитальные дендритные клетки
Локализация:
В парокортикальных зонах лимфоузлов
В Т-зависимых зонах
селезёнки, миндалин
В мозговом веществе тимуса
Представляют антиген Т-лимфоцитам, вызывая антигенспецифический
иммунный ответ
Слайд 52
Биологическая роль СМФ в процессах обмена веществ
Участие в
углеводном обмене (рецепторы к инсулину и способность к синтезу
медиатора, усиливающего окисление глюкозы жировой тканью)
Активная роль в патогенезе атеросклероза (рецепторы для ЛПНП →образование «пенистых» клеток)
Метаболизм металлов: железа, цинка, меди
Слайд 53
Секреторные факторы макрофагов
Провоспалительные цитокины (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12,
ИЛ-18, ФНО-α, интерферон-α, моноцитарный хемотаксический протеин, миграцию ингибирующий фактор)-
запуск и поддержание воспаления
Противовоспалительные цитокины (ИЛ-10, трансформирующий ростовой фактор)-иммуносупрессия, фиброз
Слайд 54
Роль цитокинов в воспалении. Активация эндотелиальных клеток, повышение
экспрессии молекул адгезии - Е-селектин, Р-селектин, активация нейтрофилов, усиление
адгезии и миграции нейтрофилов в ткани
Слайд 55
Лимфоцитопоэз. Лимфоцитарный росток
лимфобласт
пролимфоцит
лимфоцит
Слайд 56
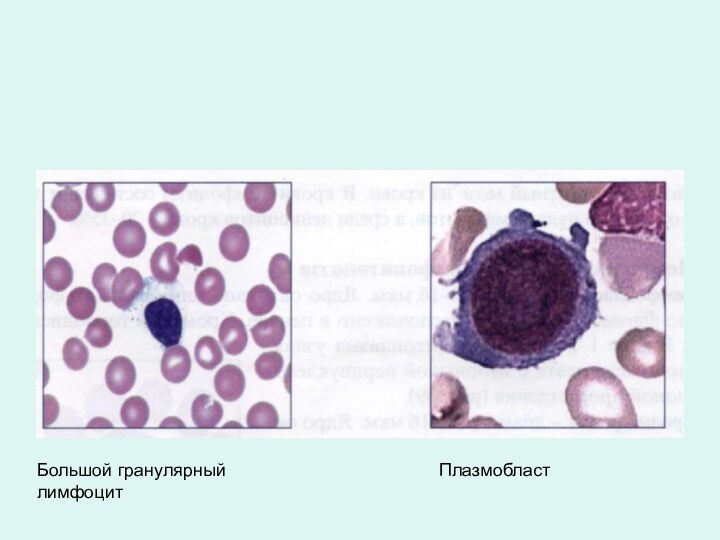
Большой гранулярный лимфоцит
Плазмобласт
Слайд 57
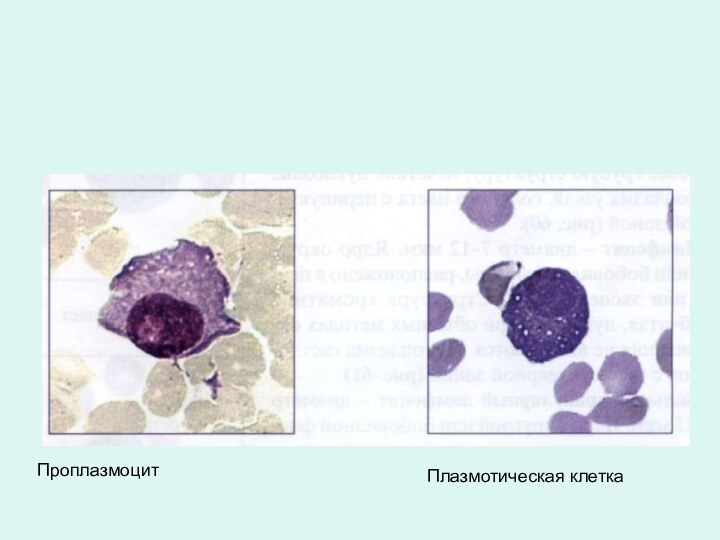
Проплазмоцит
Плазмотическая клетка
Слайд 58
Антигеннезависимые и антигензависимые этапы дифференцировки Т-лим-
фоцитов
Слайд 60
Дифференцировка В-лимфоцитов
Основной характеристикой В-лимфоцитов является наличие на их
мембране рецепторов для распознавания антигенов, основу которых составляют молекулы
иммуноглобулинов.
В-лимфоциты в костном мозге проходят этап антигеннезависимой дифференцировки-формирование зрелой (наивной) В-клетки. С момента завершения формирования рецепторного комплекса В-клетка приобретает способность взаимодействовать с антигеном
Зрелые В-лимфоциты покидают костный мозг, попадают в циркуляцию и поступают в периферические лимфоидные органы, где при встрече с антигеном они проходят этап антигензависимой дифференцировки.
Слайд 61
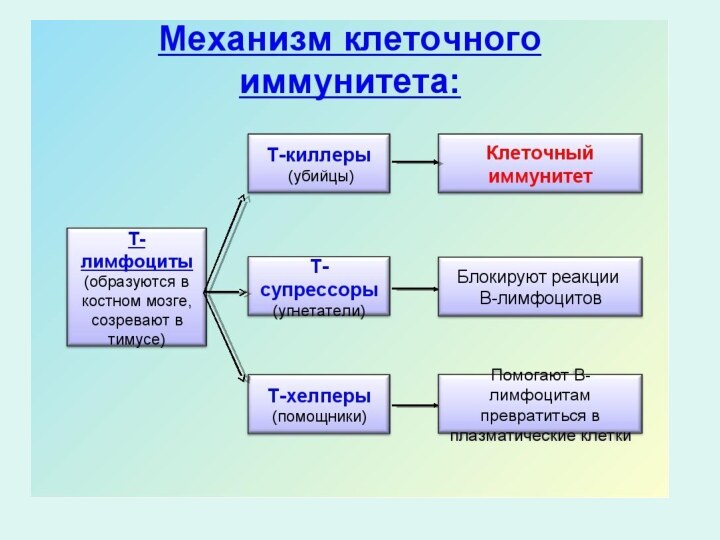
Механизм гуморального иммунитета:
Интерферон
Лизоцим
+
Слайд 63
Мегакариоцитарный росток
мегакариобласт
промегакариоцит
мегакариоцит
Слайд 64
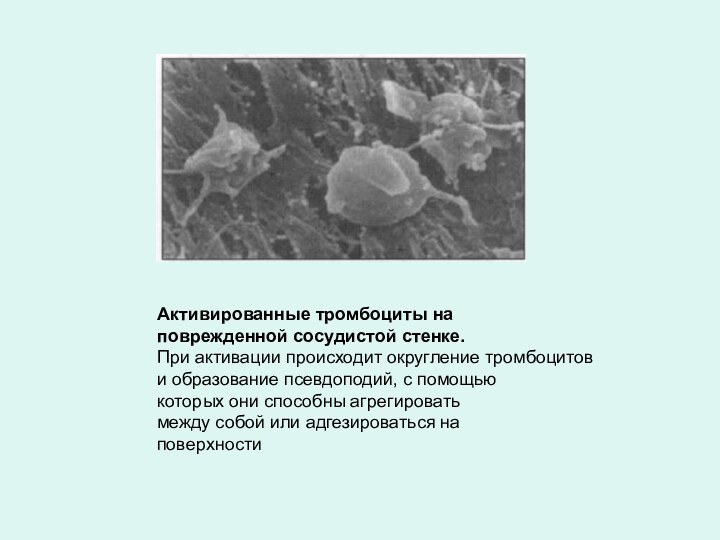
Активированные тромбоциты на
поврежденной сосудистой стенке.
При активации происходит
округление тромбоцитов
и образование псевдоподий, с помощью
которых они способны агрегировать
между
собой или адгезироваться на
поверхности