- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химиотерапевтические препараты и антибиотики
Содержание
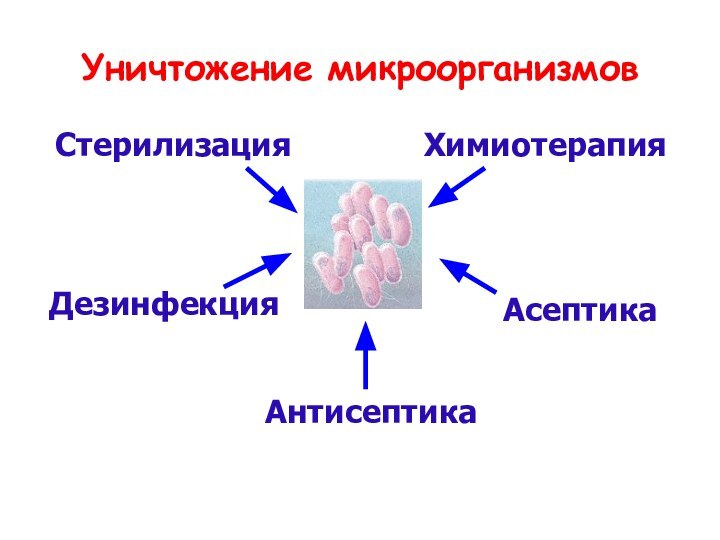
- 2. Уничтожение микроорганизмовСтерилизацияДезинфекцияАнтисептикаАсептикаХимиотерапия
- 3. История Филипп фон Гогенгейм «Парацельс» (1493-1541). Пауль
- 4. Зинаида Виссарионовна Ермольева – создатель отечественного пенициллинаЗ.В.
- 5. АнтибиозЖ.Виллеман – 1889г.С.Ваксман – 1941 г.Л.Пастер: жизнь убивает жизнь…
- 6. Принцип «волшебной пули» П. Эрлиха – убить
- 7. Химиотерапевтический индекс:минимальная токсическая доза препарата(максимальная переносимая)минимальная доза, проявляющаяантимикробную активность (минимальная терапевтическая)>1
- 8. Антибиотики – специфические продукты жизнедеятельности или их
- 9. Способы получения антибиотиковБиологический синтез – антибиотики природные
- 10. Классификация антибиотиков по химическому строению β-Лактамы (пенициллины,
- 11. Классификация антибиотиков по происхождениюАнтибиотики, вырабатываемые микроорганизмами (грамицидины,
- 12. Классификация антибиотиков по спектру биологического действия Противобактериальные
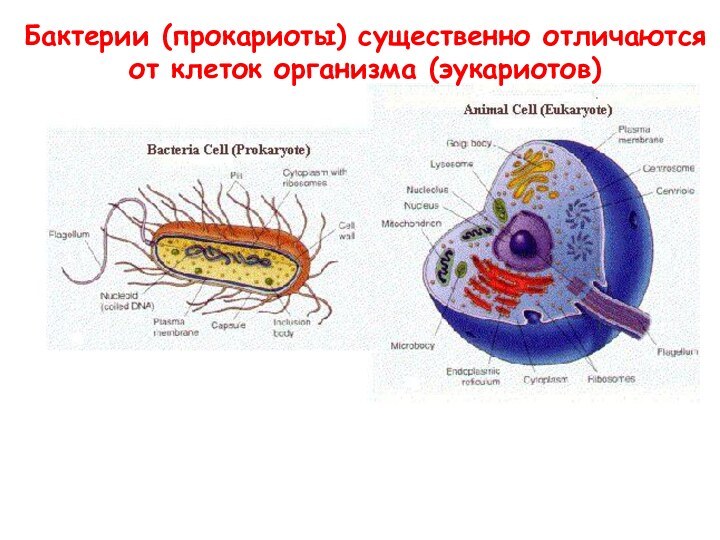
- 13. Бактерии (прокариоты) существенно отличаются от клеток организма (эукариотов)
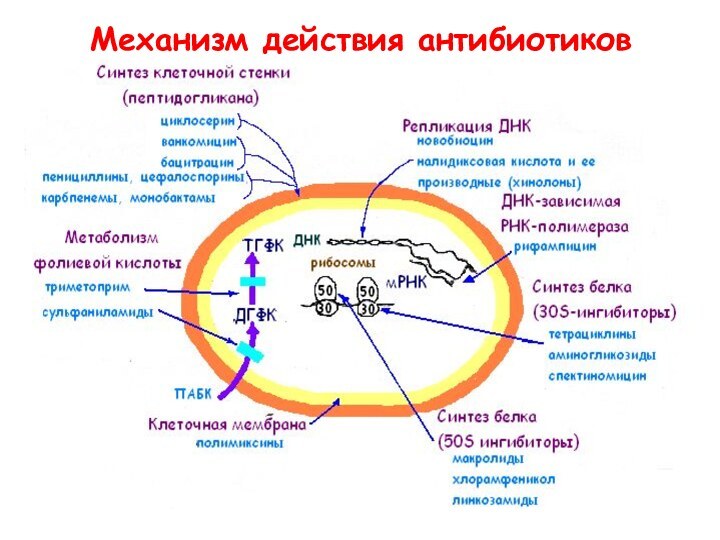
- 14. Механизм действия антибиотиков
- 15. Острая инфекцияХроническая инфекцияРазмножениеРаспространениеВыживаниеАнтимикробный препаратОстрая и хроническая инфекции
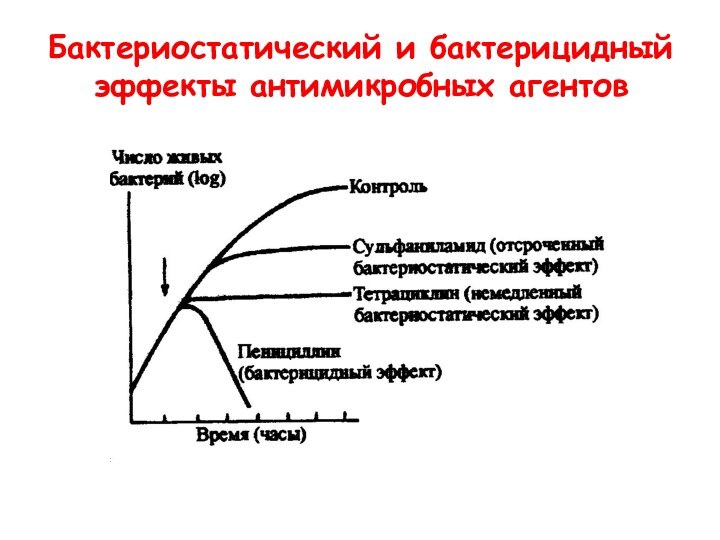
- 16. Бактериостатический и бактерицидный эффекты антимикробных агентов
- 17. Побочное действие антибиотиков На макроорганизмТоксические реакции: гепатотоксическое
- 18. Резистентность бактерий к антибиотикам В медицинском смысле
- 19. Устойчивость бактерий к антибиотикам
- 20. Гены резистентности могут передаваться в процессе: конъюгации (плазмиды, транспозоны);трансдукции (бактериофаги);трансформации (после гибели бактерии).
- 21. Селекция резистентных клонов под действием антибиотикаАнтибиотик(селекционирующий фактор)Резистентные клоныУстойчивая популяцияУстойчивый видРезервуар – микрофлора организма человека
- 22. Общие принципы реализации антимикробного эффекта: антибиотик должен
- 23. Механизмы резистентности Нарушение проницаемости клеточных оболочек. Причина
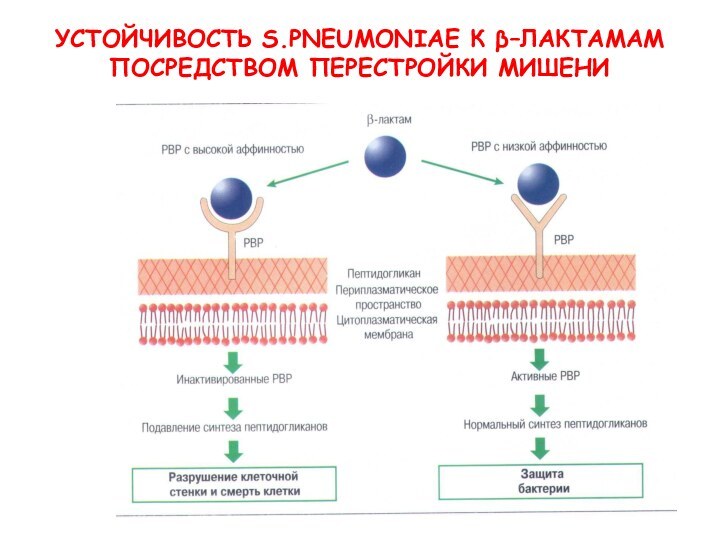
- 24. Механизмы резистентности Модификация мишеней β-лактамы −
- 25. УСТОЙЧИВОСТЬ S.PNEUMONIAE К β–ЛАКТАМАМ ПОСРЕДСТВОМ ПЕРЕСТРОЙКИ МИШЕНИ
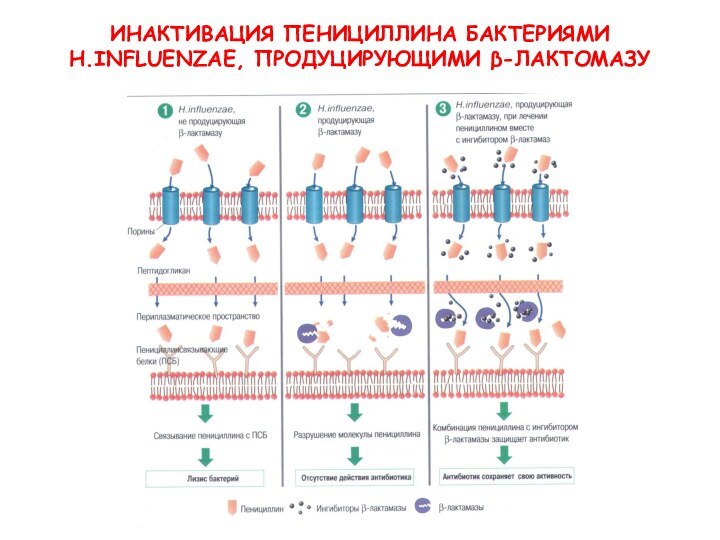
- 26. Механизмы резистентности Инактивация антибиотика β-лактамазы
- 27. ИНАКТИВАЦИЯ ПЕНИЦИЛЛИНА БАКТЕРИЯМИ H.INFLUENZAE, ПРОДУЦИРУЮЩИМИ β-ЛАКТОМАЗУ
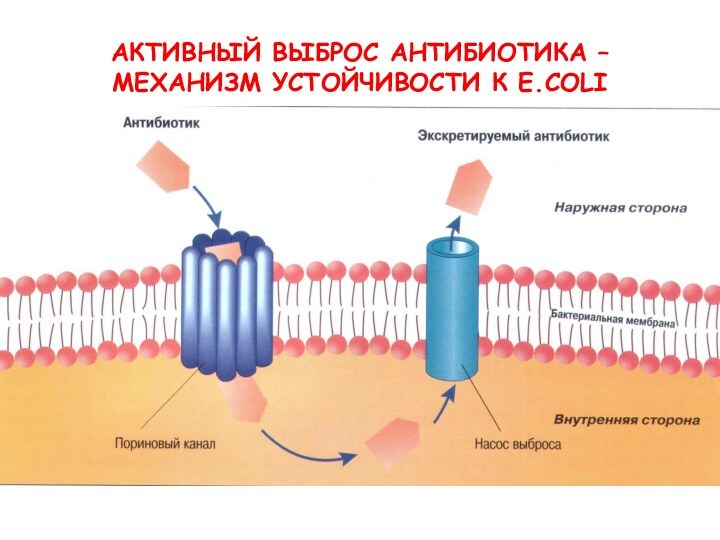
- 28. Механизмы резистентности Активное выведение антибиотика из
- 29. АКТИВНЫЙ ВЫБРОС АНТИБИОТИКА – МЕХАНИЗМ УСТОЙЧИВОСТИ К E.COLI
- 30. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К ХИНОЛОНАМ У ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ
- 31. Абсолютная резистентностьEnterococcus faecalisMycobacterium tuberculosis Pseudomonas aeruginosa
- 32. Основные эффекты антибиотика лечебный – воздействие на внедрившийся инфекционный агент;устранение не патогенных бактерий.
- 33. Нарушение экологии микромира изменение видов,появление новых возбудителей резистентных к антибиотикам (энтерококки, Acinetobacter и Xanthomonas).
- 34. Антибиотики выходят из-под контроля Использование антибиотиков
- 35. Стратегия применения АБОграничение применения АБ без показанийВыбор
- 36. Принципы рациональной антибиотикотерапииМикробиологический принцип. Фармакологический принцип. Клинический принцип. Эпидемиологический принцип. Фармацевтический принцип.
- 37. Методы определения чувствительности бактерий к антибиотикамСерийных разведенийВ
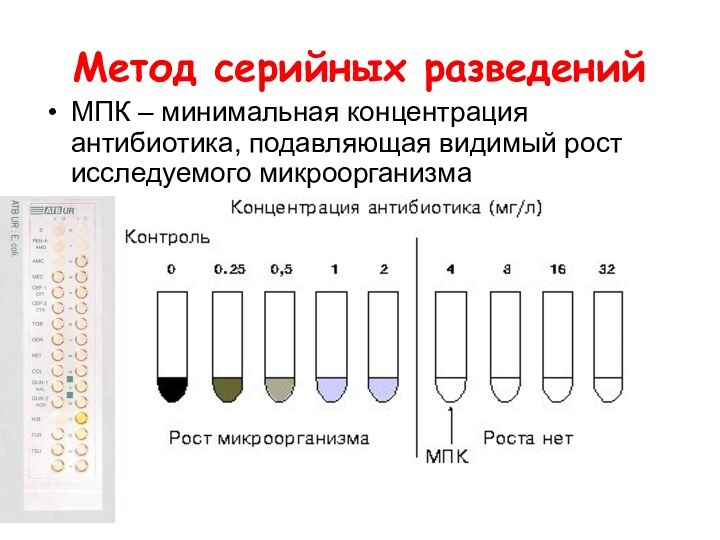
- 38. Метод серийных разведенийМПК – минимальная концентрация антибиотика, подавляющая видимый рост исследуемого микроорганизма
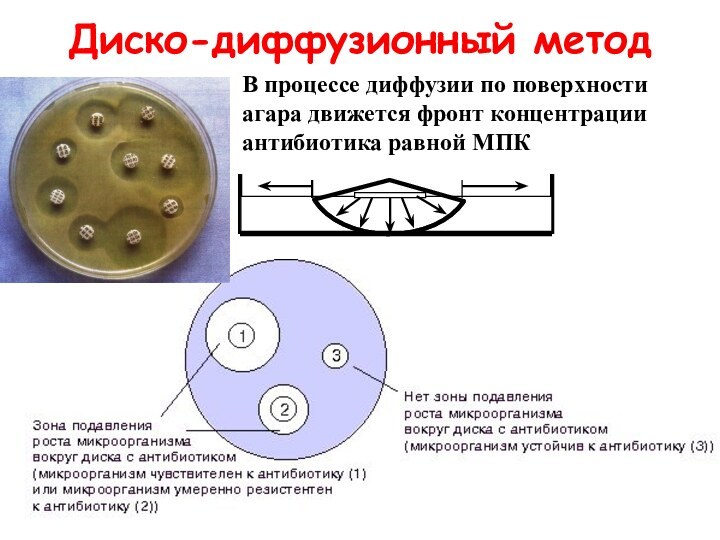
- 39. Диско-диффузионный методВ процессе диффузии по поверхности агара движется фронт концентрации антибиотика равной МПК
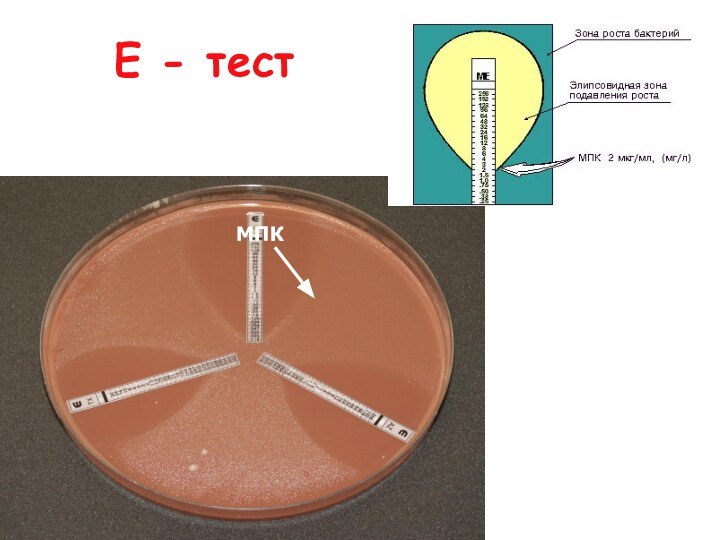
- 40. Е - тестМПК
- 41. Скачать презентацию
- 42. Похожие презентации
Уничтожение микроорганизмовСтерилизацияДезинфекцияАнтисептикаАсептикаХимиотерапия


























Слайд 3
История
Филипп фон Гогенгейм «Парацельс» (1493-1541).
Пауль Эрлих
(1854-1915).
Э. Чейн, Г.Флори.
Слайд 4
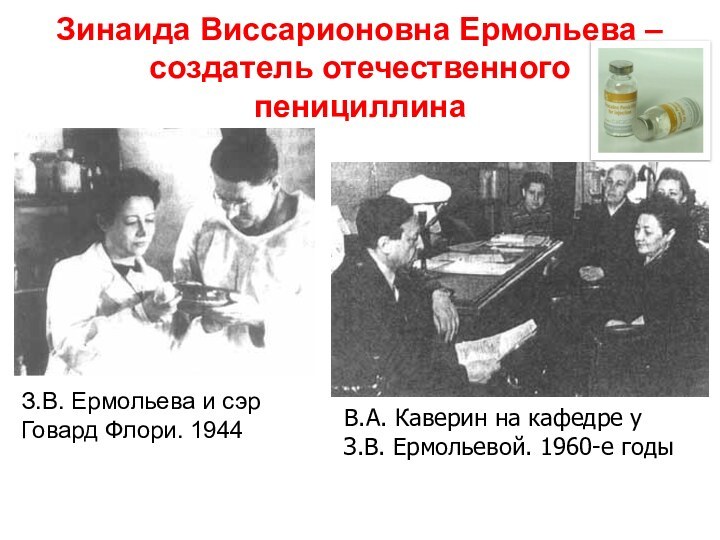
Зинаида Виссарионовна Ермольева – создатель отечественного пенициллина
З.В. Ермольева
и сэр
Говард Флори. 1944
В.А. Каверин на кафедре у
З.В. Ермольевой. 1960-е годы
Слайд 6
Принцип «волшебной пули» П. Эрлиха –
убить живое
в живом, не вредя живому,
т.е. уничтожить паразита, не
нанося ущерба хозяину.
Слайд 7
Химиотерапевтический индекс:
минимальная токсическая доза препарата
(максимальная переносимая)
минимальная доза, проявляющая
антимикробную
активность
(минимальная терапевтическая)
>1
Слайд 8 Антибиотики – специфические продукты жизнедеятельности или их модификации,
обладающие высокой физиологической активностью по отношению к определенным группам
микроорганизмов, избирательно задерживая их рост или полностью подавляя развитие.
Слайд 9
Способы получения антибиотиков
Биологический синтез – антибиотики природные (пенициллин,
стрептомицин).
Химический синтез – антибиотики синтетические (химиотерапевтические препараты). Хинолоны, фторхинолоны.
Комбинированный
способ – антибиотики полусинтетические (метициллин, оксациллин).
Слайд 10
Классификация антибиотиков по химическому строению
β-Лактамы (пенициллины, цефалоспорины,
карбапенемы).
Аминогликозиды (стрептомицин, гентамицин).
Тетрациклины (тетрациклин, доксициклин).
Макролиды (эритромицин, олеандомицин).
Линкозамиды (линкомицин).
Гликопептиды (ванкомицин).
Рифампицины
(рифампицин).Полимиксины.
Полиены (нистатин, леварин, амфотерицин В).
Сульфаниламиды.
Ингибиторы ДНК-гиразы (хинолоны, фторхинолоны).
Нитрофураны (фуразолидон).
Дополнительная группа (хлорамфеникол, фузидиевая кислота).
Слайд 11
Классификация антибиотиков по происхождению
Антибиотики, вырабатываемые микроорганизмами (грамицидины, полимиксины),
в том числе актиномицетами (стрептомицин, тетрациклины, эритромицин ).
Антибиотики, образуемые
плесневыми грибками: (пенициллин, гризиофульвин ).Антибиотики, образуемые лишайниками, водорослями и низшими растениями (усниновая кислота).
Антибиотики, образуемые высшими растениями (фазеолин).
Антибиотики животного происхождения (лизоцим, интерферон).
Слайд 12
Классификация антибиотиков по спектру биологического действия
Противобактериальные антибиотики
узкого спектра действия: природные и полусинтетические пенициллины, полусинтетические цефалоспорины
и др.Противобактериальные антибиотики широкого спектра действия: тетрациклины, хлорамфеникол, аминогликозиды, полусинтетические пенициллины (ампициллин, карбенициллин) и др.
Противотуберкулезные антибиотики: стрептомицин, канамицин, циклосерин.
Противогрибковые антибиотики: нистатин, гризеофульвин, амфотерицин В и др.
Противоопухолевые антибиотики: актиномицин С, адриамицин (доксорубицин), рубомицины и др.
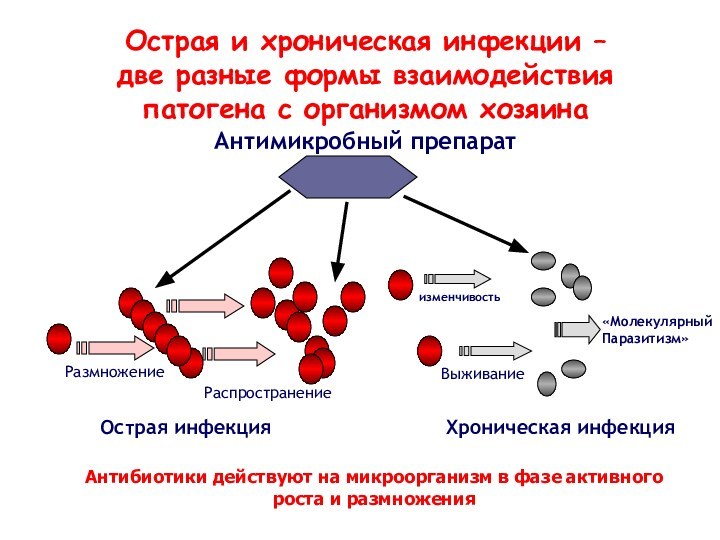
Слайд 15
Острая инфекция
Хроническая инфекция
Размножение
Распространение
Выживание
Антимикробный препарат
Острая и хроническая инфекции –
две разные формы взаимодействия
патогена с организмом хозяина
изменчивость
«Молекулярный
Паразитизм»
Антибиотики действуют
на микроорганизм в фазе активного роста и размножения
Слайд 17
Побочное действие антибиотиков
На макроорганизм
Токсические реакции: гепатотоксическое действие
(тетрациклины, эритромицин), нефротоксическое действие (аминогликозиды), нарушение формирование костного скелета
и эмали зубов (тетрациклины), поражение органов кроветворения (хлорамфеникол и сульфаниламиды), кровотечения (цефалоспорины).Дисбиозы.
Воздействие на иммунитет: аллергические реакции, иммунодепрессия (хлорамфеникол угнетает антителообразование, тетрациклины – фагоцитоз).
На микроорганизм
Появление атипичных форм микроорганизмов (образование L-форм).
Формирование антибиотико-резистентности.
Слайд 18
Резистентность бактерий к антибиотикам
В медицинском смысле резистентными
следует считать бактерии, если они не обезвреживаются такими концентрациями
антибиотика, которые возникают в организме при введении фармакологических (т.е. клинически реальных) дозировок.
Слайд 20
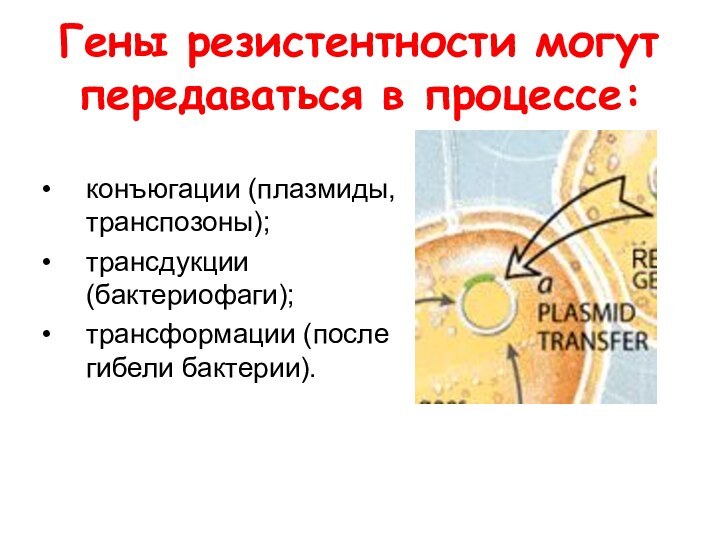
Гены резистентности могут передаваться в процессе:
конъюгации (плазмиды,
транспозоны);
трансдукции (бактериофаги);
трансформации (после гибели бактерии).
Слайд 21
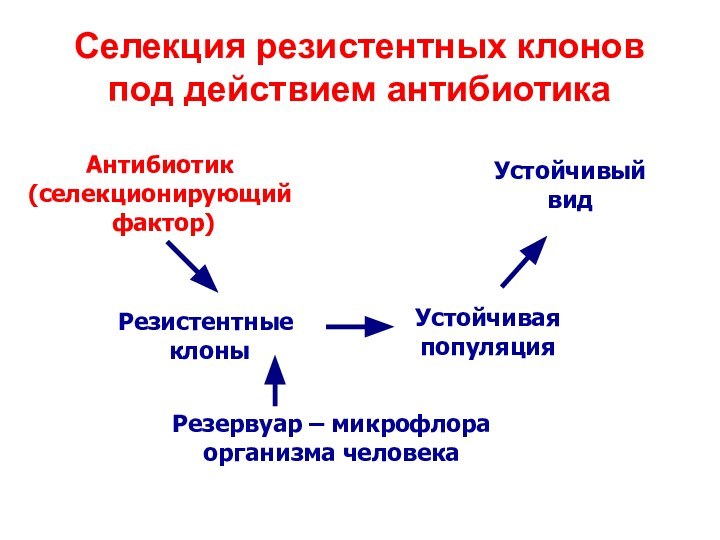
Селекция резистентных клонов под действием антибиотика
Антибиотик
(селекционирующий
фактор)
Резистентные
клоны
Устойчивая
популяция
Устойчивый
вид
Резервуар – микрофлора
организма человека
Слайд 22
Общие принципы реализации антимикробного эффекта:
антибиотик должен связаться
с бактерией и пройти через ее оболочку;
антибиотик должен быть
доставлен к месту действия;антибиотик должен вступить во взаимодействие с внутриклеточными мишенями.
Слайд 23
Механизмы резистентности
Нарушение проницаемости клеточных оболочек. Причина –
полная или частичная утрата пориновых белков.
Система
MAR (multiple antibiotic resistance − множественная устойчивость к антибиотикам): снижение количества одного из пориновых белков (OmpF) + повышение активности одной из систем активного выведения → тетрациклины или хлорамфеникол → β-лактамы и хинолоны.
Слайд 24
Механизмы резистентности
Модификация мишеней
β-лактамы −
ПСБ
(стафилококки − ПСБ2а → устойчивость к
метициллину или оксациллину).хинолоны/фторхинолоны → модификация ДНК-гиразы и топоизомеразы IV,
макролиды, кетолиды и линкозамиды → метилирование 50S субъединица рибосомы.
Слайд 26
Механизмы резистентности
Инактивация антибиотика
β-лактамазы
→ гидролиз β-лактамного кольца.
Ингибиторы β-лактамаз: клавулановая кислота, сульбактам,
тазобактам (амоксиклав, цефоперазон/сульбактам).Ферментативная инактивация. Модифицированные молекулы аминогликозидов теряют способность связываться с рибосомами и подавлять биосинтез белка. Россия – гентамицин и торбамицин.
Слайд 28
Механизмы
резистентности
Активное выведение
антибиотика из бактериальной
клетки (эффлюкс).
Синегнойная палочка → карбопинемы.
Хинолоны, макролиды, линкозамиды и тетрациклины. Формирование метаболического шунта → триметоприм, сульфаниламиды.
Конкурентное связывание или перехват антимикробного агента.
Слайд 31
Абсолютная резистентность
Enterococcus faecalis
Mycobacterium tuberculosis
Pseudomonas aeruginosa
Слайд 32
Основные эффекты антибиотика
лечебный – воздействие на внедрившийся
инфекционный агент;
устранение не патогенных бактерий.
Слайд 33
Нарушение экологии микромира
изменение видов,
появление новых возбудителей резистентных
к антибиотикам (энтерококки, Acinetobacter и Xanthomonas).
Слайд 34
Антибиотики выходят
из-под контроля
Использование антибиотиков без показаний.
Препараты,
применяющиеся для
лечения людей, широко
используются
в животноводствеи земледелии.
Слайд 35
Стратегия применения АБ
Ограничение применения АБ без показаний
Выбор препарата
с максимальной эффективностью
Лучшие результаты лечения
Нет селекции резистентных штаммов
Снижение затрат
на АБ
Слайд 36
Принципы рациональной антибиотикотерапии
Микробиологический принцип.
Фармакологический принцип.
Клинический принцип.
Эпидемиологический принцип.
Фармацевтический принцип.
Слайд 37
Методы определения чувствительности бактерий к антибиотикам
Серийных разведений
В агаре,
в бульоне
Макровариант, микровариант
По количеству концентраций:
«длинный ряд», по пограничным концентрациям Диффузионные
Диско-диффузионный
Эпсилометрический (Е-тест)