Слайд 2
ОПРЕДЕЛЕНИЕ
К.Т.П.П. представляют собой cледствие несостоятельности систем контроля гомеостазиса
клетки при воздействии повреждающих факторов и представлено:
- дистрофией
- апоптозом
-
аутофагией
онкозом
некрозом
Слайд 3
ДИСТРОФИЯ
(от греч. dys- нарушение, trophe- питание) –
морфологическое выражение нарушений тканевого (клеточного) метаболизма, т. е. трофики
тканей (клеток), что ведет их к структурным изменениям и в конечном итоге к дисфункции.
Под трофикой следует понимать «совокупность процессов, определяющих метаболизм и структурную организацию тканей (клеток), которые необходимы для определения специализированной функции».
Слайд 4
КЛЕТОЧНАЯ ДИСТРОФИЯ
нарушения метаболизма
+
нарушение структуры
+
функциональные изменения
Нарушения метаболизма являются пусковым механизмом (врождённые или приобретенные)
Слайд 5
По уровню возникновения дистрофии:
паренхиматозные -
возникают на уровни клеток;
мезенхимальные -
возникают на межклеточном уровне;
смешанные -
при нарушениях в клетках и
межклеточном веществе.
Слайд 6
СУЩНОСТЬ ДИСТРОФИИ:
избыток или дефицит
В клетке и межклеточном
веществе образуется избыточное количество соединений, или вещества не присущие
данной клетке.
В клетке и межклеточном веществе развивается дефицит определённого вещества
например:
-АТФ в клетке
-мукополисахариды вне клетки.
Слайд 7
Клеточные парадигмы:
дистрофия гепатоцита
дистрофия кардиомиоцита
дистрофия
нейрона
Слайд 8
по характеру нарушения метаболизма:
липидные
▬ углеводные
белковые
● гидроэлектролитные
▬▬ смешанные
Слайд 9
ДИСТРОФИИ БЫВАЮТ:
Обратимыми
Необратимыми
Местными
Генеральными
или общими
Слайд 10
ПАТОГЕНЕЗ:
инфильтрация - с кровью поступает больше веществ чем нужно;
извращённый
синтез - это синтез в клетках или в тканях веществ,
не встречающихся в них в норме.
Например: синтез аномального белка амилоида в клетке, который в норме отсутствует;
трансформация - переход одного вещества в другое. Например: трансформация углеводов в жиры при гипергликемии;
декомпозиция или фанероз - распад клеточных и межклеточных структур, что приводит к накоплению в клетке избыточного количества белков или жиров;
депонирование - при нарушении использования вещества.
Слайд 11
АМИЛОИДОЗ ►ПАТОГЕНЕЗ
Фибриллы амилоида синтезируются клетками – макрофагами, плазматическими
клетками, кардиомиоцитами и клетками микроглии мозга.
Появление в строме органов
и в стенках сосудов не встречающегося в норме сложного белка амилоида.
Амилоид состоит из фибриллярного белка, связанного с глюкопротеидами.
Амилоид выпадает по ходу ретикулярных или коллагеновых волокон.
Выраженный амилоидоз ведет к атрофии паренхимы и склерозу органов , что сопровождается развитием их функциональной недостаточности.
АМИЛОИДОЗ
Первичный (идиопатический)
Вторичный (приобретенный,
реактивный). Возникает как осложнение ряда болезней, сопровождающихся хроническим воспалением – ревматоидный артрит, бронхоэктатическая болезнь, туберкулез, остеомиелит, язвенный колит, болезнь Крона.
Наследственный (генетический, семейный).
Старческий амилоидоз (при болезни Альцгеймера и старческой деменции).
Слайд 13
ПАТОГЕНЕЗ:
ДЕФИЦИТ глюкозы-6-фосфатазы приводит к аккумулированию гликогена в гепатоцитах.
Развивается т.н. гликогеноз.
Слайд 14
Нарушение активности протеаз и белков теплового шока (шаперонов):
накопление белков в клетке, в том числе аномальных
белков
ПАТОГЕНЕЗ:
Слайд 15
МЕХАНИЗМЫ ЖИРОВОЙ ДИСТРОФИИ ПЕЧЕНИ
Избыточное поступление жирных кислот и
триглицеридов в клетку при гиперлипидемии - при алкоголизме, сахарном
диабете, общем ожирении.
Снижение утилизации - окисления жирных кислот в митохондриях – при гипоксии, анемии, токсических воздействиях.
Снижение выведения липидов из печеночной клетки, что связано в основном с уменьшением продукции апопротеина, необходимого для транспорта липидов в виде липопротеидов.
Слайд 16
МЕХАНИЗМЫ ЖИРОВОЙ ДИСТРОФИИ ПЕЧЕНИ
При действии токсичных веществ (этанол,
четыреххлористый углерод, фосфор).
Наследственные дефекты ферментов, участвующие в жировом обмене.
Слайд 17
Избыток свободных радикалов кислорода:
- активирование металлопротеиназ
внеклеточного матрикса
- чрезмерный распад белков цитоскелета, в основном фибриллярного
гликогена
ПАТОГЕНЕЗ:
Слайд 18
ПАТОГЕНЕЗ:
ГИПОКСИЯ И ИШЕМИЯ – ОБЩИЕ ФАКТОРЫ ДИСТРОФИЙ:
дефицит
АТФ
накопление кальция
избыток сводных радикалов кислорода
нарушение систем
активации и
ингибирования энзим
Слайд 19
МЕХАНИЗМЫ ЖИРОВОЙ ДИСТРОФИИ СЕРДЦА ПРИ ГИПОКСИИ:
Недостаток кислорода приводит
к снижению окислительного фосфорилирования в кардиомиоцитах
Переключение на анаэробный гликолиз
сопровождается резким снижением синтеза АТФ
Повреждение митохондрий
Нарушение бета-окисления жирных кислот
Накопление липидов в виде мелких капель в цитоплазме (пылевидное ожирение)
Вторичное повреждение митохондрий....
внутриклеточный ацидоз:
ингибирование энзим
потеря ионов калия
нарушение формирования АТФ
накопление ионов натрия и кальция
снижение эффективности анаэробного
гликолиза
ПАТОГЕНЕЗ:
Слайд 21
Лизосомальный механизм
лабилизация лизосом
выход гидролаз
парциальный аутолиз клетки
ДИСТРОФИЯ
ПАТОГЕНЕЗ:
Слайд 22
Избыток катехоламинов (стресс):
●активация функции клетки
●активация липолиза
●aккумулирование свободных жирных кислот
●разобщение окислительного фосфорилирования
●энергетический дефицит
●активация оксидативного тсресса
►ДИСТРОФИИ
ПАТОГЕНЕЗ:
Слайд 23
► НАРУШЕНИЕ ЭКЗОЦИТОЗА:
накопление
продуктов баласта (метаболический мусор – например: липофусцина)
►
НАРУШЕНИЕ (СНИЖЕНИЕ) АКТИВНОСТИ ЛИЗОСОМАЛЬНЫХ АРИЛСУЛЬФАТАЗ:
накопление липофусцина.
Липофусцин – гликопротеид,
маркер старения клетки.
ПАТОГЕНЕЗ:
ПОСЛЕДСТВИЯ
ДИСТРОФИЙ
►ВОССТАНОВЛЕНИЕ (т.е. обратимый характер дистрофии)
►АПОПТОЗ
►НЕКРОЗ
Слайд 25
АПОПТОЗ
ПРОГРАМИРОВАННАЯ СМЕРТЬ КЛЕТКИ вследствие активации генетического механизма
ЗНАЧИМОСТЬ АПОПТОЗА:
сохранение клеточного гомеостаза (количественного и качественного)
Слайд 26
Лауреаты Нобелевской премии в данной сфере:
Сидней Бреннер,
Роберт
Хорвиц,
Джон Салстон
Нобелевская Премия в области Физиологии и
Медицины за 2002 год совместно за их открытия в области "генетического регулирования развития организма и запрограммированной смерти клеток"
©
Слайд 27
Количественное равновесие
Сохранение адекватного числа клеток для оптимальной
функции органа или системы.
Реализуется путём гибели нормальных клеток,
когда их число превышает величину оптимальной функции (инволюция миометрия после рождения, инволюция тимуса, инволюция клеток скелетной мышцы при иммобилизации тела и.т.д.).
Слайд 28
КАЧЕСТВЕННЫЙ ГОМЕОСТАЗ
Апоптоз (програмирования гибель):
анормальных клеток;
необратимо повреждённых
клеток;
клеток с мутациями АДН;
опухолевидных клеток;
инфицированных клеток
вирусами или другими ксенобиотиками.
Слайд 29
Зачем гибнет клетка:
Клетка выполнила свою функцию и стала
ненужной организму
Клетка состарилась и больше не может выполнять свои
функции
Клетка подверглась внешнему воздействию и больше не может выполнять свои функции или стала опасной для организма
Слайд 30
ПРИЧИНЫ АПОПТОЗА
Положительные сигналы направленные на:
Старые клетки или клетки с необратимыми изменениям.
Клетки с мутациями ДНК.
Клетки с дистрофией.
Онкологические клетки.
Инфицированные клетки.
Слайд 31
ПРИЧИНЫ АПОПТОЗА
Отрицательные сигналы:
Отсутствие
действия со стороны:
▬ факторов роста клеток (эпидермиса, эндотелия, нерва,
фибробластов, и.т.д.)
▬ тропных гормонов
AКТГ – надпочечники.
TТГ – щитовидная железа.
Андрогены – простата.
Эстрогены – эндометрий.
Пролактин – молочная железа.
Слайд 32
Апоптоз: стадии
Стадия обратимых изменений, во время которой процесс
апоптоза может быть остановлен и клеточные структуры будут репарированы!!!
Стадия необратимых изменений, во время которой клеточные структуры разрушаются и клетка образует апоптотические тельца!!!
Слайд 33
ПУТИ СУИЦИДА
- внутренний путь
- внешний путь
Слайд 34
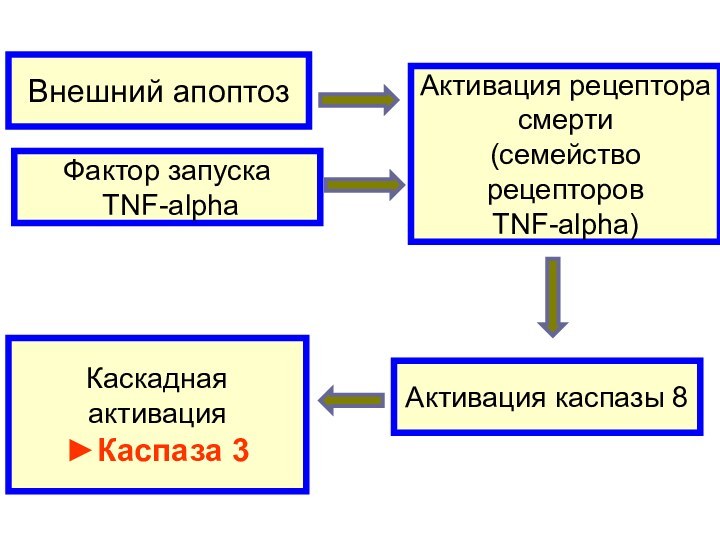
Внешний апоптоз
Активация рецептора
смерти
(семейство
рецепторов
TNF-alpha)
Фактор запуска
TNF-alpha
Активация каспазы
8
Каскадная активация
►Каспаза 3
Слайд 35
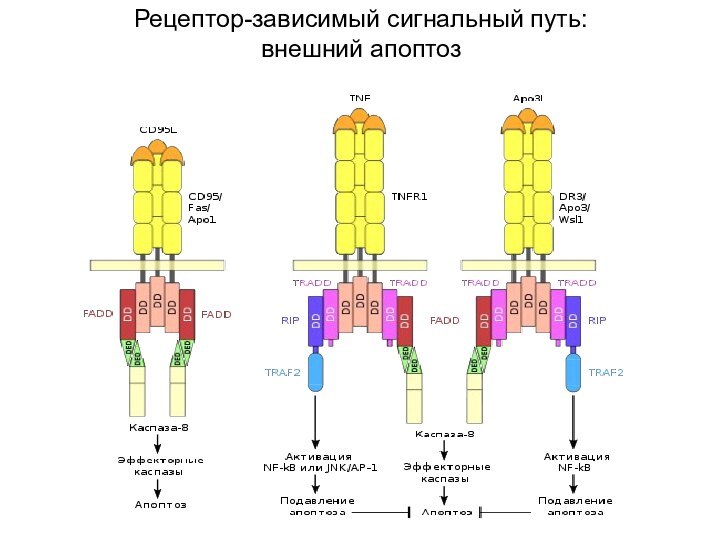
Рецептор-зависимый сигнальный путь:
внешний апоптоз
Слайд 36
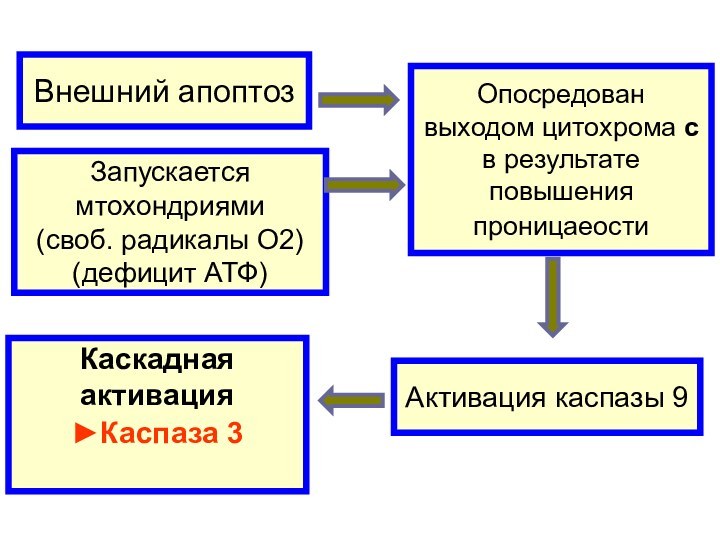
Внешний апоптоз
Опосредован
выходом цитохрома c
в результате
повышения
проницаеости
Запускается
мтохондриями
(своб. радикалы О2)
(дефицит АТФ)
Активация каспазы 9
Каскадная
активация
►Каспаза
3
Слайд 37
Апоптоз:
стадия 2 – аккуратная смерть
Активация каспаз,
других протеаз
и распад белков
Потеря клеткой воды
Фрагментация ДНК и утрата ею
связи с кариолеммой
Дисфункция цитолеммы
Распыление хроматина
Кариорексис, Кариолизис
Разрушение молекул нуклеиновых кислот
Кариопикноз
Клетка сморщивается
Появление «пузырей» на поверхности клетки
Отшнуровывание и фагоцитоз апоптотических телец
Слайд 38
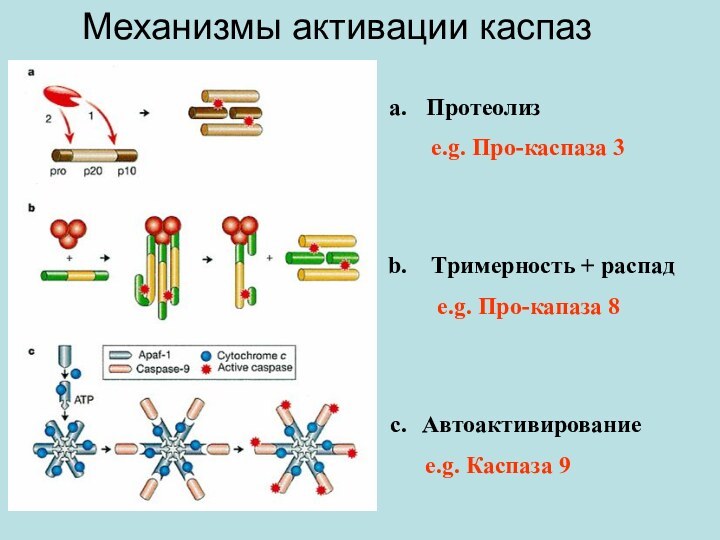
Mеханизмы активации каспаз
Протеолиз
e.g.
Про-каспаза 3
Tримерность + распад
e.g. Про-капаза
8
Aвтоактивирование
e.g. Каспаза 9
Слайд 40
Ключевые факторы
АПОПТОЗА
КАСПАЗЫ
БЕЛКИ АДАПТОРЫ (p53 И Р21)
TNF &
TNFR
Bcl-2 – СИСТЕМА анти-АПОПТОЗА
Слайд 41
р53 и АПОПТОЗ
●p53 блокирует рост клетки между
фазами G2 и S клеточного цикла.
●Условия для восстановления
ДНК
●Усли это не удаётся p53 активирует ген суицида и запускается апоптоз.
Слайд 42
ОСОБЕННОСТЬ АПОПТОЗА:
Важное условие – сохранение определённого уровня
АТФ (10-15%)
Если это условие отсутствует, тогда
апоптоз не
удаётся и гибель клетки реализуется через НЕКРОЗ.
Слайд 43
Аномалии апоптоза:
Клетка не отвечает на положительные стимулы апоптоза
и не умирает через суицид.
Это приводит к сохранению
и накоплению опухолевидных клеток, с мутацией ДНК, старых и недееспособных, инфицированных вирусами т.д.
Слайд 44
Аномалии апоптоза:
Чрезмерная aктивация aпоптоза.
Несанкционированный апоптоз.
Последствия:
1. Дегенеративные заболевания
(Альцгеймер, Паркинсонизм).
2. Чрезмерная гибель нормальных клеток.