- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Загальна характеристика мітохондріальної патології. Клініка, діагностика, лікування
Содержание
- 2. Мітохондріальні захворювання Гетерогенна група спадкових захворювань,
- 3. • Біохімічно мітохондропатії – це порушення ферментів
- 5. Історична довідка1962 рік - вперше відкриті мітохондріальні
- 6. Схема будови мітохондрії • Мітохондрія описана Альтманом
- 7. Мітохондріальна ДНК (мт ДНК) – це:• мікроскопічна
- 8. Мітохондріальна ДНКОдночасно в клітині можуть співіснувати нормальний
- 9. Материнське спадкуванняФізіологія материнського типу спадкування
- 10. Тип успадкування мітохондріальних захворюваньМоже бути:РецесивнимДомінантнимХ- зчепленим (при
- 11. Етіопатогенез мітохондріальних захворюваньПорушення процесу виробництва внутріклітинного синтезу
- 12. Органи і тканини характеризують-ся різною залежністю від
- 13. Класифікація патогенних мтДНК мутацій
- 14. Класифікація мітохондріальних захворювань (Wallace,1992)1.Місенс-мутантні:Нейроофтальмопатія ЛебераПігментний ретиніт2. Мутації
- 15. Класифікація мітохондріальних захворювань (Wallace,1992)4. Мутації,що знижують число
- 16. Описано більш, як 100 точкових мутацій мтДНК
- 17. Найбільш часті органопатії при дефектах дихального ланцюгаЦНС:
- 18. Найбільш часті органопатії при дефектах дихального ланцюгаЕндокринна
- 19. Клінічні особливість мітохондріальних захворювань -
- 20. Методи дослідження мітохондріальних захворюваньклініко-генеалогічний аналізгенетичний аналізморфологічний аналіз
- 21. Місенс-мутантні мітохондропатії Синдром ЛЕБЕРА “грім серед ясного
- 22. Синдром ЛебераПораження очей поєднується з неврологічною симптоматикою:
- 23. Мутації у генах тРНК Синдром MERRF
- 24. Синдром MERRF міоклонус-епілепсія,“рвані червоні волокна” генералізованні тоніко-клонічні
- 25. Синдром MELAS мітохондріальна міопатія - енцефалопатія-лактат-ацидоз, інсультоподібні
- 26. Синдром MELAS мітохондріальна міопатія - енцефалопатія-лактат-ацидоз, інсультоподібні
- 27. Синдром MELAS Характерні ознаки мітохондріальної недостатності
- 28. Делеції або дуплікації мтДНК Синдром Кернса
- 29. Синдром Кернса — Сейраосновні клінічні прояви —
- 30. атріовентрикулярна блокада серця мозкова атаксія.ендокринні розлади: низький
- 31. Синдром Кернса — СейраПовна форма хвороби: -
- 32. Синдром Кернса — СейраПри лабораторному обстеженні -
- 33. Синдром ПірсонаОписаний Pearson в 1979 роців основі
- 34. Синдром Пірсонамакроцитарна анемія з нейтропенією і тромбоцитопенією.
- 35. Синдром ПірсонаЛабораторне дослідження - наявність лактатацидозу, комплексної
- 36. Синдром Пірсонапосмертно виявляють портальну дилятацію, фіброз, холестаз
- 37. Лікування мітохондріальних захворюваньКетогенна дієта (60% енергії- жир)
- 38. Лікування мітохондріальних захворювань Патогенетичне: (Спрямоване на
- 39. Дякую за увагу!
- 41. Скачать презентацию
- 42. Похожие презентации
Мітохондріальні захворювання Гетерогенна група спадкових захворювань, яка характеризується патологією в системі мітохондрій (порушення структури, функцій мітохондрій), що призводить до органопатій тих органів, в яких вони максимально містяться.





























Слайд 3 • Біохімічно мітохондропатії – це порушення ферментів або
ферментних комплексів, безпосередньо залучених у виробництві хімічної енергії за
допомогою окислюваль-ного фосфорилювання.• Існує дефіцит виробництва клітинної енергії внаслідок генетичного дефекту мітохондріальної ДНК.
Слайд 4
АКТУАЛЬНІСТЬ
значна розповсюдженість у вигляді полісиндромної патології з більш частим
ураженням:• нервової системи • очей • серця • нирок
• м”язової системи • ендокринних органів
неефективне традиційне лікування
сімейний характер патології (у випадку порушення окислювального фосфорилювання)
частоту дисфункції дихального ланцюга оцінюють від 1 на 5-10 тисяч до 4-5 на 100 тисяч новонароджених
мають тенденцію до росту в геометричній прогресії
- виражена інвалідизація
Слайд 5
Історична довідка
1962 рік - вперше відкриті мітохондріальні захворювання
(описана хвороба Люфта у молодої жінки)
1960-1990р.р.- діагностика мітохондропатій визначалась
тільки біохімічними і морфологічними критеріями1988р. – вперше доведена роль мутації мт ДНК, закладені базисні принципи мітохондріальної патології.
Слайд 6
Схема будови мітохондрії
• Мітохондрія описана Альтманом понад 100
років тому, як бактерія – паразит.
• Мітоходрії – це
унікальні енергетичні фабрики клітин: забезпечують майже 90% всієї енергії для потреби організму у вигляді молекул АТФ. Будова мітохондрій :
Зовнішня мембрана: висока проник-ливість, відділяє органелу від цитоплазми клітини
Внутрішня мембрана: утворює крипти, містить 5 мультиферментних комплексів дихального ланцюга
Матрикс : протікають більшість біохімічних процесів окислювального фосфорилювання і оновлення в дихальному ланцюзі
• Мітоходрії мають свої власні ДНК, РНК і рибосоми
Слайд 7
Мітохондріальна ДНК (мт ДНК) – це:
• мікроскопічна молекула,
яка включає 16569 пар нуклеотидів
• Кожна клітина містить від
2 до 20 кільцевих молекул мітохондріальної ДНК (мтДНК)• складається з двох комплементарних ланцюгів протилежної орієнтації
• кодує 37 генетичних продуктів: 2 гени рРНК, 22 гени тРНК і 13 структурних генів
Слайд 8
Мітохондріальна ДНК
Одночасно в клітині можуть співіснувати нормальний (дикий)
і мутантний типи мтДНК, що прийнято позначати терміном гетероплазмія
Обидва
типи мтДНК в процесі поділу клітини розподіляються випадково між дочірними клітинамиТому в наступних поколіннях частина клітин можуть мати тільки нормальні мтДНК, частина – тільки мутантні, а третя частина - і ті і інші типи мтДНК
Характерне материнське спадкування
Слайд 9
Материнське спадкування
Фізіологія материнського типу
спадкування на
відміну від менделівського типу полягає
в тому, що
під час запліднення при проникненні в яйцеклітину сперматозоїд втрачає хвіст з мітохондріями і мт ДНК. Тому в яйцеклітину попадає лише ядерна ДНК спермію. Подібний механізм зумовлює те, що патогенні мутації мт ДНК і викликані ними клінічні фенотипи передаються дітям лише від матері.Випадків батьківської передачі мітохондріальних захворювань не задокументовано.
Слайд 10
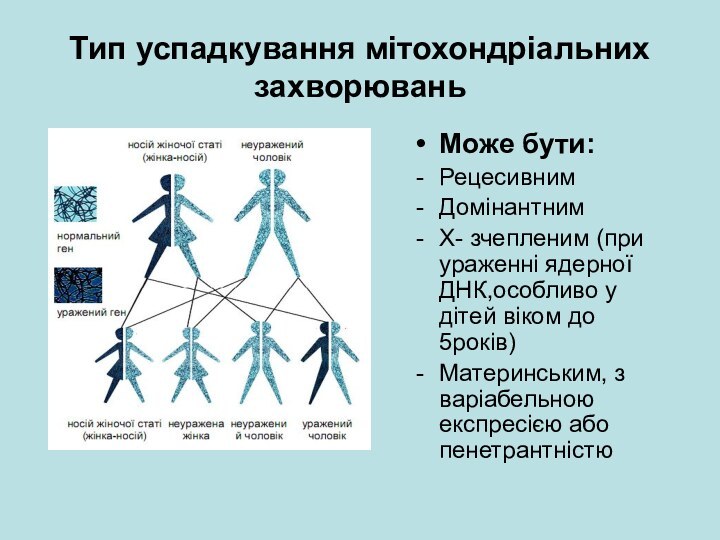
Тип успадкування мітохондріальних захворювань
Може бути:
Рецесивним
Домінантним
Х- зчепленим (при ураженні
ядерної ДНК,особливо у дітей віком до 5років)
Материнським, з варіабельною
експресією або пенетрантністю
Слайд 11
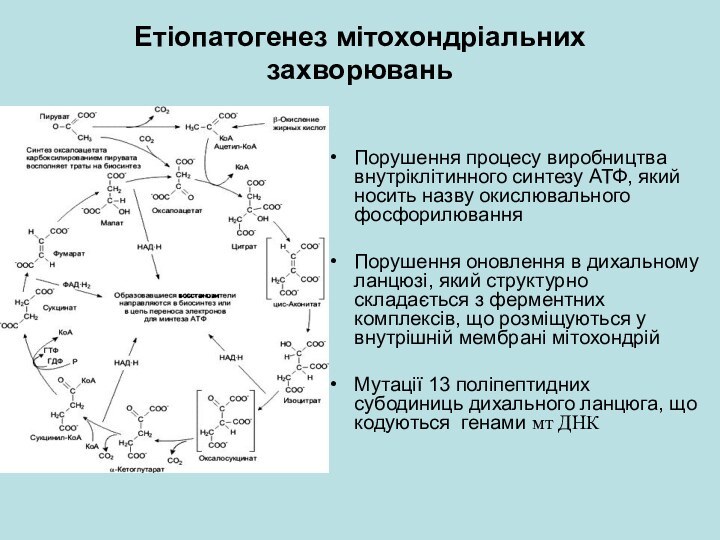
Етіопатогенез мітохондріальних захворювань
Порушення процесу виробництва внутріклітинного синтезу АТФ,
який носить назву окислювального фосфорилювання
Порушення оновлення в дихальному ланцюзі,
який структурно складається з ферментних комплексів, що розміщуються у внутрішній мембрані мітохондрійМутації 13 поліпептидних субодиниць дихального ланцюга, що кодуються генами мт ДНК
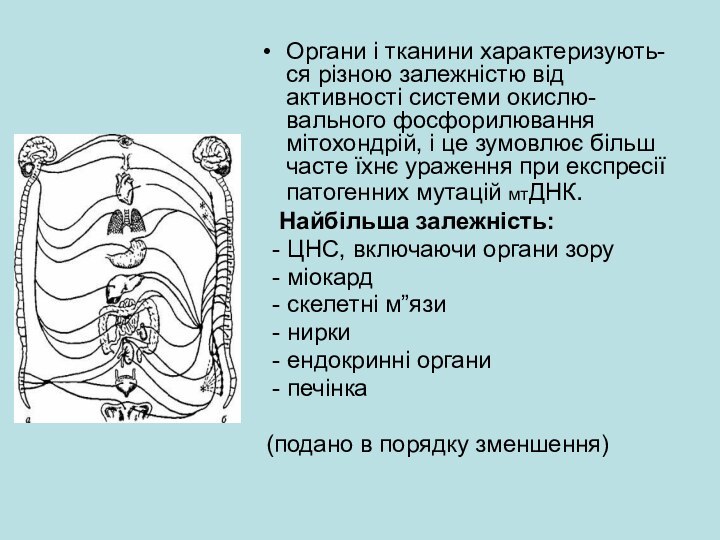
Слайд 12 Органи і тканини характеризують-ся різною залежністю від активності
системи окислю-вального фосфорилювання мітохондрій, і це зумовлює більш часте
їхнє ураження при експресії патогенних мутацій мтДНК.Найбільша залежність:
- ЦНС, включаючи органи зору
- міокард
- скелетні м”язи
- нирки
- ендокринні органи
- печінка
(подано в порядку зменшення)
Слайд 13
Класифікація патогенних мтДНК мутацій
Молекулярно-генетична класифікація:
•
інсерція-делеція мтДНКзовнішня офтальмопатія
синдром Кернса-Сейра
синдром Пірсона
асиметричний птоз
двобічний птоз з офтальмопарезом та міотонією м’язів нижніх кінцівок
дилятаційна кардіоміопатія
NARP-синдром
• мутації структурних генів
синдром MERF
синдром MELAS
• заміна основ з порушенням білкового синтезу в мітохондріях
фумарова ацидемія
глутарова ацидемія
Слайд 14
Класифікація мітохондріальних захворювань (Wallace,1992)
1.Місенс-мутантні:
Нейроофтальмопатія Лебера
Пігментний ретиніт
2. Мутації у
генах тРНК:
синдром MERF
синдром MELAS
3. Делеції або дуплікації мтДНК:
зовнішня офтальмопатія
синдром
Кернса-Сейрасиндром Пірсона
асиметричний птоз
двобічний птоз з офтальмопарезом та міотонією м’язів нижніх кінцівок
дилятаційна кардіоміопатія
NARP-синдром
Слайд 15
Класифікація мітохондріальних захворювань (Wallace,1992)
4. Мутації,що знижують число копій
мтДНК:
летальна інфантильна дихальна недостатність
синдром молочно-кислого ацидозу
5. Мутації в ядерній
ДНК:фумарова ацидемія
глутарова ацидемія
дефіцит ацил-Ко-А-дегідрогенази жирних кислот з довгим вуглеводним ланцюгом
дефіцит ацил-Ко-А-дегідрогенази жирних кислот з середнім вуглеводним ланцюгом
дефіцит ацил-Ко-А-дегідрогенази жирних кислот з коротким вуглеводним ланцюгом
підгостра некротизуюча енцефаломіопатія Лея
прогресуюча склерозуюча полідистрофія Альперса
трихополідистрофія Менкеса
Слайд 16 Описано більш, як 100 точкових мутацій мтДНК і
сотні перебудов мітохондріального геному.
Захворювання основою яких є
порушення функції окислювального фосфорилювання:Хвороба Альцгеймера (AD)
Хвороба Лебера(LHON),хворба Лебера і дистонія (LDYT)
Хвороба Паркінсона (PD)
Дитяча кардіоміопатія “плюс” (FICP)
Гастроінтестинальний рефлюкс (GER)
Інсуліннезалежний цукровий діабет (NIDDM)
Летальна дитяча мітохондріальна міопатія (LIMM)
Мітохондріальна міопатія (MM)
Синдром деменції і хореї (DEMCHOR)
Синдром раптової дитячої смерті (SIDS) та інші.
Слайд 17
Найбільш часті органопатії при дефектах дихального ланцюга
ЦНС: пре-,
перинатальна енцефалопатія, епі-еквіваленти, епілепсія, полінейропатія.
Очі: птоз, амбліопія, офтальмоплегія, пігментний
ретиніт, атрофія зорових нервів, ністагм, катаракта.Серце: гіпертрофічна кардіоміопатія, аритмії, порушення провідної системи.
• Печінка: прогресуюча печінкова недостатність, помірна гепатомегалія
• Селезінка: спленомегалія
• Нирки: тубулопатія Фанконі, нефрит, ниркова недостатність
• Шлунково-кишковий тракт: рецидивуюча блювота, діарея, атрофія ворсин, порушення екзокринної функції підшлункової залози.
Слайд 18
Найбільш часті органопатії при дефектах дихального ланцюга
Ендокринна система:
низький ріст, цукровий діабет
Кістковий мозок: панцитопенія, макроцитарна анемія
Шкіра: раннє
старіння, недостатній розвиток підшкірно-жирової клітковиниСкелет: аномалії розвитку
Слайд 19
Клінічні особливість мітохондріальних
захворювань
- Можуть проявлятися
неповністю, так як в клітині 100-1000 мітохондрій, кожна з
яких містить по 2-19 копій мтДНК, і якщо в деяких з них відбулися мутації, то іншікомпенсують функції дихання.
Дефекти дихального ланцюга проявляються в будь-якому віці.
Порушення внутрішньоутробного розвитку з розвитком внутрішньоутробної гіпотрофії і вад розвитку мозку
Наявність у малих дітей енцефаломіопатії, у дорослих - міопатії
Слайд 20
Методи дослідження мітохондріальних захворювань
клініко-генеалогічний аналіз
генетичний аналіз
морфологічний аналіз (біопсія)
біохімічний
метод дослідження (лактат, піруват, КФК, ЛФ, аланін)
додаткові методи дослідження(огляд
очного дна, УЗД внутрішніх органів, ЕЕГ, РЕГ, ехо-ЕГ, КТ, МРТ)Слайд 21 Місенс-мутантні мітохондропатії Синдром ЛЕБЕРА “грім серед ясного неба” зміни амінокислотного складу
поліпептидів І-го
комплексу дихального ланцюга
• Вперше
описаний Теодором Лебером в 1971 році• захворювання проявляється у віці 6 - 62 роки (частіше 11- 30 р.р.), розвивається гостро або підгостро • перші прояви- різке зниження гостроти зору одного ока, а через 7-8 тижнів - іншого ока. Зниження гостроти зору швидко прогресує однак повна сліпота буває рідко
• в сітківці ока відмирають і не відновлюються світлочутливі клітини • скарги: нечіткість зору при яркому світлі, кращий зір при заході сонця, що зумовлено мікроангіопатією сітківки
Слайд 22
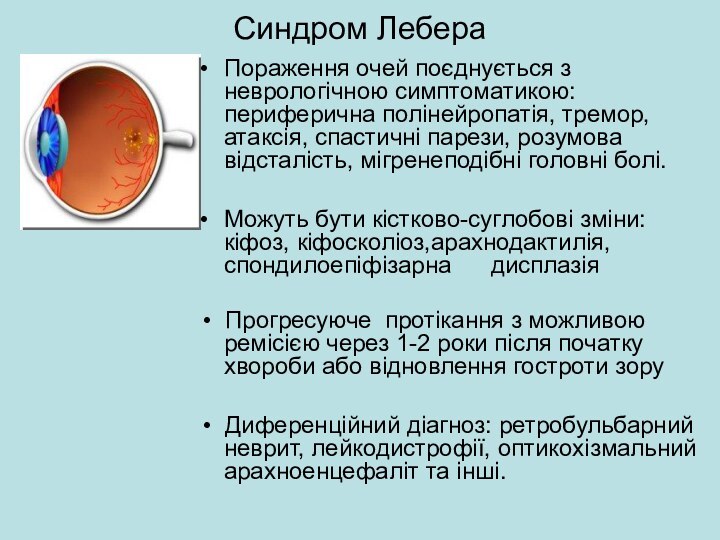
Синдром Лебера
Пораження очей поєднується з неврологічною симптоматикою: периферична
полінейропатія, тремор, атаксія, спастичні парези, розумова відсталість, мігренеподібні
головні болі.Можуть бути кістково-суглобові зміни: кіфоз, кіфосколіоз,арахнодактилія,спондилоепіфізарна дисплазія
• Прогресуюче протікання з можливою ремісією через 1-2 роки після початку хвороби або відновлення гостроти зору
• Диференційний діагноз: ретробульбарний неврит, лейкодистрофії, оптикохізмальний арахноенцефаліт та інші.
Слайд 23 Мутації у генах тРНК Синдром MERRF міоклонус-епілепсія,“рвані червоні волокна”
Зумовлений точковими мутаціями в гені лізинової т-РНК
в позиціях 8344, 8356 мтДНКСпадкується по материнській лінії з внутрісімейним поліморфізмом
Початок захворювання – 3 - 65 років
Ранні ознаки: швидка втомлюваність, біль в гомілкових м”язах, зниження пам”яті, уваги
Характерний симптомокомплекс: прогресуюча міоклонус-епілепсія(раптове, швидке, короткочасне скорочення м’язів)
сенсорні порушення(розлади вібраційної і м’язово-суглобової чутливості)
Слайд 24
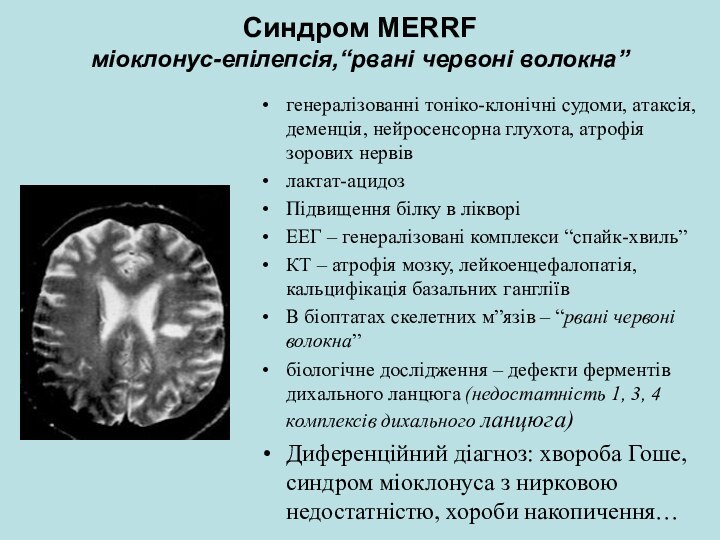
Синдром MERRF
міоклонус-епілепсія,“рвані червоні волокна”
генералізованні тоніко-клонічні судоми, атаксія,
деменція, нейросенсорна глухота, атрофія зорових нервів
лактат-ацидоз
Підвищення білку в лікворі
ЕЕГ
– генералізовані комплекси “спайк-хвиль”КТ – атрофія мозку, лейкоенцефалопатія, кальцифікація базальних гангліїв
В біоптатах скелетних м”язів – “рвані червоні волокна”
біологічне дослідження – дефекти ферментів дихального ланцюга (недостатність 1, 3, 4 комплексів дихального ланцюга)
Диференційний діагноз: хвороба Гоше, синдром міоклонуса з нирковою недостатністю, хороби накопичення…
Слайд 25
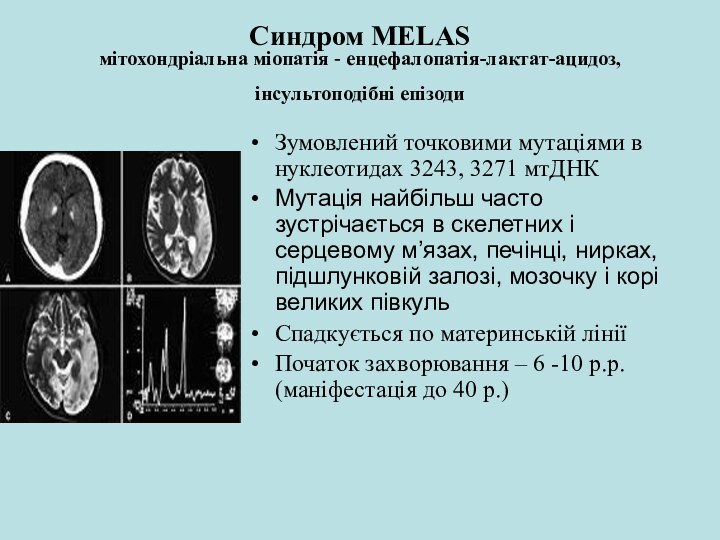
Синдром MELAS
мітохондріальна міопатія - енцефалопатія-лактат-ацидоз, інсультоподібні епізоди
Зумовлений
точковими мутаціями в нуклеотидах 3243, 3271 мтДНК
Мутація найбільш часто
зустрічається в скелетних і серцевому м’язах, печінці, нирках, підшлунковій залозі, мозочку і корі великих півкульСпадкується по материнській лінії
Початок захворювання – 6 -10 р.р. (маніфестація до 40 р.)
Слайд 26
Синдром MELAS
мітохондріальна міопатія - енцефалопатія-лактат-ацидоз, інсультоподібні епізоди
Ранні
ознаки: судоми (фокальні пароксизми, генералізовані тоніко-клонічні напади, міоклонії, резистентні
до терапії),Інсультоподібні епізоди: рецидивуючий біль голови, запаморочення, блювота, анорексія, вогнищева симптоматика, коматозні стани (гостра недостатність енергетичних субстратів в клітинах)
Слайд 27
Синдром MELAS
Характерні ознаки мітохондріальної недостатності – непереносимість фізичних
навантажень – різке погіршення самопочуття, поява м”язової слабкості, міалгії
При
комп’ютерній томографії головного мозку виявляються зони інфарктів, переважно в області гемісфер, що зумовлює неврологічну симптоматику.Диференційний діагноз: синдром Лея (підгостра некротизуюча енцефалопатія), органічні ацидеміії, гомоцистинурія, судинні аномалії
Слайд 28
Делеції або дуплікації мтДНК
Синдром Кернса — Сейра
• Вперше описаний Кернсом в 1946 році
найбільш високий
вміст мутантної мітохондріальної ДНК знаходиться в скелетних м’язах і мозковій тканині (60-85%)меньша кількість - в серці, печінці, нирках, гладких м’язах, лейкоцитах
перші ознаки хвороби появляються у віці від 4 до 14 років (до 20 років)
Слайд 29
Синдром Кернса — Сейра
основні клінічні прояви — прогресуюча
зовнішня офтальмоплегія, пігментний ретиніт (симетричний, білатеральний птоз, обмеження руху
очних яблук, іноді зниження гостроти зору)міопатичний синдром (через декілька років від початку птозу поява маскоподібного, гіпомімічного обличчя, зміни тембру голосу, поперхувань, втоми при тривалій мові)
при фізичних навантаженнях поява міалгій, міотоній, тремору
Слайд 30
атріовентрикулярна блокада серця
мозкова атаксія.
ендокринні розлади: низький ріст,
гінекомастія, гіпогонадизм, цукровий діабет, гіперальдостеронізм, гіпопаратиреоз
кістково-сулобова система: кіфосколіоз, кранеосіностоз,
метафізарна дисплазіяпорушення емалегенезу
сечовивідна система: нирковий тубулярний ацидоз, синдром де Тоні-Дебре-Фанконі
Синдром Кернса — Сейра
Слайд 31
Синдром Кернса — Сейра
Повна форма хвороби:
- хронічна
прогресуюча зовнішня офтальмоплегія
- пігментний ретиніт
- атріовентрикулярна блокада
•
Неповний форма:І варіант:
- хронічна прогресуюча зовнішня офтальмоплегія
- міопатія низхідного типу + будь-який інший симптом
ІІ варіант:
- ізольована хронічна прогресуюча зовнішня офтальмоплегія
Диференційний діагноз : з іншими формами прогресуючих міопатій, синдром Толоза- Ханта, офтальмоплегічна мігрень, діабетична полінейропатія, міастенія
Слайд 32
Синдром Кернса — Сейра
При лабораторному обстеженні - підвищений
рівень білку в спинномозковій рідині (більше 1 г/л).
В крові
і спинномозковій рідині збільшений вміст молочної і піровиноградної кислот.Характерна морфологічна ознака
захворювання - наявність «рваних» червоних волокон (RRF), які знаходять при світловій мікроскопії м’язової тканини.
Слайд 33
Синдром Пірсона
Описаний Pearson в 1979 році
в основі лежать
делеції мтДНК
більшість дітей не доживає до 4-х річного
вікухворіє меньше сотні дітей в усьому світі
в періоді новонародженості - гіпотонія, гіпоглікемія, важкий лактатацидоз
характерною ознакою є виражена сидеробластна анемія з вакуолізацією еритроїдних і мієлоїдних попередників
дисфункція підшлункової залози, в подальшому з розвитком діареї і затримкою фізичного розвитку, іноді в поєднанні з інсулінзалежним цукровим діабетом
Слайд 34
Синдром Пірсона
макроцитарна анемія з нейтропенією і тромбоцитопенією.
порушення
перистальтики кишківника, блювота, гастропарез і псевдообструкція.
недостатність функції печінки,
стеатоз, гемосидероз, цироз
Слайд 35
Синдром Пірсона
Лабораторне дослідження - наявність лактатацидозу, комплексної органічної
ацидурії, підвищення вмісту гемоглобіну F і збільшення активності аденозиндезамінази
біопсія
скелетних м’язів - характерні рвані червоні волокна і інші аномалії ультраструктуриПідвищене співвідношення лактат/піруват в плазмі і аномалії ОФ (oxidative phosphorilation) в лімфоцитах підтверджує мітохондріальну природу хвороби
Слайд 36
Синдром Пірсона
посмертно виявляють портальну дилятацію, фіброз, холестаз і
гепатоцелюлярний гемосидероз
у пацієнтів, які прожили декілька років, в подальшому
развиваються ознаки синдрому Кернса-Сейра (Kearns-Sayre syndrome) з енцефаломієлопатичною офтальмоплегією, пігментною ретинопатією і церебелярним синдромом.вважють, що синдром Пірсона і синдром Кернса-Сейра мають загальний патогенетичний механізм.
Слайд 37
Лікування мітохондріальних захворювань
Кетогенна дієта (60% енергії- жир) +
янтарна кислота
уникнення довготривалого голодування та багато-вуглеводної їжі
адекватне застосування рідини,
електролітівуникнення тривалих великих фізичних навантажень
виключення препаратів і процедур, які здатні гальмувати енергетичний механізм(барбітурати, препарати вальпроєвої кислоти, хлорамфенікол)
попередження кислотно-радикального ушкодження мітохондріальних мембран
(вітаміни С і Е)
Слайд 38
Лікування мітохондріальних захворювань
Патогенетичне:
(Спрямоване на підвищення
активності дихальної ланки мітохондрій):
кофермент Q10 (4,3мг/кг в добу)
сукцинат натрію
(6гр / добу)вітаміни К1(філоквінон) 0,4 мг/кг, К3(менадіон) 1 мг/кг ,С 50-60 мг/кг
Ідебенон (90мг/ добу)
L- карнітин чотирма дозами по 50-100-200 мг/кг/добу під контролем РН крові
• Кортикостероїди (механізм дії неясний)
• Дихлорацетат (від15 до в добу) – стимулює активність ПВК-дегідрогенази, зменшення рівня лактату і аланіну плазми крові
Симптоматичне: аналгетики, протисудомні, седативні,інфузії соди і.т.д.