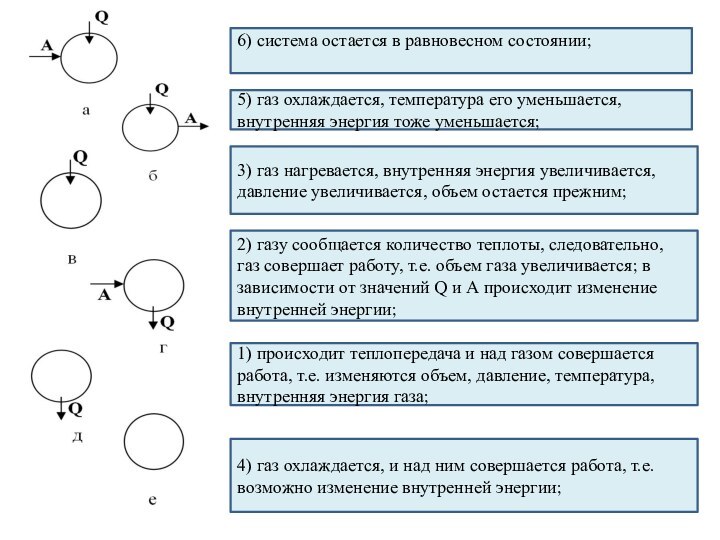
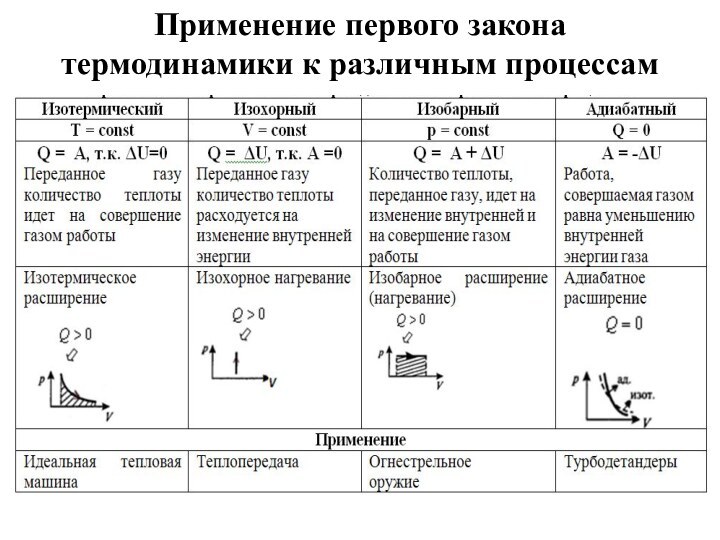
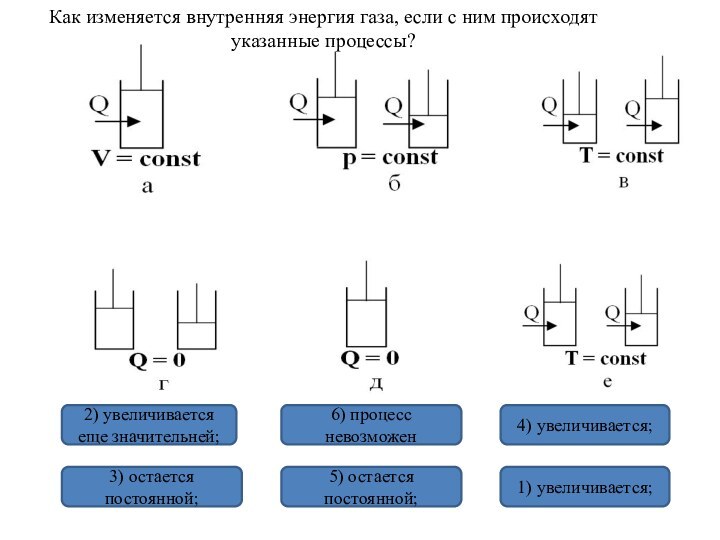
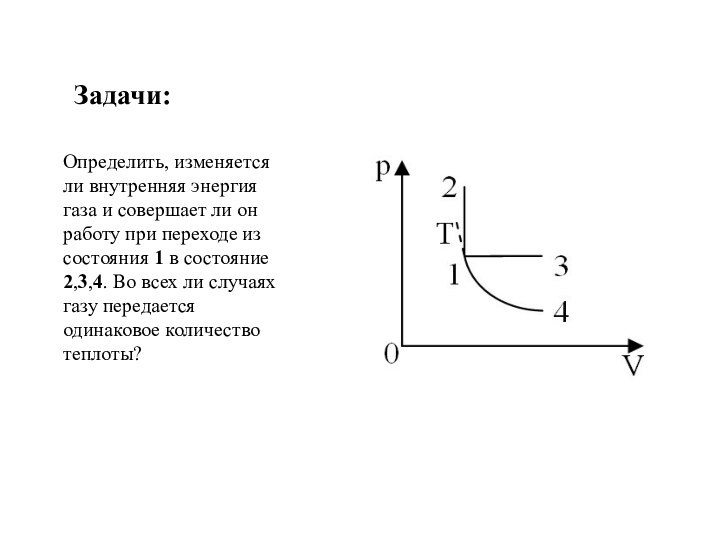
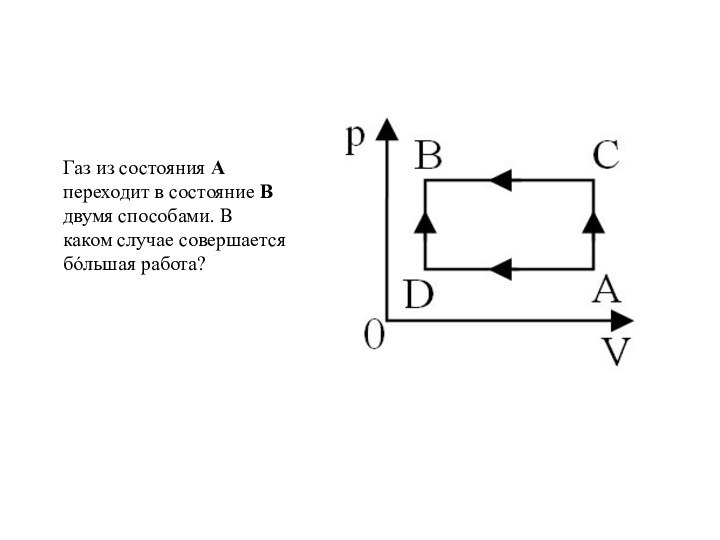
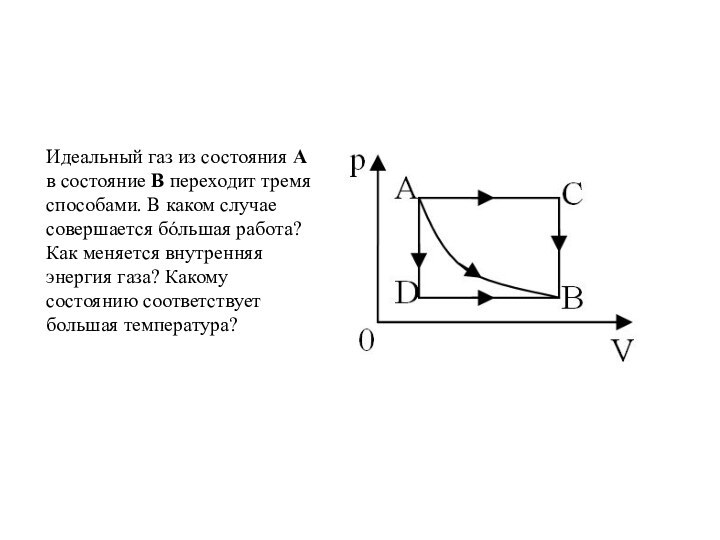
и превращения энергии термодинамической системы;
ввести понятие об адиабатном
процессе; раскрыть физическое содержание первого начала термодинамики при рассмотрении конкретных процессов;
продолжить формирование умений описывать тепловые процессы физическими величинами и законами