веществ в отличающиеся от них по химическому составу или
строению новые вещества (продукты реакции).Вспомните определения:
Исходные вещества - это…
Продукты реакции - это…
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



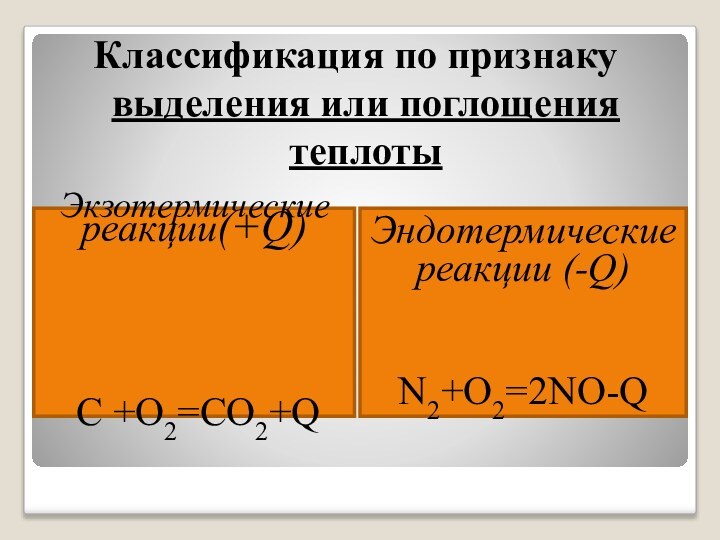











Разложение перманганата калия:
t
2KMnO4 → K2MnO4 + MnO2+ O2↑
Разложение дихромата аммония:
t
(NH4)2Cr2O7 = Cr2O3 + N2 ↑ + 4H2O