Слайд 2
Второй постулат Бора гласит: атом излучает фотоны только
при переходе из стационарного состояния с большей энергией Ek
в стационарное состояние с меньшей энергией Em. При этом энергия излученного фотона равна разности энергий стационарных состояний:
hν=Ek- Em (1)
Слайд 3
Соотношение 1 позволяет рассчитать частоту ν с индексом
km излучения, соответствующего фотону, который образуется при переходе электрона
с орбиты, соответствующей главному квантовому числу k, на орбиту, соответствующую меньшему главному квантовому числу m:
ν=Ek- Em / h (2)
Слайд 4
Для атома водорода с учетом уравнений (5) из
ξ70 получаем:
ν=2π2k2mee4/h3 * (1/m2-1/k2) (3)
Атом химического элемента имеет
свой уникальный набор стационарных орбит, отличающий данный элемент от других химических элементов.
Поэтому атом данного хим элемента может излучать фотоны, имеющие строго определенные энергии,т.е. электромагнитные волны строго определенных частот.
Слайд 5
Набор частот электромагнитных волн (фотонов), излучаемых атомом данного
химического элемента, называют спектром излучения этого элемента.
Слайд 6
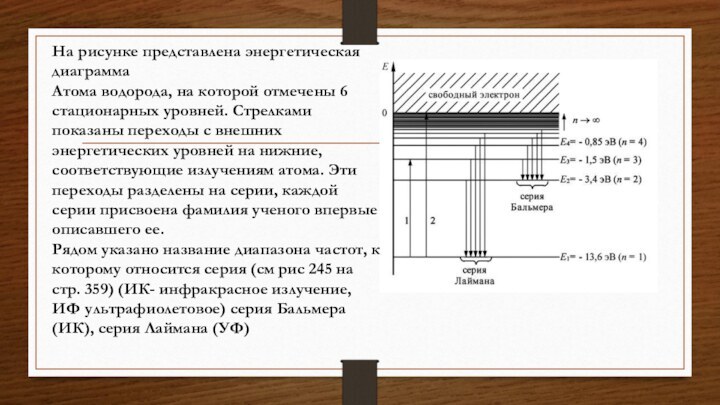
На рисунке представлена энергетическая диаграмма
Атома водорода, на которой
отмечены 6 стационарных уровней. Стрелками показаны переходы с внешних
энергетических уровней на нижние, соответствующие излучениям атома. Эти переходы разделены на серии, каждой серии присвоена фамилия ученого впервые описавшего ее.
Рядом указано название диапазона частот, к которому относится серия (см рис 245 на стр. 359) (ИК- инфракрасное излучение, ИФ ультрафиолетовое) серия Бальмера (ИК), серия Лаймана (УФ)
Слайд 7
Атом может не только излучать, но и поглощать
энергию электромагнитного излучения. Согласно теории Бора, поглощая фотон, атом
переходит из стационарного состояния с меньшей энергией Em в стационарное состояние с большей энергией Ek. При этом частота поглощенного фотона удовлетворяет соотношению, hν=Ek- Em (4)
Слайд 8
Из hν=Ek- Em (1) и hν=Ek-
Em (4) следует, что частицы электромагнитных волн (фотонов), которые
атом может поглощать, совпадают с частотами волн (фотонов), которые атом может излучать.
Слайд 9
Набор частот электромагнитных волн (фотонов), поглощаемых атомом данного
химического элемента, называют спектром поглощения этого элемента
Слайд 10
Значит, линии в спектрах поглощения и излучения уединенного
атома данного элемента совпадают.
Переход атома из одного стационарного
состояния в другое стационарное состояние с большей энергией может происходить не только в результате поглощения фотона, но и в результате взаимодействия с другими атомами или элементарными частицами.
Если атом, находившийся в основном стационарном состоянии, поглотит энергию, превышающую E1, то его электрон перейдет из основного состояния в свободное. Поэтому энергию, равную E1, называют энергией ионизации.
Слайд 11
Движение и взаимодействие атомов др с др в
веществе приводит к изменению спектров как излучения, так и
поглощения. Наблюдавшиеся в спектре уедененного атома линии становятся шире (уширяются). Это связано с тем, что каждый атом движется и взаимодействует со своими соседями по-разному. Поэтому разность энергий Ek- Em для каждого из атомов данного химического элемента несколько различается. Результатом этого будет наблюдаемое уширение спектральных линий от набора атомов данного химического элемента.
Слайд 12
При больших скоростях движений атомов и молекул и
сильном взаимодействии их друг с другом уширенные линии в
спектре сливаются и спектр становится сплошным.
Слайд 13
Модель атома Резерфорда – Бора, позволяющая объяснить наблюдаемые
в эксперименте спектры атома водорода, оказалась неприменимой для описания
более сложных атомов. Искусственное соединение законов Ньютона и Кулона из классической физики с идеей Планка о квантовании энергии привело к противоречию с результатами экспериментов. Однако модель Резерфорда –Бора послужила одним из толчков для создания современной квантовой теории. Было установлено, что гениально угаданные Бором постулаты являются следствиями основных положений этой теории.
Слайд 14
Задание1. Как изменится энергия электрона атоме водорода, если
атом излучает фотон, который имеет длину волны λ=4,86⋅10−7м?
Слайд 15
Решение. На основании второго постулата Бора запишем:
ΔE=En−Em=hν.
Длину волны
фотона свяжем с его частотой при помощи выражения:
ν=cλ
Принимая во
внимание выражение и формулу преобразуем к виду:
ΔE=hcλ.
Скорость света в вакууме равна c=3⋅10 в 8 мс , можем провести вычисления:
ΔE=6,63⋅10−34⋅3⋅1084,86⋅10−7=4,09⋅10−19(Дж).
Ответ. ΔE=4,09⋅10−19Дж
Слайд 16
Задание 3 Установите соответствие между названиями постулатов и
их формулировками. К каждой позиции первого столбца подберите нужную
позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
Слайд 24
1. Уровни энергии электрона в
атоме водорода задаются формулой E=-
13,6/n2 эВ, где n=1,2,3…. При переходе атома из состояния E2 в состояние E1 атом испускает фотон. Попав на поверхность фотокатода, этот фотон выбивает фотоэлектрон. Длина волны света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода, λкр=300 нм. Чему равна максимально возможная кинетическая энергия фотоэлектрона?
Слайд 25
Решение.
Согласно постулатам Бора, свет излучается при переходе атома
на более низкие уровни энергии, при этом фотоны несут
энергию, равную разности энергий начального и конечного состояний. Таким образом, испущенный фотон имел нес энергию
hν=E2-E1= -13,6 эВ (1/2(в квадрате)- 1/1 (в кв))= 10,2 эВ
Согласно уравнению фотоэффекта, максимальная кинетическая энергия вылетающих фотоэлектронов связана с энергией фотона и работой выхода соотношением
hν=А+Е
Работа выхода связана с длиной волны красной границы соотношением:
А=hc/λкр
Слайд 26
Таким образом, максимально возможная кинетическая энергия фотоэлектрон равна
Е=hν-А=10,2
эВ- 6,62 на 10 в минус 34на 3 в
10 в 8/ 3 на 10 в минус7 *1/1,6 на 10 в минус 19 эВ= 6,1 эВ
Слайд 27
2.На рисунке изображена схема возможных значений энергии атомов
разреженного газа.
В начальный момент времени атомы находятся в состоянии
с энергией Е3 Возможно испускание газом фотонов с энергией
1) только 2 на 10 в минус 18 Дж
2) Только 3 на 10 в минус 18 и 6 на 10 в минус 18 Дж
3) только 2 на 10 в минус 18, 5 на 10 в минус 18 и 8 на 10 в минус 18 Дж
4) любой от 2 на 10 в минус 18 до 8 на 10 в минус 18 Дж
Слайд 28
Решение.
В описанной ситуации атомы будут спонтанно переходить из
состояния с энергией Е3 в состояния с меньшей энергией:
Е1 и Е2 Кроме того те атомы, которые перешли в состояние с энергией Е2 могут впоследствии опуститься еще ниже, то есть перейти в состояние с энергией Е1. Согласно постулатам Бора, при переходе в состояние с меньшей энергией происходит испускание фотона света с энергией, равной разности энергий начального и конечного состояний. Таким образом, возможно испускание газом фотонов с энергиями:
Е3-Е1=-2на 10 в минус 18 – (-8 на 10(-18))= 6 на 10(-18),
Е3-Е2= -2на 10(-18)-(-5 на 10(-18))=3 на 10(-18)и
Е2-Е1= -5на 10(-18) – (-8 на 10(-18))= 3 на 10 (-18) Дж
Ответ:2
Слайд 29
3. Электрон в атоме водорода переходит с энергетического
уровня с номером n = 2 на энергетический уровень
с n = 1. Чему равен модуль импульса испущенного при этом фотона? Ответ выразите в кг · м/с, умножьте на 10 в 29 и после этого округлите до целого числа.
Слайд 30
Решение. Уровни энергии электрона в атоме водорода задаются
формулой E=- 13,6/n2 эВ, где n=1,2,3…. эВ, где
n = 1, 2, 3, ... При переходе атома из состояния Еn в состояние Em атом испускает фотон с энергией Е= Еn-Em При переходе со второго на первый энергетический уровень атом испустит фотон с энергией
Е=Е2-Е1=13,6*(1-1/4)=10,2эВ
Импульс фотона связан с его энергией как p=E/c тогда
10 в (29) * 10,2*1,6 на 10 (-19)/3 на 10(8)= 544 кг*м/с
Слайд 31
4. Покоящийся атом излучает фотон с энергией 16,32
на 10 (-19) Дж в результате перехода электрона из
возбуждённого состояния в основное. Атом в результате отдачи начинает двигаться поступательно в противоположном направлении с кинетической энергией 8,81 на 10(-27) Дж. Найдите массу атома. Скорость атома считать малой по сравнению со скоростью света.
Слайд 32
Решение.
Ядерные силы намного больше внешней силы тяжести, действующей
на атом и фотон, поэтому система является замкнутой и
выполняется закон сохранения импульса. Изначально атом покоился и импульс системы был равен нулю. Следовательно, импульс фотона равен импульсу излучившего атома: Рф=Рат
Импульс тела связан с его кинетической энергией. Скорость атома мала по сравнению со скоростью света, поэтому для атома эта связь выражается нерелятивистским соотношением: Еат= Р2ат/2mат а для фотона Еф=РфС Выражая отсюда импульсы и подставляя их в закон сохранения, получаем
Еф/С= корень квадратный под корнем 2mат*Еат значит mат=Е2ф/2ЕатС2
mат=1,67 на 10 (-27) кг
Слайд 33
5. В атоме водорода уровни энергии описываются формулой
Еn=-E0/n2 . Наибольшая длина волны излучаемого фотона при переходе
на второй уровень энергии равна 655 нм. Найдите E0.
Слайд 34
Решение.
1. Структуру атомных уровень атома водорода можно схематично
представить в виде следующей схемы.
Поглощению фотона соответствует переход с
нижнего уровня на верхний. Излучению — переход с верхнего уровня на нижний.
2. В условии говорится о излучении при переходе на уровень 2. То есть это переходы 3→2, 4→2, 5→2. Переход с наибольшей длиной волны соответствует переходу с наименьшей частотой излучаемого фотона. А это возможно при переходе с ближайшего ко 2 уровню энергии — то есть с третьего на второй λmax.→ νminт. к. λν=с, νmin: 3→2.
Слайд 35
Согласно постулатам Бора частота излучаемого фотона определяется
соотношением:
hν=Е3-Е2;
hс/λ2= - E0//3(2) + E0/2(2);
hс/λ2= 9Е0-4Е0/4*9;
hс/λ2= 5Е0/4*9;
Теперь найдем значение Е0: hс/λ2= 5Е0/4*9; Е0= 36hс/5λ2=
= 36*6,6*10 в (-34) *3*10(8)/ 5*655*10(-9)= 2,18 на 10(-18) Дж.
Слайд 36
6. При облучении паров ртути электронами энергия атома
ртути увеличивается на 4,9 эВ. Какова длина волны излучения,
которое испускают атомы ртути при переходе в невозбужденное состояние?
Слайд 38
7.Для ионизации атома азота необходима энергия 14,53 эВ.
Найти длину волны излучения, которое вызовет ионизацию.
Слайд 40
8.Для однократной ионизации атомов неона требуется энергия 21,6
эВ, для двукратной — 41 эВ, для трехкратной —
64 эВ. Какую степень ионизации можно получить, облучая неон рентгеновскими лучами, наименьшая длина волны которых 25 нм?
Слайд 41
Данная длина волны может вызвать однократную и двукратную
ионизацию, так как энергия фотона 49,6 эВ.
Слайд 42
9.Во сколько раз изменится энергия атома водорода при
переходе атома из первого энергетического состояния в третье? при
переходе из четвертого энергетического состояния во второе?
Слайд 44
10. Во сколько раз длина волны излучения атома
водорода при переходе из третьего энергетического состояния во второе
больше длины волны излучения, обусловленного переходом из второго состояния в первое?
Слайд 45
Дано:
n1=3, k1=2,
n2 = 2, k2 = 1.
Найти