Слайд 2
ПЛАН
изучения отдельного вида дисперсной системы
Определение.
Классификация.
Методы получения.
Особенности строения частиц
ДФ.
Особенности свойств: а) молекулярно-кинетических;
б) оптических;
в) электрокинетических.
Методы стабилизации.
Методы разрушения.
Слайд 3
8.1 Коллоидные системы
Коллоидное состояние – это высокодисперсное состояние, когда частицы дисперсной
фазы имеют размеры 0,001…0,1 мкм или 1…100 нм.
Классификация:
По интенсивности взаимодействия частиц ДФ с молекулами дисперсионной среды:
лиофильные коллоиды;
лиофобные коллоиды.
По интенсивности взаимодействия частиц ДФ друг с другом:
золи;
гели и студни.
Слайд 4
8.1.1 Лиофильные золи
Лиофильные золи являются термодинамически устойчивыми системами
и образуются самопроизвольно. К ним относятся:
растворы высокомолекулярных соединений
(ВМС);
коллоидные растворы поверхностно-активных веществ (ПАВ).
А. Растворы ВМС
Классификация ВМС:
не содержащие функциональные группы (полиэтилен и др.);
содержащие полярные неионогенные функциональные группы (-ОН, -OR и другие, например, поливиниловый спирт);
полиэлектролиты :
содержащие кислотные группы ( - СООН, -SO3H и другие);
содержащие основные группы, например, -NH2;
полиамфолиты, которые одновременно содержат как кислотные, так и основные группы, например, белки;
Слайд 5
Методы получения. Растворы ВМС образуются самопроизвольно только методом
диспергирования и весь процесс происходит в две стадии:
набухание (∆H
0 и ∆S ≈ 0);
растворение ( ∆H ≈ 0 и ∆S > 0).
Особенности строения частиц ДФ.
Причины появления зарядов у макромолекул:
диссоциации ионогенных функциональных групп макромолекул полиэлектролитов ;
адсорбция на полярных неионогенных группах макромолекулы определенных ионов из раствора.
Слайд 6
Особенности строения белковых молекул.
Первичная структура – это полипептидная
цепь, в которой остатки аминокислот расположены в определенной последовательности.
Вторичная
структура возникновение спиралевидной конформации макромолекулы белка за счет образования водородных связей между СО- и NH-группами полипептидной цепи.
Третичная структура – это глобула или фибрилла, образованная из спиралевидной макромолекулы белка.
Четвертичная структура белков образуется путем объединения одинаковых или неодинаковых молекул белка, соединенных слабыми межмолекулярными связями.
Слайд 7
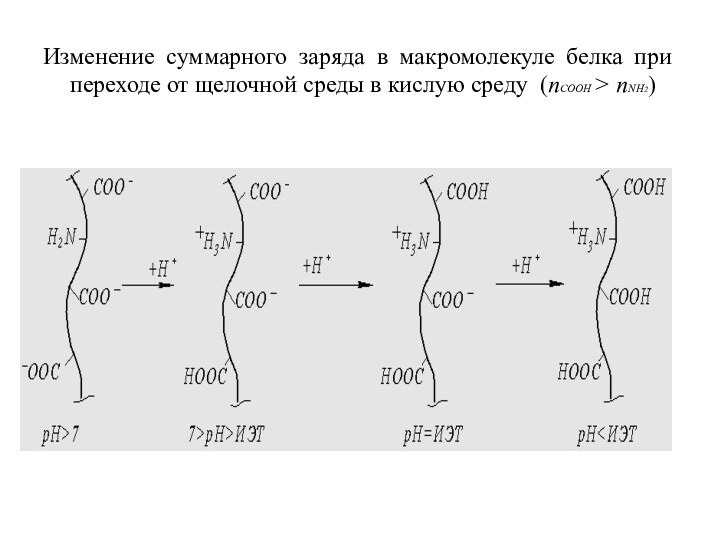
Изменение суммарного заряда в макромолекуле белка при переходе
от щелочной среды в кислую среду (nCOOH > nNH2)
Слайд 8
Особенности свойств растворов ВМС.
Диффузия и броуновское движение достаточно
интенсивные, седиментация выражена слабо, осмотическое давление небольшое, мембранное равновесие
Доннана проявляется.
Эффект Фарадея-Тиндаля наблюдается, опалесценция имеет место, большинство растворов не окрашены или слабо окрашены.
Подвергаются электрофорезу.
Методы стабилизации. Система термодинамически устойчива в соответствующей дисперсионной среде.
Агрегативная устойчивость обеспечена двумя факторами:
наличием одноименных зарядов макромолекул;
наличием сольватных оболочек вокруг макромолекул.
Кинетическая устойчивость проявляется из-за относительно небольших размеров макромолекул.
Слайд 9
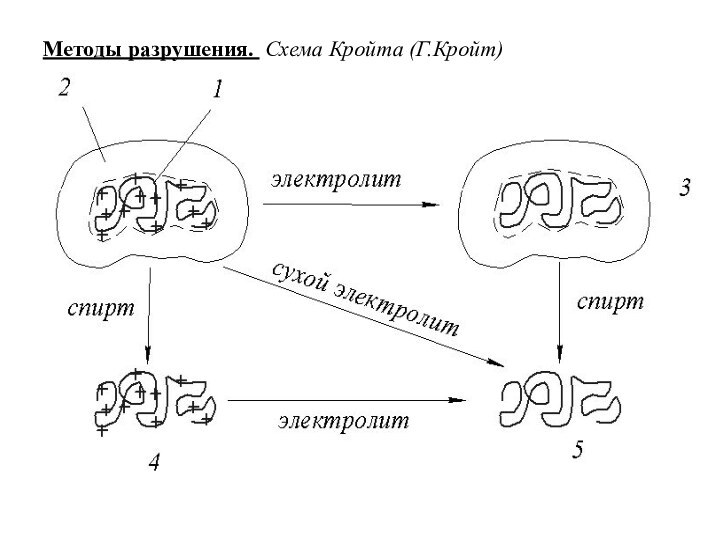
Методы разрушения. Схема Кройта (Г.Кройт)
Слайд 10
Лиотропные ряды ионов Гоффмейстера:
- ряд анионов
- ряд
катионов
Виды разрушения устойчивости:
коацервация ‒ это образование в растворе
ВМС капель, обогащенных растворенным веществом, при создании условий взаимно-ограниченной растворимости компонентов раствора;
высаливание ‒ это выделение ВМС из раствора в виде отдельного слоя путем введения в раствор другого, как правило, хорошо растворимого в данном растворителе вещества – высаливателя;
денатурация белков – это потеря первичных свойств белков, вызванная изменениями пространственной структуры.
Слайд 11
Структурообразование в растворах ВМС.
Студнеобразование – это процесс
появления и постепенного упрочнения в растворе ВМС пространственной сетки,
состоящей из макромолекул.
Влияющие факторы:
концентрация ВМС;
форма и размер макромолекул;
температура;
время;
электролиты;
рН среды.
Синерезис – это процесс самопроизвольного уплотнения студней с сохранением формы пространственного каркаса, сопровождающийся отделением (выдавливанием) дисперсионной среды из ячеек структурной сетки.
Слайд 12
Б. Коллоидные растворы ПАВ
Классификация ПАВ.
Неионогенные ПАВ в растворах
не распадаются на ионы.
Ионогенные ПАВ:
анионные ПАВ – диссоциируют с
образованием поверхностно-активного аниона;
катионные ПАВ - диссоциируют с образованием поверхностно-активного катиона;
амфолитные ПАВ – одновременно содержат и кислотные, и основные группы.
Методы получения. Коллоидные растворы ПАВ получаются при концентрациях СМ >0,0001…0,001 моль/л самопроизвольно.
Слайд 13
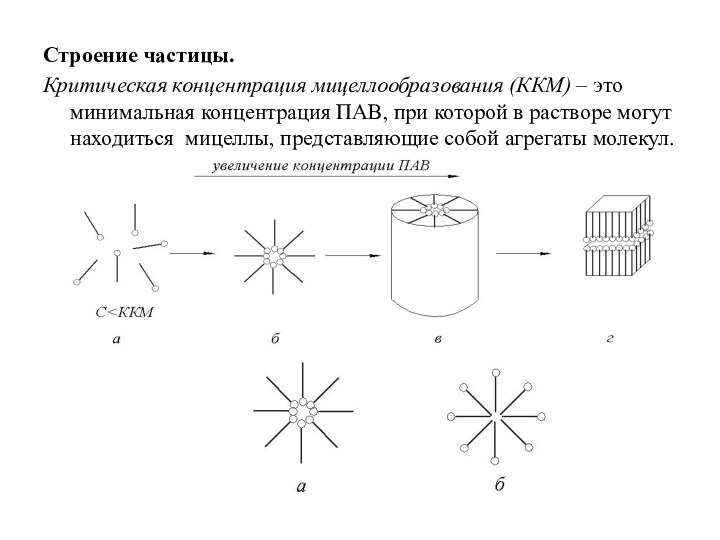
Строение частицы.
Критическая концентрация мицеллообразования (ККМ) – это минимальная
концентрация ПАВ, при которой в растворе могут находиться мицеллы,
представляющие собой агрегаты молекул.
Слайд 14
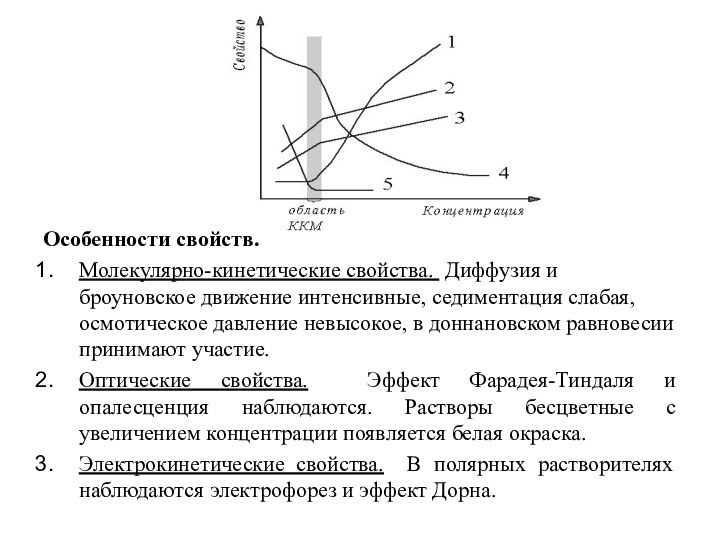
Особенности свойств.
Молекулярно-кинетические свойства. Диффузия и броуновское движение интенсивные,
седиментация слабая, осмотическое давление невысокое, в доннановском равновесии принимают
участие.
Оптические свойства. Эффект Фарадея-Тиндаля и опалесценция наблюдаются. Растворы бесцветные с увеличением концентрации появляется белая окраска.
Электрокинетические свойства. В полярных растворителях наблюдаются электрофорез и эффект Дорна.
Слайд 15
Методы стабилизации. Устойчивые системы. Основные факторы стабильности –
адсорбционно-сольватный, энтропийный и гидродинамические факторы. В полярных растворителях значительную
роль играет электростатический фактор.
Методы разрушения. В полярных растворителях разрушить мицеллы можно ослабив электростатический фактор:
добавление к анионным ПАВ катионных ПАВ и наоборот;
добавление к анионным ПАВ электролита с многовалентным катионом, а к катионным ПАВ – электролита с многовалентным анионом.
Солюбилизация – это самопроизвольный процесс перехода нерастворимых или малорастворимых соединений в водную фазу в присутствии коллоидных ПАВ.
Слайд 16
Число гидрофильно-липофильного баланса ПАВ (число ГЛБ):
гидрофильные группы:
гидрофобные группы:
Слайд 17
В зависимости от значения
ГЛБ ПАВ используют в следующих областях:
3…6 –
стабилизаторы эмульсий типа В/М (сорбитан моностеарат, глицерил моностеарат);
7…9 - смачиватели (силиконовые смачиватели для транспортерных лент обеспечивают легкое скольжение упаковок типа тетрапак),
8…13 – стабилизаторы эмульсий типа М/В (GRINDSTED® 100; GRINDSTED®CITREM)
13…15 –моющие средства (алкилсульфонаты, алкиларилсульфонаты, алкилсульфаты; например, лаурилсульфат натрия или додецилсульфат натрия);
15…16 – солюбилизаторы (NEOPAL, RICINO, LAUROPAN T 20)
Слайд 18
8.1.2 Лиофобные коллоиды
Характерно нерастворимость или очень малая растворимость
вещества дисперсной фазы в дисперсионной среде.
Классификация.
По характеру взаимодействия
частиц ДФ:
золи;
гели.
По природе дисперсионной среды:
гидрозоли;
органозоли.
Методы получения.
Методы диспергирования твердых тел в присутствии электролита-стабилизатора
Метод конденсации в истинных растворах.
Слайд 19
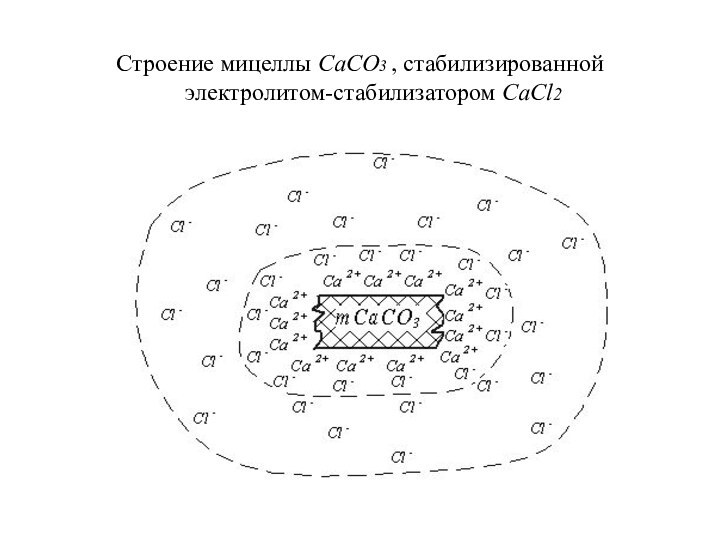
Строение мицеллы СаСО3 , стабилизированной электролитом-стабилизатором СаСl2
Слайд 20
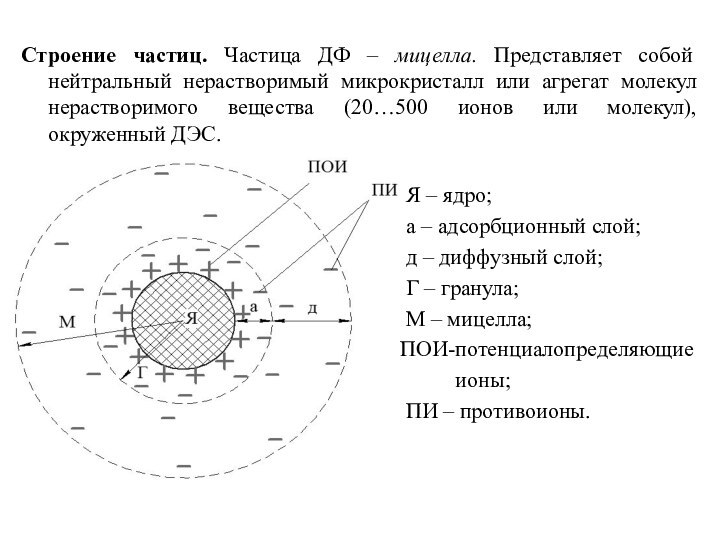
Строение частиц. Частица ДФ – мицелла. Представляет собой
нейтральный нерастворимый микрокристалл или агрегат молекул нерастворимого вещества (20…500
ионов или молекул), окруженный ДЭС.
Я – ядро;
а – адсорбционный слой;
д – диффузный слой;
Г – гранула;
М – мицелла;
ПОИ-потенциалопределяющие
ионы;
ПИ – противоионы.
Слайд 21
Особенности свойств.
Молекулярно-кинетические. Диффузия и броуновское движение интенсивные, устойчивое
диффузионно-седиментационное равновесие, осмотическое давление невысокое, в доннановском равновесии принимают
участие.
Оптические. Рассеивают свет. Эффект Фарадея-Тиндаля и опалесценция наблюдаются. Окраска от белого до черного. Имеет место полихромия.
Электрокинетические. Наблюдаются явления электрофореза и эффект Дорна.
Слайд 22
Методы стабилизации.
1. Электростатический фактор создается путем образования ДЭС
из ионов электролита-стабилизатора вокруг частицы ДФ. При |ς| >
25 мВ золь устойчив.
2. Адсорбционно-сольватный фактор образуется сольватированными ионами диффузного слоя мицеллы. Создание коллоидной защиты.
3. Структурно-механический фактор возникает при создании коллоидной защиты.
4. Энтропийный фактор стабилизации обусловлен высокой дисперсностью.
5. При повышении вязкости дисперсионной среды усиливается гидродинамический фактор устойчивости.
Слайд 23
Методы разрушения. Коагуляция – слипание частиц ДФ с
образованием более крупных агрегатов, приводящее появлению хлопьев, которые со
временем выпадают в осадок.
Действие электролита:
концентрационная коагуляция;
нейтрализационная коагуляция.
2. Действие смеси электролитов:
аддитивность;
синергизм;
антагонизм.
3. Гетерокоагуляция и гетероадагуляция.
4. Гелеобразование. 5. Флокуляция.
Слайд 24
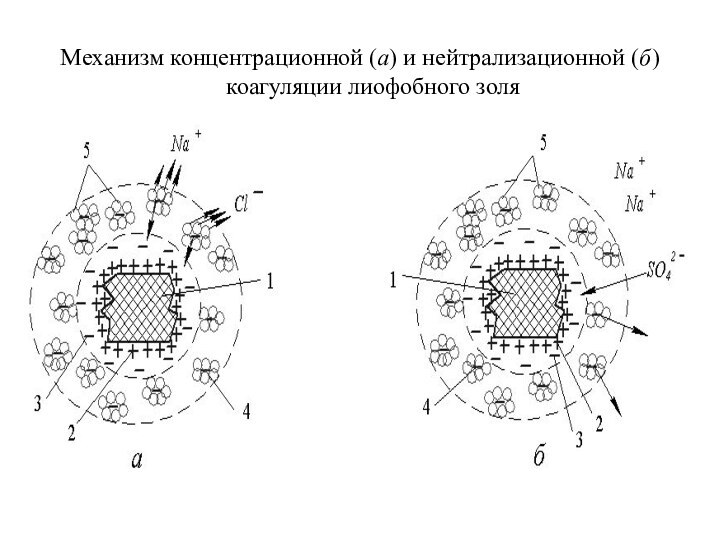
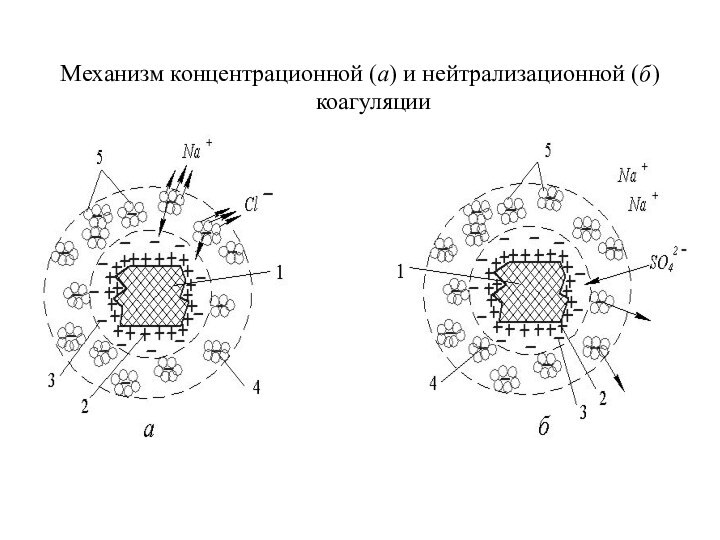
Механизм концентрационной (а) и нейтрализационной (б) коагуляции лиофобного
золя
Слайд 25
Порог коагуляции (Ск) – это минимальное количество моль-эквивалента
электролита, которое вызывает явную коагуляцию 1 л золя.
Правило Шульце-Гарди:
коагуляцию вызывает тот ион добавленного электролита, который имеет заряд, противоположный заряду гранулы; чем выше заряд коагулирующего иона, тем выше его коагулирующее действие и тем ниже порог коагуляции электролита.
Слайд 26
Механизм концентрационной (а) и нейтрализационной (б) коагуляции
Слайд 27
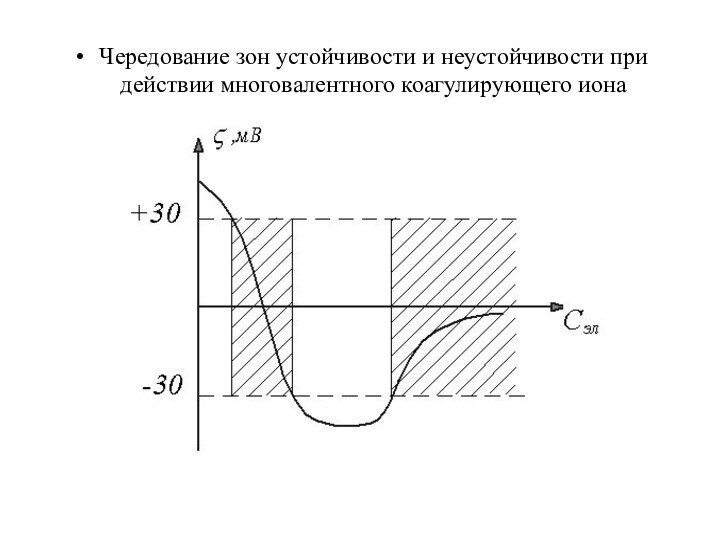
Чередование зон устойчивости и неустойчивости при действии многовалентного
коагулирующего иона
Слайд 28
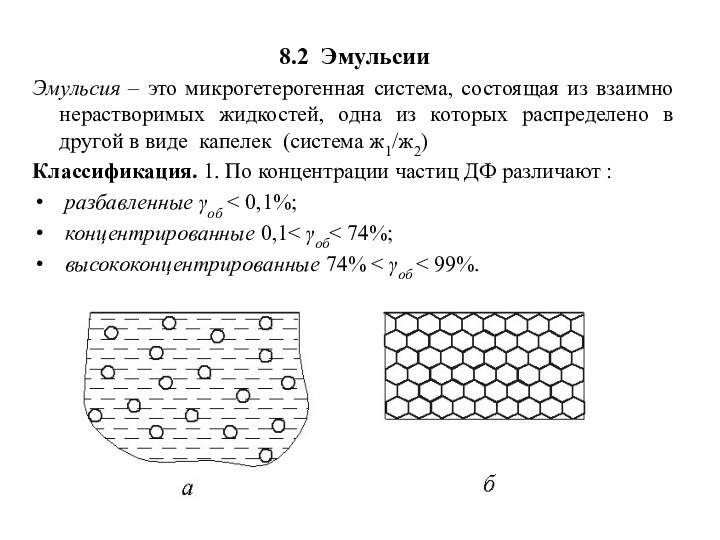
8.2 Эмульсии
Эмульсия – это микрогетерогенная система, состоящая из
взаимно нерастворимых жидкостей, одна из которых распределено в другой
в виде капелек (система ж1/ж2)
Классификация. 1. По концентрации частиц ДФ различают :
разбавленные γоб ˂ 0,1%;
концентрированные 0,1˂ γоб˂ 74%;
высококонцентрированные 74% ˂ γоб ˂ 99%.
Слайд 29
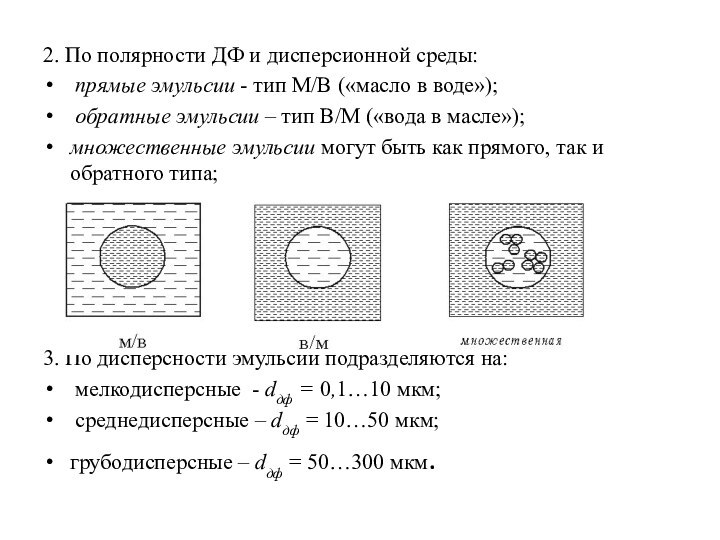
2. По полярности ДФ и дисперсионной среды:
прямые
эмульсии - тип М/В («масло в воде»);
обратные
эмульсии – тип В/М («вода в масле»);
множественные эмульсии могут быть как прямого, так и обратного типа;
3. По дисперсности эмульсии подразделяются на:
мелкодисперсные - dдф = 0,1…10 мкм;
среднедисперсные – dдф = 10…50 мкм;
грубодисперсные – dдф = 50…300 мкм.
Слайд 30
Методы определения типа эмульсии.
Метод электропроводности
Метод флуоресценции.
Метод окрашивания
Метод
разбавления.
Метод смачивания фильтровальной бумаги
Особенности свойств. 1. Молекулярно-кинетические свойства:
диффузия, броуновское
движение, седиментация.
2. Оптические свойства: ярко выраженная мутность; окраска – при поглощении компонентами определенной длины волны излучения; флуоресценция обратных эмульсий В/М при УФ облучении.
3. Электрокинетические свойства: электрофорез.
Слайд 31
Методы стабилизации. 1. Электростатический фактор создается путем адсорбции
ионогенных ПАВ или полиэлектролитов.
2. Адсорбционно-сольватный фактор создается путем
лиофилизации поверхности частиц ДФ – адсорбции ПАВ и ВМС. Действия эмульгаторов определяются правилом Банкрофта: гидрофильные эмульгаторы (ГЛБ=10…12) стабилизируют прямые эмульсии (тип м/в), а гидрофобные (ГЛБ=3…6) – обратные эмульсии (тип в/м).
3. Структурно-механический фактор создается путем применения твердых порошкообразных материалов. Гидрофильные порошки стабилизируют прямые эмульсии М/В, гидрофобные – обратные эмульсии В/М.
4. Вклад энтропийного фактора возрастает при увеличении степени дисперсности эмульсий . В обратных эмульсиях этот фактор создается еще хаотическим тепловым движением углеводородных радикалов адсорбированных ПАВ и ВМС.
Слайд 32
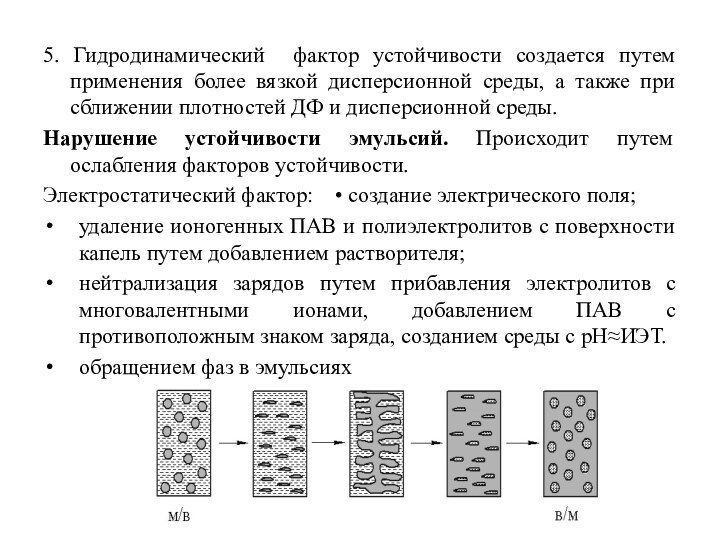
5. Гидродинамический фактор устойчивости создается путем применения более
вязкой дисперсионной среды, а также при сближении плотностей ДФ
и дисперсионной среды.
Нарушение устойчивости эмульсий. Происходит путем ослабления факторов устойчивости.
Электростатический фактор: • создание электрического поля;
удаление ионогенных ПАВ и полиэлектролитов с поверхности капель путем добавлением растворителя;
нейтрализация зарядов путем прибавления электролитов с многовалентными ионами, добавлением ПАВ с противоположным знаком заряда, созданием среды с рН≈ИЭТ.
обращением фаз в эмульсиях
Слайд 33
2. Адсорбционно-сольватный фактор:
лиофобизация поверхности путем удаления эмульгатора растворением
или химическим способом.
3. Структурно-механический фактор:
растворение полимерной пленки;
разрушение бронирующей пленки
порошкообразного материала путем перемешивания или в центробежном поле;
4. Энтропийный фактор:
укрупнение капелек из-за коалесценции при ослаблении других факторов агрегативной устойчивости;
удаление эмульгатора из поверхности обратной эмульсии.
5. Гидродинамический фактор:
повышение температуры;
снижение вязкости путем прибавления менее вязкого растворителя;
центрифугирование.
Слайд 34
8.3 Пены
Пены – грубодисперсные системы, в которых дисперсной
фазой являются пузырьки газа, а дисперсионной средой – жидкость
в виде тонких пленок (система Г/Ж).
Параметры пен. 1. Кратность пены(β)
2. Относительная доля газа в пене
3. Доля жидкости в объеме пены
4. Время существования пены - это время с момента ее образования до самопроизвольного разрушения. В некоторых случаях за время существования принимают время разрушения половины объема пены.
Слайд 35
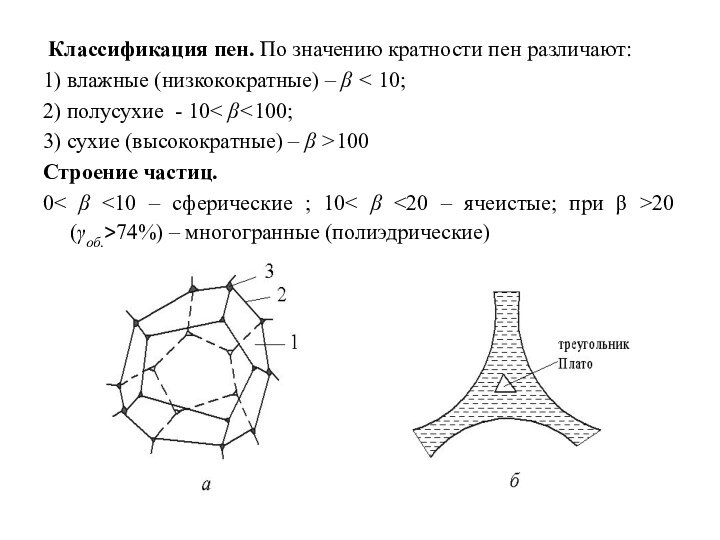
Классификация пен. По значению кратности пен различают:
1)
влажные (низкокократные) – β ˂ 10;
2) полусухие - 10˂
β˂100;
3) сухие (высокократные) – β ˃100
Строение частиц.
0˂ β ˂10 – сферические ; 10˂ β ˂20 – ячеистые; при β ˃20 (γоб.>74%) – многогранные (полиэдрические)
Слайд 36
В месте соприкосновения трех пузырьков образуются каналы (каналы
Плато-Гиббса). Место пересечения каналов, расположенное на вершине многогранника, называется
узлом.
Первое правило Плато: три пузырька, грани которых встречаются под углом 1200, образуют устойчивую систему.
Второе правило Плато: на вершинах додекаэдров сходятся четыре канала Плато-Гиббса, образуя между собой углы 109028'.
Свойства пен. 1. Молекулярно-кинетические явления могут проявиться только в низкократных пенах в виде седиментации.
2. Оптические свойства пен проявляются в результате рассеяния и поглощения света элементами структуры пен: пленками, каналами Плато-Гиббса и узлами. d > 760 нм ‒ бесцветные,
760 нм < d < 400 нм ‒ радужная, d < 400 нм ‒в отраженном свете на темном фоне кажутся черными.
3. Электрокинетические свойства: электроосмос и возникновение потенциала течения (эффект Квинке)
Слайд 37
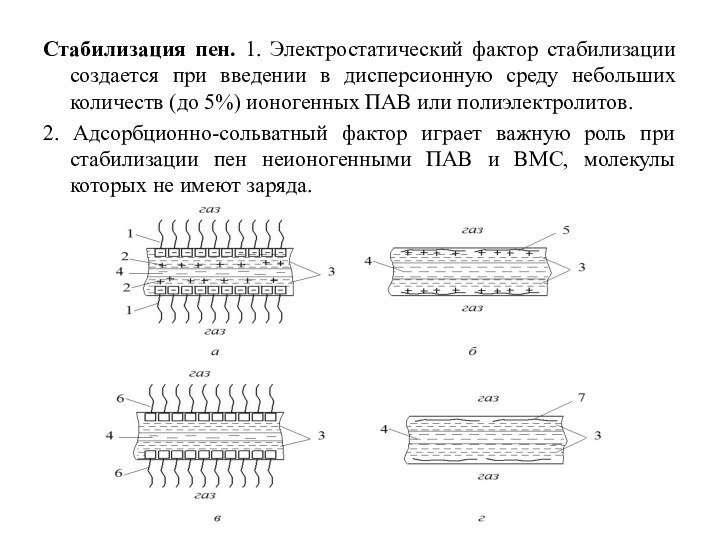
Стабилизация пен. 1. Электростатический фактор стабилизации создается при
введении в дисперсионную среду небольших количеств (до 5%) ионогенных
ПАВ или полиэлектролитов.
2. Адсорбционно-сольватный фактор играет важную роль при стабилизации пен неионогенными ПАВ и ВМС, молекулы которых не имеют заряда.
Слайд 38
3. Структурно-механически фактор: пленки из адсорбированных ПАВ и
ВМС, проведение реакции полимеризации в пленке.
4. Энтропийный фактор стабилизации
создают углеводородные радикалы противоположных поверхностей, если дисперсионная среда является неполярной жидкостью.
5. Гидродинамический фактор устойчивости создают путем введения в состав пены специальных загустителей. Они увеличивают вязкость дисперсионной среды и снижают скорость вытекания жидкости из пленок в каналы.
Разрушение пен. 1. Химические методы основаны на применении пеногасителей, которые реагируют с пенообразователем и разрушают пленку, разделяющую газовые пузырьки.
2. Физические методы основаны на физическом воздействии на пены (термический, акустический, электрический, барометрич.)
3. Механические методы .
Предотвращение образования пены.
Слайд 39
8.4 Аэрозоли
Аэрозоли (от греч. aer – воздух и
лат. sol(utio) – раствор) – дисперсные системы с газовой
дисперсионной средой и жидкой или твердой ДФ ( системы Ж/Г, Т/Г, (Ж+Т)/Г ) .
Классификация. 1. По методу получения: диспергационные и конденсационные.
2. По агрегатному состоянию ДФ: туман (Ж/Г), дым (Т/Г), смог (Т+Ж)/Г.
3. По размеру частиц ДФ:
- в системе Ж/Г – 10-7…10-5 м (туман);
в системе Т/Г - 10-9…10-5 м (дым), d > 10-5м (пыль).
Характеристика частиц. В системе Ж/Г – сферические. В системе Т/Г полидисперсные, формы частиц:
изометричные (куб, шар, многогранники);
два размера больше третьего (диск, чешуйки, лепестки);
- один размер больше двух других (нити, палочкобразные)
Слайд 40
Особенности свойств. 1 Молекулярно-кинетические свойства: диффузиофорез, термофорез, фотофорез
и седиментация.
2. Оптические свойства: характерно поглощение и рассеяние света
3.
Электрокинетические свойства: электрофорез.
Факторы стабилизации. Единственным фактором стабилизации является энтропийный фактор.
Разрушение аэрозолей. 1. Инерционное осаждение в циклонах.
2. Инерционное осаждение на каплях и пленках жидкости.
3. Фильтрование.
4. Электростатическое осаждение.
5. Конденсационный метод
Слайд 41
8.5 Суспензии
Суспензия – это дисперсная система, в которой
ДФ представлена частицами твердого вещества размерами более 1 мкм,
а дисперсионная среда является жидким (система Т/Ж).
Классификация. 1. По природе дисперсионной среды:
- органосуспезии, в которых дисперсионной средой является органическая жидкость;
- водные суспензии (дисперсионная среда – вода).
2. По концентрации ДС:
- разбавленные суспензии – взвеси;
- концентрированные суспензии – пасты.
3. По размеру частиц ДФ:
- муть (1 …10 мкм);
- тонкие суспензии (10…100 мкм);
- грубые суспензии (> 100 мкм).
Слайд 42
Строение частицы ДФ. Формы частиц: изометрические, пластинки, волокна.
На
поверхности частиц ДФ имеется ДЭС, подобный слою в мицеллах
лиофобных коллоидов. Сольватная оболочка толще на плоских гранях и тоньше на ребрах и вершинах.
Особенности свойств. 1. Молекулярно кинетические свойства: наиболее характерна седиментация, диффузия и броуновское движение – при размерах частиц 1-10 мкм.
2. Оптические свойства обусловлены отражением и поглощением света. Рассеивает свет только муть.
3. Проявляются все 4 вида электрокинетических явлений.
Слайд 43
Стабилизация суспензий. 1. Вклад электростатического фактора увеличивается при
удалении примеси электролитов из дисперсионной среды и если ионы
диффузного слоя однозарядны . Адсорбция ионогенных ПАВ и полиэлектролитов
2. Адсорбционно-сольватный фактор создается лиофилизацией поверхности путем добавления ПАВ и ВМС.
3. Структурно-механический фактор создают пленки адсорбированных молекул ПАВ и ВМС.
4. Энтропийный фактор. Более устойчивы высокодисперсные суспензии.
5. Гидродинамический фактор создается путем применения более вязкой дисперсионной среды или путем введения загустителей.