Слайд 2
Строение, свойства и функции белков
В живых клетках главную
роль играют полимерные макромолекулы - белки, нуклеиновые кислоты, полисахариды.
Синтезированные
белки выполняют многообразные функции:
ускоряют химические реакции,
выполняют транспортную,
структурную,
защитную функции,
участвуют в передаче сигналов от одних клеток другим
и таким образом реализуют наследственную информацию. Поэтому белки называют также протеинами (от греч. proteos - первый).
Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью .
Пептид – соединение, в котором количество аминокислотных остатков не превышает 10.
Полипептид – если в соединении содержится от 10 до 40 АК остатков.
Белок - более 40 АК остатков.
Слайд 3
Белки
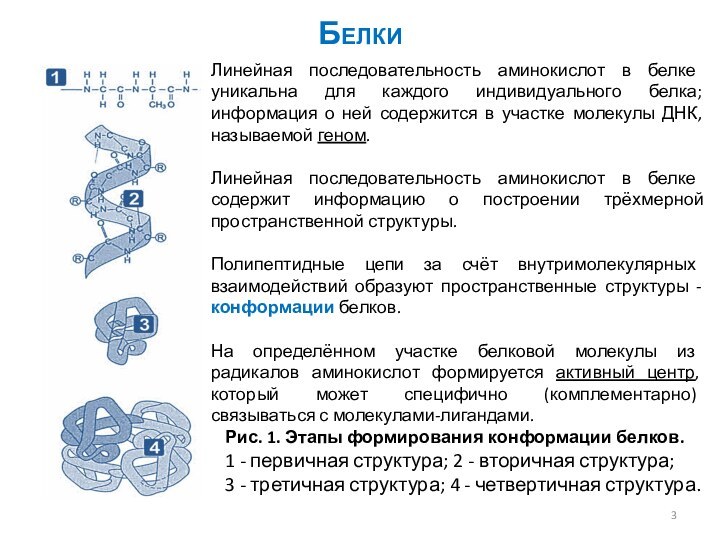
Рис. 1. Этапы формирования конформации белков.
1 -
первичная структура; 2 - вторичная структура;
3 - третичная
структура; 4 - четвертичная структура.
Линейная последовательность аминокислот в белке уникальна для каждого индивидуального белка; информация о ней содержится в участке молекулы ДНК, называемой геном.
Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры.
Полипептидные цепи за счёт внутримолекулярных взаимодействий образуют пространственные структуры - конформации белков.
На определённом участке белковой молекулы из радикалов аминокислот формируется активный центр, который может специфично (комплементарно) связываться с молекулами-лигандами.
Слайд 4
Биосинтез белков (трансляция)
Трансляция - перевод информации, заключённой в
полинуклеотидной последовательности мРНК, в аминокислотную последовательность белка.
А. Генетический
код и его свойства
Генетический, биологический, нуклеотидный, или аминокислотный код - своеобразный "словарь", позволяющий выяснить, какая последовательность нуклеотидов мРНК обеспечивает включение в белок аминокислот в заданной последовательности.
Слайд 5
Свойства генетического кода
Триплетность
Число кодирующих последовательностей из четырёх нуклеотидов
по три равно 43 = 64.
Кодоны - кодирующими элементами при
шифровании аминокислотной последовательности являются тройки нуклеотидов (триплеты).
61 триплет шифрует включение аминокислот в синтезирующуюся полипептидную цепь, а 3 остальных - UAA, UAG, UGA* - сигнализируют о завершении трансляции (терминирующие, или стоп-кодоны).
Специфичность
Каждому кодону соответствует только одна определённая аминокислота. В этом смысле генетический код строго однозначен.
*Примечания: U - урацил; А - аденин; G - гуанин.
Слайд 6
Вырожденность
В информационных молекулах включение в белок одной и
той же аминокислоты определяют несколько кодонов.
Линейность записи информации
Универсальность
Смысл
кодовых слов одинаков для всех изученных организмов, но митохондриальная мРНК содержит 4 триплета, имеющих другое значение, чем в мРНК ядерного происхождения. Так, в мРНК митохондрий триплет UGA кодирует Три, AUA - Мет, а АСА и AGG прочитываются как дополнительные стоп-кодоны.
Колинеарность гена и продукта
У прокариотов обнаружено линейное соответствие последовательности кодонов гена и последовательности аминокислот в белковом продукте.
В эукариотических клетках аминокислотная последовательность белка колинеарна последовательности экзонов в гене или зрелой мРНК после посттранскригщионного удаления интронов.
Свойства генетического кода
Слайд 7
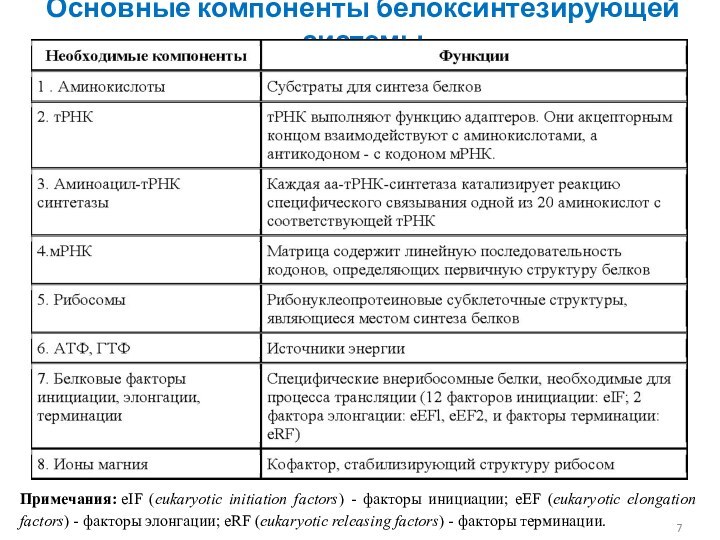
Основные компоненты белоксинтезирующей системы
Примечания: eIF (eukaryotic initiation factors) -
факторы инициации; eEF (eukaryotic elongation factors) - факторы элонгации;
eRF (eukaryotic releasing factors) - факторы терминации.
Слайд 8
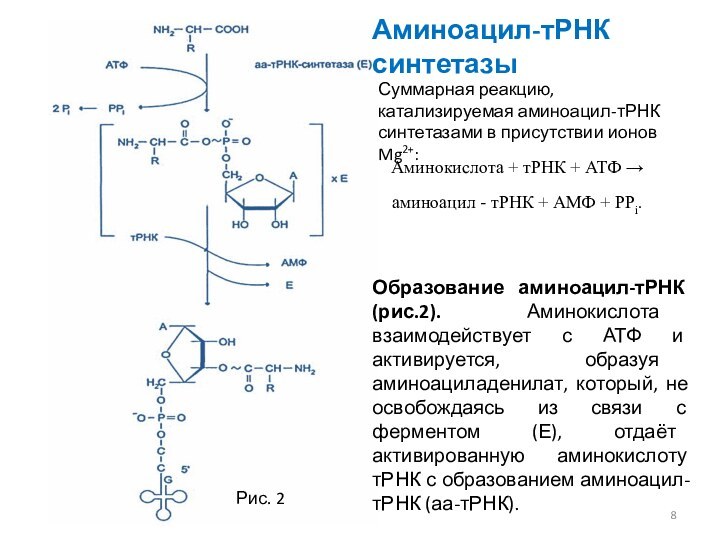
Образование аминоацил-тРНК (рис.2). Аминокислота взаимодействует с АТФ и
активируется, образуя аминоациладенилат, который, не освобождаясь из связи с
ферментом (Е), отдаёт активированную аминокислоту тРНК с образованием аминоацил-тРНК (аа-тРНК).
Аминокислота + тРНК + АТФ →
аминоацил - тРНК + АМФ + PPi.
Суммарная реакцию, катализируемая аминоацил-тРНК синтетазами в присутствии ионов Mg2+:
Рис. 2
Аминоацил-тРНК синтетазы
Слайд 9
Рибосомы
Рибосомы представляют собой рибонуклеопротеиновые образования. На рибосомах идёт
сборка аминокислот в белки.
Белки, входящие в состав субъединиц
рибосомы в количестве одной копии выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом.
Центр А (аминоацильный) связывает аа-тРНК, строение которой определяет кодон, находящийся в области этого центра. В структуре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь.
Центр Р (пептидильный) занимает пептидил-тРНК, т.е. тРНК, связанная с пептидной цепочкой, которая уже синтезирована.
Слайд 10
Белковые факторы
В каждой стадии белкового синтеза на рибосоме:
инициации, элонгации и терминации участвует разный набор внерибосомных белковых
факторов.
Эти белки связываются с рибосомой или её субъединицами на определённых стадиях процесса и
стабилизируют или
облегчают
функционирование белоксинтезирующей машины.
Специфические внерибосомные белки, необходимые для процесса трансляции (12 факторов инициации: eIF; 2 фактора элонгации: eEFl, eEF2, и факторы терминации: eRF)
Слайд 11
АТФ и ГТФ как источники энергии
На включение одной
аминокислоты в растущую полипептидную цепь клетка затрачивает 4 макроэргические
связи:
2 из АТФ в ходе реакции, катализируемой аа-тРНК синтетазой (в процессе активации аминокислот АТФ расщепляется на АМФ и пирофосфат)
2 молекулы ГТФ: одна используется на связывание аа-тРНК в А-центре рибосомы, а вторая затрачивается на стадию транслокации.
2 макроэргические связи молекул АТФ и ГТФ используются на инициацию и терминацию синтеза полипептидной цепи.
Слайд 12
Синтез полипептидной цепи на рибосоме
В ходе синтеза белка
прочтение информации мРНК идёт в направлении от 5'- к
З'-концу, обеспечивая синтез пептида от N- к С-концу.
Эукариотические мРНК кодируют строение только одной полипептидной цепи (т.е. они моноцистронны)
Прокариотические мРНК часто содержат информацию о нескольких пептидах (т.е. они полицистронны).
На полицистронных мРНК синтез белка начинается до того, как заканчивается их собственный синтез.
У эукариотов трансляция протекает в цитоплазме, куда из ядра поступают уже "зрелые" мРНК.
Слайд 13
События на рибосоме включают этапы: инициация, элонгация и
терминация.
Инициация
тРНКiМет -инициирующая метиониновая тРНК ;
eIF (от англ. eukaryotic initiation
factors) - факторы инициации;
Кэпсвязывающий белок - один из факторов инициации (eIF-4F), который узнаёт и присоединяется к участку "кэп" на молекуле мРНК;
Слайд 14
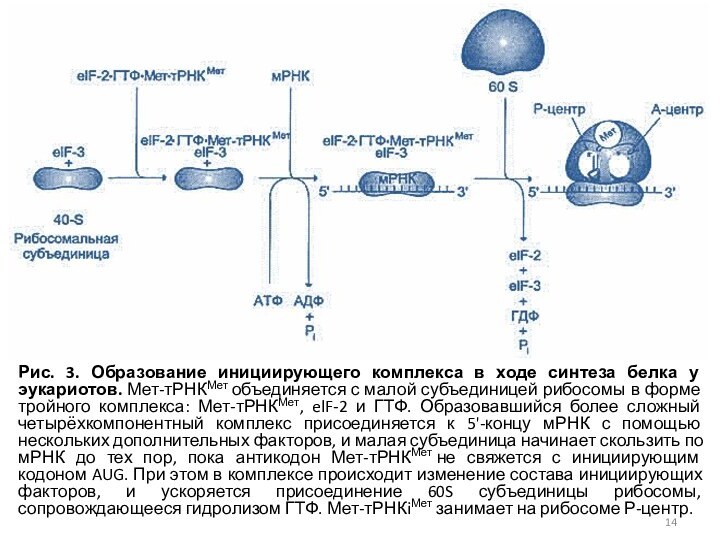
Рис. 3. Образование инициирующего комплекса в ходе синтеза
белка у эукариотов. Мет-тРНКМет объединяется с малой субъединицей рибосомы в
форме тройного комплекса: Мет-тРНКМет, elF-2 и ГТФ. Образовавшийся более сложный четырёхкомпонентный комплекс присоединяется к 5'-концу мРНК с помощью нескольких дополнительных факторов, и малая субъединица начинает скользить по мРНК до тех пор, пока антикодон Мет-тРНКМет не свяжется с инициирующим кодоном AUG. При этом в комплексе происходит изменение состава инициирующих факторов, и ускоряется присоединение 60S субъединицы рибосомы, сопровождающееся гидролизом ГТФ. Мет-тРНКiМет занимает на рибосоме Р-центр.
Слайд 15
2. Элонгация
это процесс, в ходе которого рибосома с
помощью аа-тРНК последовательно "читает" мРНК в виде триплетов нуклеотидов,
следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот.
Включение каждой аминокислоты в белок происходит в 3 стадии, в ходе которых:
аа-тРНК каждой входящей в белок аминокислоты связывается с А-центром рибосомы;
пептид от пептидил-тРНК, находящейся в Р-центре, присоединяется к α-NH2-гpyппe аминоацильного остатка
аа-тРНК А-центра с образованием новой пептидной связи;
удлинённая на один аминокислотный остаток пептидил-тРНК перемещается из А-центра в Р-центр в результате транслокации рибосомы.
Слайд 16
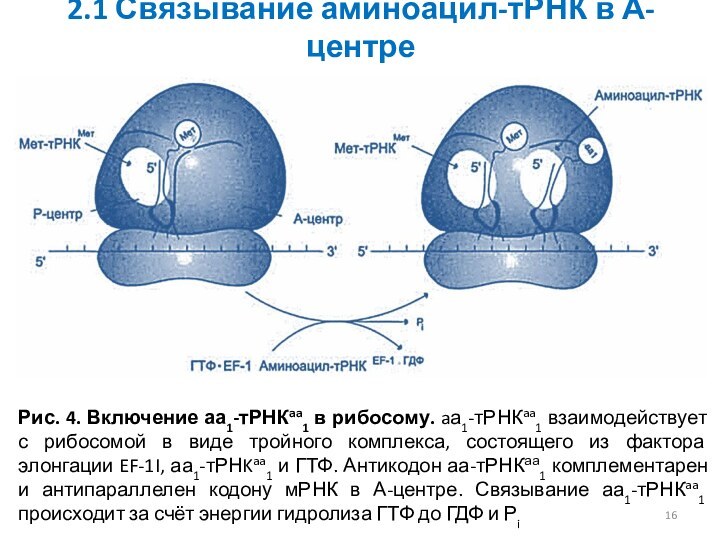
2.1 Связывание аминоацил-тРНК в А-центре
Рис. 4. Включение аа1-тРНКaa1
в рибосому. aа1-тРНКaa1 взаимодействует с рибосомой в виде тройного
комплекса, состоящего из фактора элонгации EF-1I, аа1-тРНKaa1 и ГТФ. Антикодон аа-тРНКаа1 комплементарен и антипараллелен кодону мРНК в А-центре. Связывание аа1-тРНКaa1 происходит за счёт энергии гидролиза ГТФ до ГДФ и Рi
Слайд 17
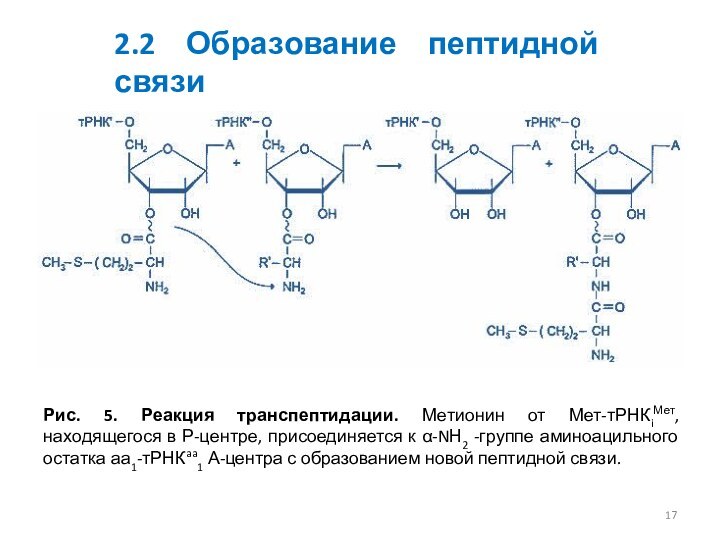
Рис. 5. Реакция транспептидации. Метионин от Мет-тРНКiМет, находящегося
в Р-центре, присоединяется к α-NН2 -группе аминоацильного остатка аа1-тРНКaa1
А-центра с образованием новой пептидной связи.
2.2 Образование пептидной связи
Слайд 18
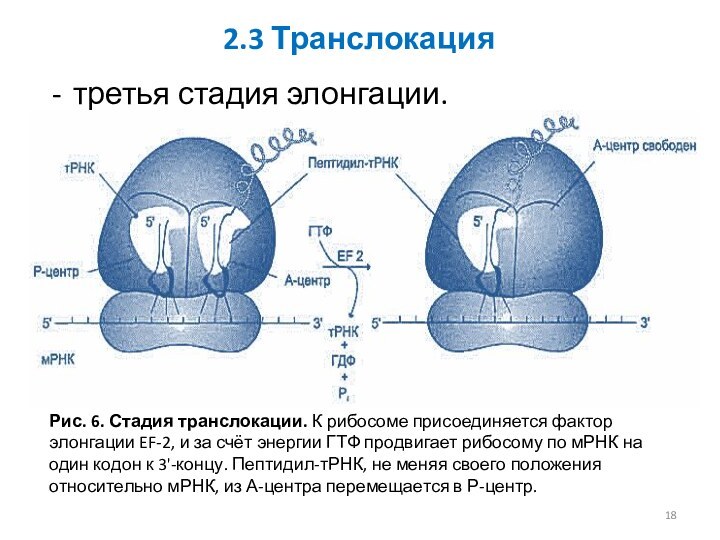
2.3 Транслокация
третья стадия элонгации.
Рис. 6. Стадия транслокации. К рибосоме
присоединяется фактор элонгации EF-2, и за счёт энергии ГТФ
продвигает рибосому по мРНК на один кодон к 3'-концу. Пептидил-тРНК, не меняя своего положения относительно мРНК, из А-центра перемещается в Р-центр.
Слайд 19
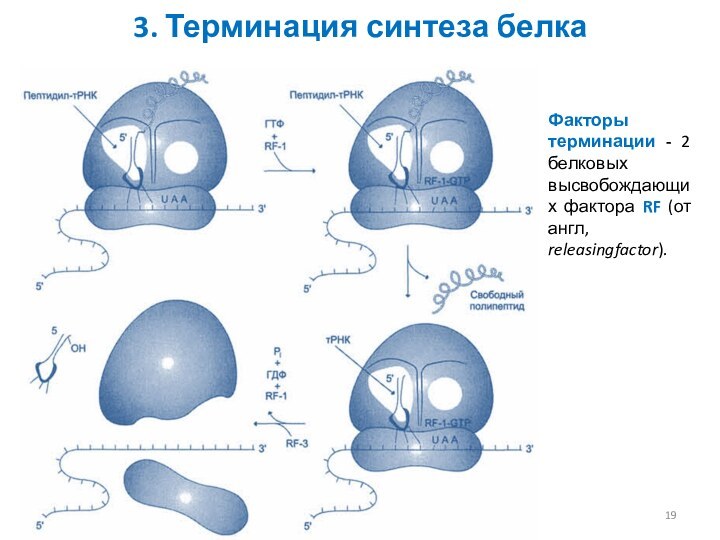
3. Терминация синтеза белка
Факторы терминации - 2 белковых
высвобождающих фактора RF (от англ, releasingfactor).
Слайд 20
Таким образом, матричная природа процесса трансляции проявляется в
том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза
белка строго детерминирована мРНК.
Малая и большая субъединицы рибосомы в процессе трансляции выполняют разные функции:
малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации,
большая субъединица ответственна за образование пептидных связей.
Как правило, много рибосом одновременно участвует в синтезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой, или полисомой, что значительно увеличивает эффективность использования матрицы.
Слайд 21
Посттрансляционные модификации полипептидной цепи
Посттрансляционные изменения - конформационные и
структурные изменения полипептидных цепей.
Полипептидные цепи могут подвергаться структурным модификациям
будучи ещё связанными с рибосомами,
после завершения синтеза.
Посттрансляционные изменения:
удаление части полипептидной цепи,
ковалентное присоединение одного или нескольких низкомолекулярных лигандов,
приобретение белком нативной конформации.
В ЭР происходят фолдинг полипептидных цепей и формирование уникальной третичной или четвертичной структуры белков.
Для поддержания нативной конформации молекул огромное значение имеет правильное формирование дисульфидных связей.
Слайд 22
Частичный протеолиз
Молекулы-предшественники - функционально неактивные молекулы многих белков,
первоначально секретируемые из клеток .
К образованию активных молекул приводит
удаление части полипептидной цепи специфическими эндопротеазами.
Некоторые белки-предшественники расщепляются в ЭР или аппарате Гольджи, другие - после секреции.
Слайд 23
Ковалентные модификации
Активирование или инактивирование структурных белков и ферментов

может происходить в результате присоединения различных химических групп:
фосфатных,
ацильных,
метальных,
олигосахаридных
и некоторых других.
Фосфорилирование белков осуществляется по гидроксильным группам серина, треонина и, реже, тирозина ферментами из группы протеинкиназ, тогда как дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы.
Гликозилирование. Белки, входящие в состав плазматических мембран или секретирующиеся из клеток, подвергаются гликозилированию. Углеводные цепи присоединяются по гидроксильным группам серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и аппарате Гольджи.
Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот: в тиреоглобулине йодируются остатки тирозина; в факторах свёртывания крови карбоксилируются остатки глутамата; в ЭР фибробластов гидроксилируются остатки пролина и лизина в цепях тропоколлагена.
Слайд 24
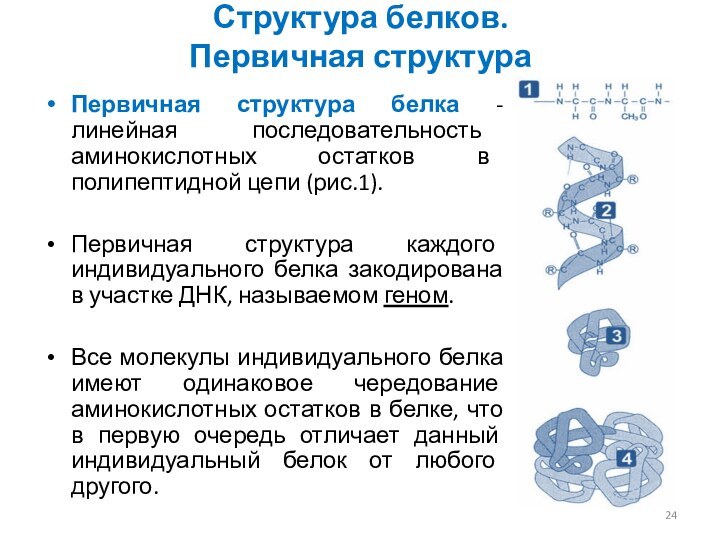
Структура белков.
Первичная структура
Первичная структура белка - линейная последовательность
аминокислотных остатков в полипептидной цепи (рис.1).
Первичная структура каждого индивидуального
белка закодирована в участке ДНК, называемом геном.
Все молекулы индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Слайд 25
Конформация белков
Конформация - определённая пространственная трёхмерная структура, которую
приобретают линейные полипептидные цепи индивидуальных белков за счёт взаимодействия
функциональных групп аминокислот.
Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию.
Вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа конформации полипептидных цепей:
вторичную структуру
третичную структуру.
Слайд 26
Вторичная структура белков
Вторичная структура белков - пространственная структура,
образующаяся в результате взаимодействий между функциональными группами, входящими в
состав пептидного остова.
Пептидные цепи могут приобретать регулярные структуры двух типов:
α-спираль и
β-структура.
Слайд 27
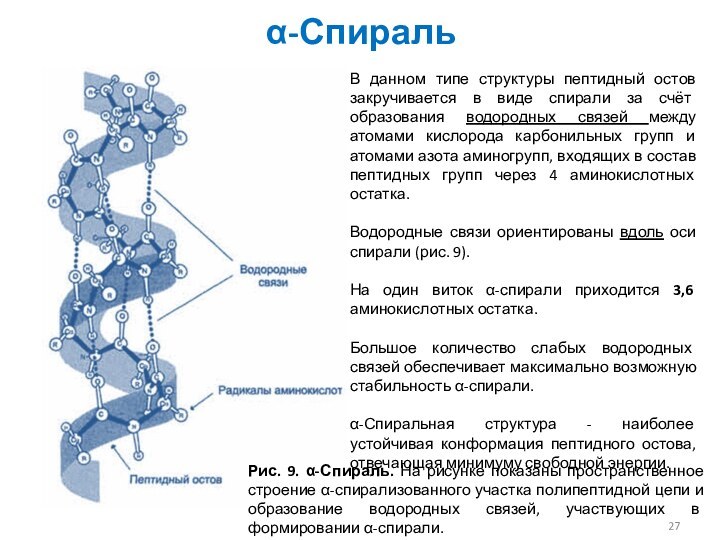
α-Спираль
Рис. 9. α-Спираль. На рисунке показаны пространственное строение
α-спирализованного участка полипептидной цепи и образование водородных связей, участвующих
в формировании α-спирали.
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка.
Водородные связи ориентированы вдоль оси спирали (рис. 9).
На один виток α-спирали приходится 3,6 аминокислотных остатка.
Большое количество слабых водородных связей обеспечивает максимально возможную стабильность α-спирали.
α-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии.
Слайд 28
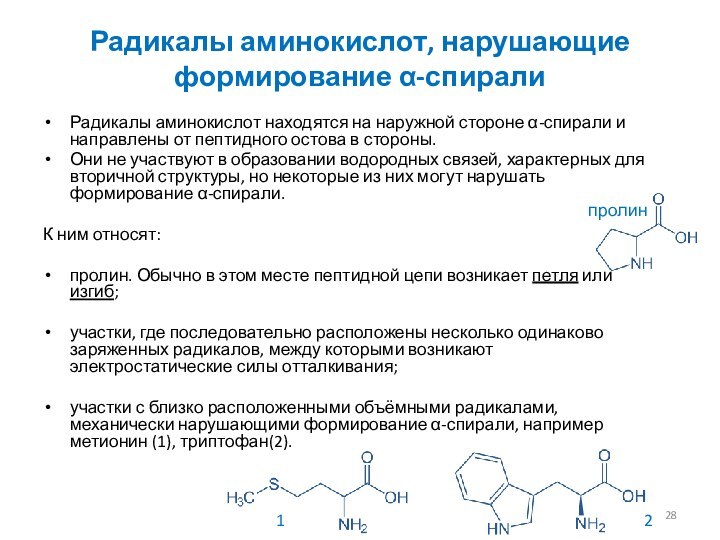
Радикалы аминокислот, нарушающие формирование α-спирали
Радикалы аминокислот находятся на
наружной стороне α-спирали и направлены от пептидного остова в
стороны.
Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование α-спирали.
К ним относят:
пролин. Обычно в этом месте пептидной цепи возникает петля или изгиб;
участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
участки с близко расположенными объёмными радикалами, механически нарушающими формирование α-спирали, например метионин (1), триптофан(2).
1
2
пролин
Слайд 29
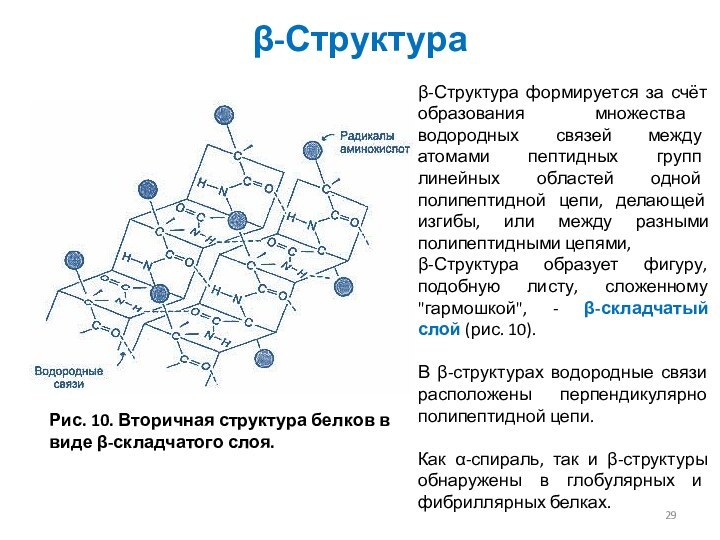
β-Структура
Рис. 10. Вторичная структура белков в виде β-складчатого
слоя.
β-Структура формируется за счёт образования множества водородных связей между
атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями,
β-Структура образует фигуру, подобную листу, сложенному "гармошкой", - β-складчатый слой (рис. 10).
В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Как α-спираль, так и β-структуры обнаружены в глобулярных и фибриллярных белках.
Слайд 30
Нерегулярные вторичные структуры
Беспорядочные клубки - области в белках
с нерегулярной вторичной структурой.
Они представлены
петлеобразными и
кольцеобразными
структурами,
имеющими меньшую регулярность укладки, чем α-спираль и β-структура.
В каждом индивидуальном белке они имеют свою фиксированную конформацию, определяемую аминокислотным составом данного участка цепи и окружающих его участков.
Слайд 31
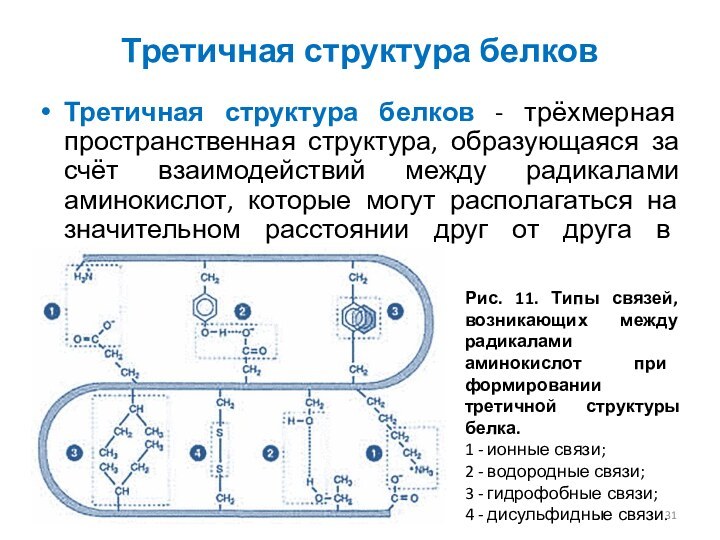
Третичная структура белков
Третичная структура белков - трёхмерная пространственная
структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые
могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Рис. 11. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка.
1 - ионные связи;
2 - водородные связи;
3 - гидрофобные связи;
4 - дисульфидные связи.
Слайд 32
Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и
водородные связи относят к числу слабых.
Поддержание характерной для белка
конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей.
Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами.
При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке.
Слайд 33
Денатурация белков
Денатурация белков - разрыв большого количества слабых
связей в молекуле белка с потерей нативной конформации и
утратой специфической функции.
При денатурации белков первичная структура белка не нарушается.
При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы денатурированного белка могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка.
Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами.
Слайд 34
Факторы, вызывающие денатурацию белков
Денатурацию белков вызывают факторы, способствующие
разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
высокая
температура (более 50 °С);
интенсивное встряхивание раствора;
органические вещества (например, этиловый спирт, фенол и его производные);
кислоты и щелочи;
соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.);
детергенты - вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными). К наиболее известным детергентам относят различные мыла (рис. 12).
Рис. 12. Денатурация белков с помощью детергентов.
Слайд 35
Полиморфизм белков
Полиморфизм белков — существование разных форм
белка, выполняющих одинаковые или очень сходные функции (изобелки).
Изобелки -
множественные формы белка, обнаруживаемые в организмах одного вида. Белки, выполняющие одинаковые функции в организмах разных биологических видов, носят название "гомологичные белки".
Многие ферменты имеют несколько изоформ и носят название изоферментов.
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Слайд 36
Изоферменты
— это ферменты, синтез которых кодируется разными генами,
у них разная первичная структура и разные свойства, но
они катализируют одну и ту же реакцию.
Виды изоферментов:
Органные — ферменты гликолиза в печени и мышцах.
Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются разными аллелями одного и того же гена.
Слайд 37
Ферменты: катализаторы и регуляторы
Ферменты — это белки, обладающие
специфическими каталитическими свойствами, то есть каждый фермент катализирует одну
или несколько сходных реакций.
Субстраты – молекулы, которые присоединяются к ферменту и изменяются в результате реакции.
Активный центр - часть молекулы фермента, которая обеспечивает связывание субстрата и катализ.
Слайд 38
Общие свойства катализаторов и ферментов
Сами не вызывают
химическую реакцию, а только ускоряют реакцию, которая протекает и
без них;
Не влияют на энергетический итог реакции;
В обратимых реакциях ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени.
Общие свойства ферментов
Высокая эффективность действия — ускоряют реакцию в 108–1012 раз;
Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия);
Высокая чувствительность к неспецифическим физико-химическим факторам среды — температуре, рН, ионной силе раствора;
Высокая чувствительность к химическим реагентам;
Высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу (активаторы и ингибиторы).