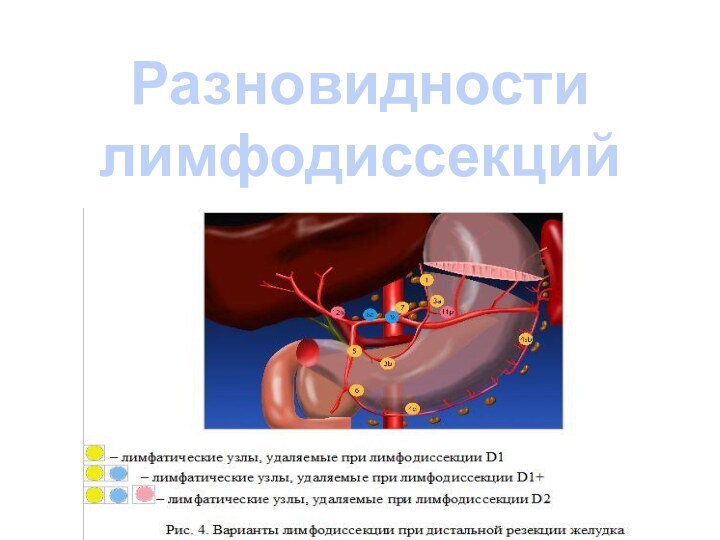
Слайд 2
Особенности лимфатической системы желудка
1. Богата сплетениями - подслизистое,
интрамуральное и серозно-подсерозное.
2. Сложна. Различные области желудка взаимосвязаны.
3. Является
основным путем метастазирования при раке желудка.
4. Лимфатические сосуды желудка имеют многочисленные связи с ЛУ пищевода, ДПК, поперечной ободочной кишки и большого сальника.
Слайд 3
Sappey (1874) и Rouvier (1932), разделили поверхность желудка
на территории, связанные с ЛУ, располагающимися вдоль сосудов
Территория венечной
артерии. Собирает лимфу из медиальных двух третей вертикальной части и сегмента горизонтальной части желудка
1. Париетальные ЛУ 2. ЛУ, размещенные вокруг кардиальной части желудка: внутренние, наружные и задние кардиальные. 3. ЛУ малой кривизны желудка, расположенные по ходу венечной артерии. 4. ЛУ серпа венечной артерии. 5. Чревные ЛУ, расположенные вокруг чревного ствола.
Слайд 4
2. Территория селезеночной артерии. собирающие лимфу слева и
выше от венечной, от дна до середины большой кривизны
желудка.
6. ЛУ желудочно-селезеночной связки 7. ЛУ поджелудочно-селезеночной связки 8. ЛУ ворот селезенки 9. ЛУ левой желудочно-сальниковой артерии;
10. Надподжелудочные (супрапанкреатические) ЛУ.
Пути лимфооттока по Сапей-Ревьеру
Слайд 5
3. Территория печеночной артерии
11. ЛУ, вокруг правой желудочно-сальниковой
артерии 12. Интрапилорические; 13. Позадипилорические ЛУ по ходу гастродуоденальной
артерии. 14. ЛУ вдоль горизонтальной порции общей печеночной артерии 15. ЛУ около вертикальной части собственно печеночной артерии 16. Надпилорические ЛУ (не постоянны) 17. Передняя панкреатодуоденальная группа ЛУ на передней поверхности ПЖ 18. Позадидуоденальная группа ЛУ
Пути лимфооттока по Сапей-Ревьеру
Слайд 6
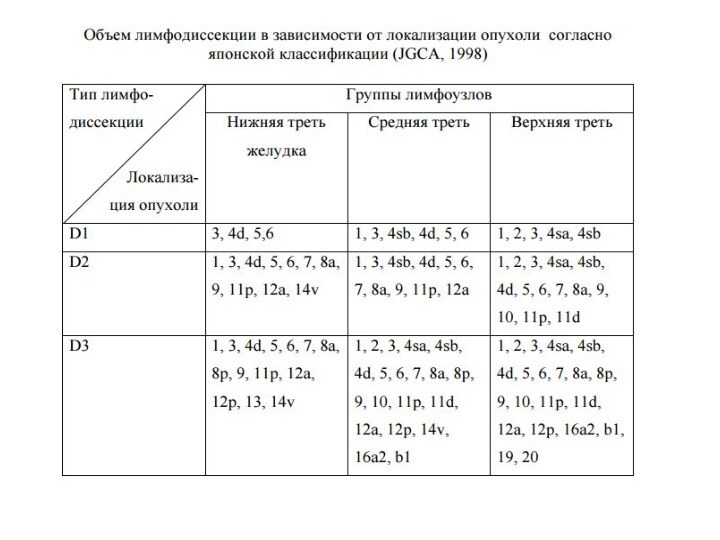
Наиболее популярные классификации рака желудка
Классификация Международного противоракового комитета
(UICC) /TNM (1997, 2010)
Простая, доступная, легко воспроизводимая
Классификация Японской
Ассоциации по изучению рака желудка (JGCA) (1998, 2010)
взаимосвязана с проводимым лечением, объемом лимфодиссекции.
Слайд 7
Классификация UICC/TNM (1997)
Категория N - количественная (числовая) интерпретация:
N1
– поражение 1—6 ЛУ;
N2 - поражение 7—15 ЛУ;
N3—наличие метастазов
в 16 и регионарных ЛУ
К IV стадии относили всех пациентов с N3 независимо от глубины инвазии
Слайд 8
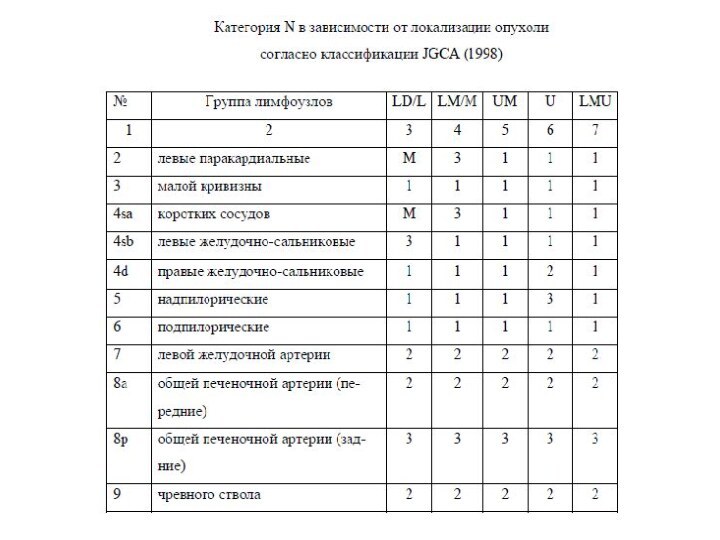
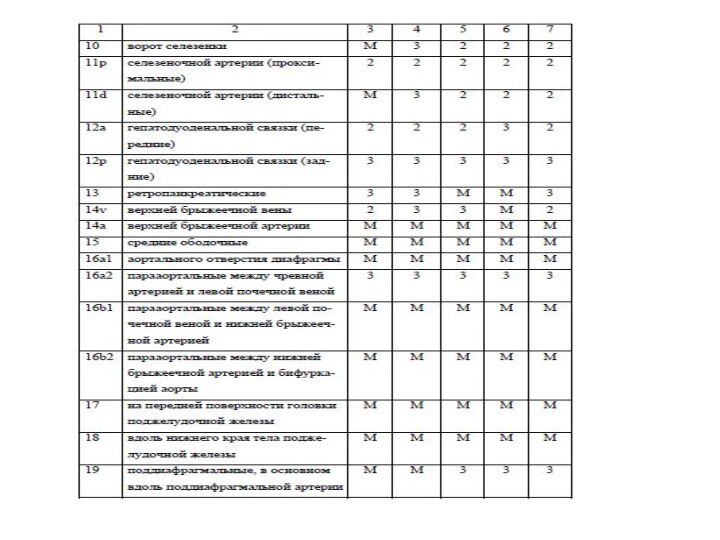
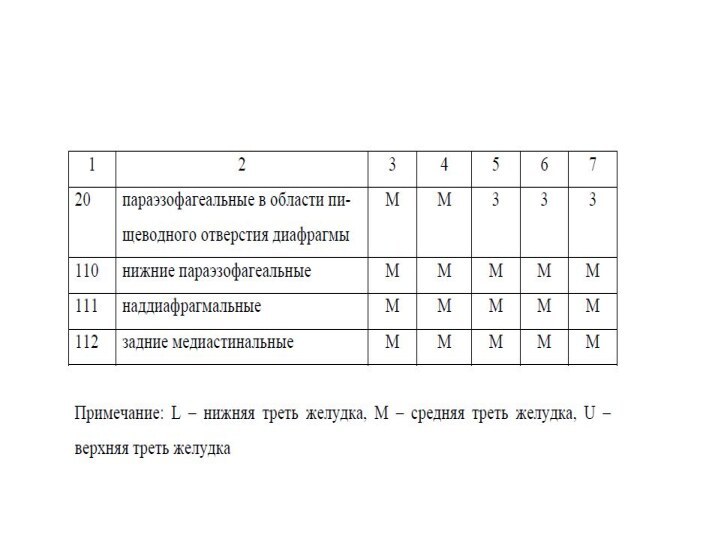
Согласно Японской ассоциации по изучению рака желудка (JGGA,
1998, Japanese Gastric Cancer Association. Japanese classification of gastric
carcinoma: 2nd English edition, 1998) лимфатические коллекторы разделены на 16 групп регионарных ЛУ, формирующих 3 последовательных этапа метастазирования опухоли от различных отделов желудка.
1 этап (N 1) – перигастральные связочные ЛУ №1-6.
2 этап (N 2)- ЛУ по ходу чревного ствола и его ветвей - №7-11
3 этап (N 3) - забрюшинные ЛУ №12 – гепатодуоденальной связки, №13 – ретропанкреатодуоденальные, №14 – вокруг верхних брыжеечных сосудов, №15 – вокруг средних ободочных сосудов, №16 – парааортальные.
Парааортальные разделены на 4 группы
Слайд 9
JGCA 1998
ВАЖНО:
Принципиальное отличие от международной (UICC/TNM) в том,
что в японской классификации центральное значение имеет локализация пораженных
ЛУ и их удаленность от первичного очага.
В международной центральное значение приобрело количество пораженных ЛУ
Слайд 13
Недостатки классификации JGCA:
Сложна в применении на практике, прежде
всего, в странах с низким уровнем РЖ
Во многих исследованиях
показано преимущество количественного подхода в связи с его простотой, легкостью воспроизведения и большей прогностической значимостью
1. Adachi Y., Kamakura T.et al. Prognostic significance of the number of positive nodes in gastric carcinoma//Br. J. Surg.—1994.—Vol. 81.—P. 414–416.
2. Kunisaki C. et al. Comparative evaluation of gastric carcinoma staging: Japanese classification versus new American joint committee on cancer/Ann. Surg. Oncol.—2004.—Vol. 11.—P. 203–206.
Слайд 14
Объединение классификаций
В 2009-2010 гг. выпущены 7-я редакция классификации
UICC/TNM и 14-я редакция JGCA, в которых разногласия были
устранены.
Основные положения:
Рак желудка - опухоли, эпицентр которых расположен в желудке на расстоянии 5 см от пищеводно-желудочного перехода или в пределах 5 см без перехода на пищевод
Опухоли, в области пищеводно-желудочного перехода, и опухоли с переходом на пищевод, независимо от их патоморфологической структуры, исключены из классификации РЖ и стадируются по системе TNM как опухоли пищевода.
1. Japanese classification of gastric carcinoma: 3rd English edition // Gastric Cancer.—2011.—Vol. 14.— P. 101–112
Слайд 15
ВАЖНО:
Комитет JGCA категорически отверг определение кардиоэзофагеального рака, предложенное
UICC/TNM, и настоял на том, чтобы аденокарциномы кардиального отдела
желудка (Siewert type 3) рассматривались с позиций классификации и стандартов лечения РЖ, а не рака пищевода, как предлагает UICC/TNM
Слайд 16
7-я редакция классификации UICC/TNM и 14-я редакция JGCA
(2009-2010)
Основные положения:
Т3 - инфильтрация опухолью всех слоев стенки до
субсерозного слоя
Категория N перестала быть качественным показателем, а приняла исключительно количественное значение
N1 – поражение 1–2 ЛУ; (ранее – 1-6)
N2 – поражение 3–6 ЛУ; (ранее – 7–15)
N3a—7-15, N3b—16- 30, N3c—31 и более пораженных метастазами ЛУ
Количество пораженных ЛУ не является основанием для диагностики IV стадии заболевания
К регионарным ЛУ отнесены узлы 1-12 и 14v групп
Слайд 17
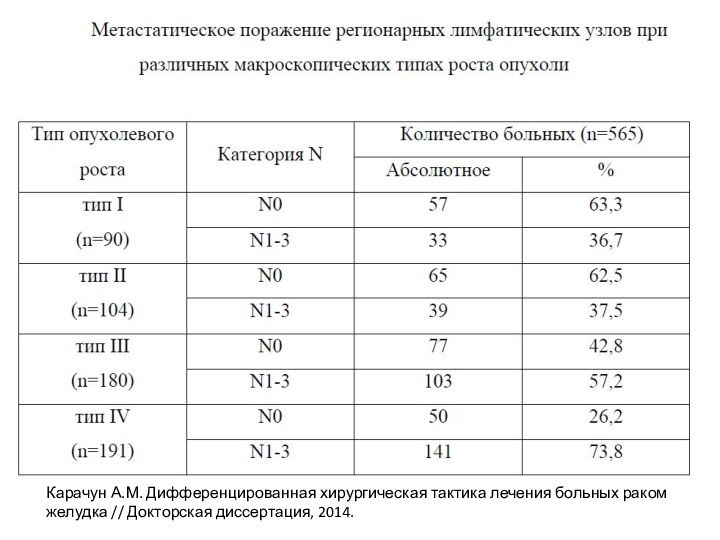
Зависимость поражения лимфатических узлов от макроскопического типа, размеров
опухоли, степени ее дифференцировки
(по данным Карачуна А.М. 2014)
Слайд 18
Карачун А.М. Дифференцированная хирургическая тактика лечения больных раком
желудка // Докторская диссертация, 2014.
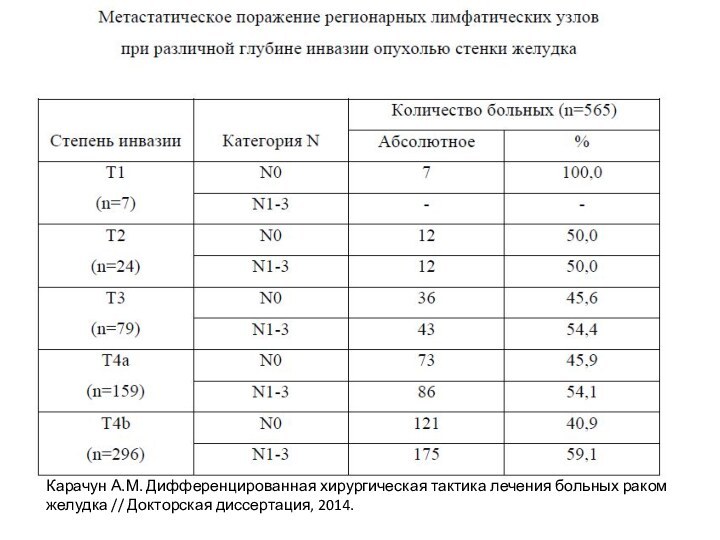
Слайд 19
Карачун А.М. Дифференцированная хирургическая тактика лечения больных раком
желудка // Докторская диссертация, 2014.
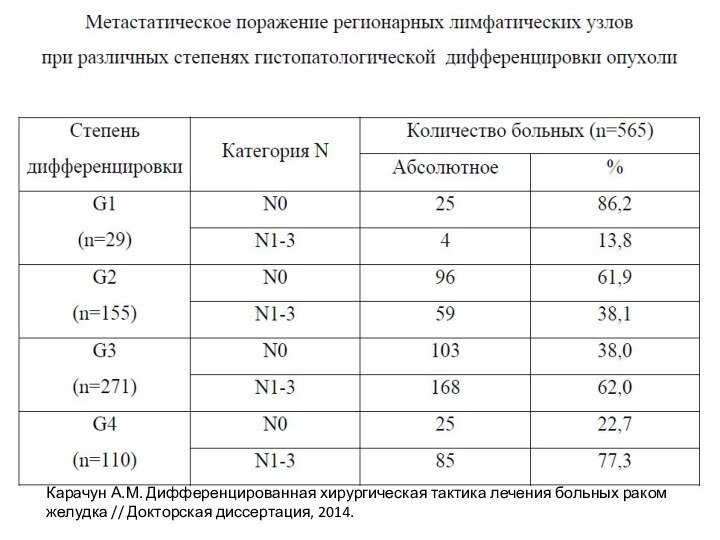
Слайд 20
Карачун А.М. Дифференцированная хирургическая тактика лечения больных раком
желудка // Докторская диссертация, 2014.
Слайд 21
Вывод по диссертации (Карачун А.М. 2014)
Из 565 пациентов
регионарные метастазы в ЛУ 2-ого этапа метастазирования выявлены в
37,9% случаях.
1. Поражение ЛУ только указанного этапа лимфогенного метастазирования при интактности узлов 1-ого этапа отмечено у 9,9% больных.
2. Поражение ЛУ центральной зоны у более чем 1/3 пациентов, обнаружение метастазов в ЛУ 2-ого уровня при их отсутствии в узлах 1-ого и невозможность достоверной интраоперационной диагностики метастатического поражения регионарных ЛУ указывает на необходимость выполнения лимфодиссекции в объеме не ниже D2 в качестве стандартной.
3. Отказ от выполнения D2 лимфодиссекции может привести, помимо заведомого снижения радикальности операции, к неправильному стадированию заболевания.
А есть ли другое мнение?
Слайд 22
Лимфодиссекция
Удаление клетчатки и ЛУ регионарного метастазирования. При РЖ лимфодиссекция позволяет превентивно удалить ЛУ 1,
2 и 3 этапов метастазирования (установить истинную распространенность процесса), повысить
радикальность операции.
Лимфодиссекция выполняется при мобилизации желудка; проводится «острым» путем от периферии к опухоли, с последовательным выделением, перевязкой и пересечением сосудов, без механического воздействия на опухоль (принцип “no touch”).
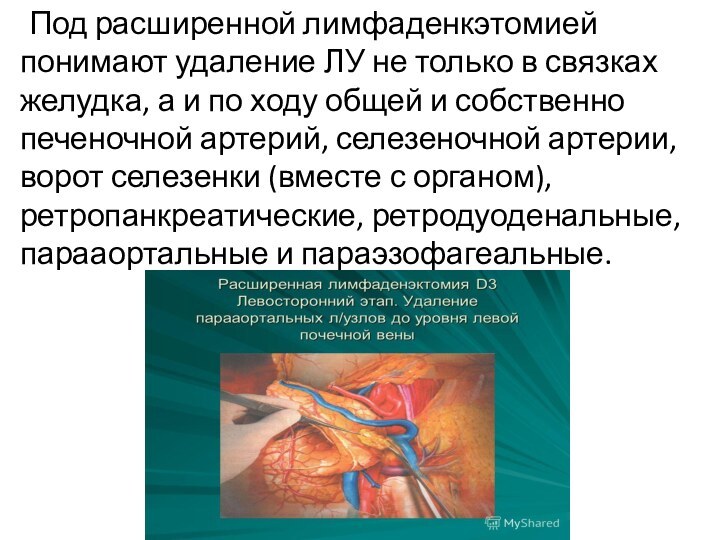
Слайд 23
Под расширенной лимфаденкэтомией понимают удаление ЛУ не только
в связках желудка, а и по ходу общей и
собственно печеночной артерий, селезеночной артерии, ворот селезенки (вместе с органом), ретропанкреатические, ретродуоденальные, парааортальные и параэзофагеальные.
Слайд 24
Целесообразность диссекции ЛУ является предметом дискуссий.
Приверженцы расширенной
диссекции полагают, что так можно четко определить стадию онкологического
процесса и провести адекватное лечение, что создает условия для улучшения показателей выживаемости.
НО, агрессивная диссекция зачастую может быть сопряжена с большим количеством ранних послеоперационных осложнений, что существенно увеличивает вероятность потенциальных летальных исходов.
Слайд 26
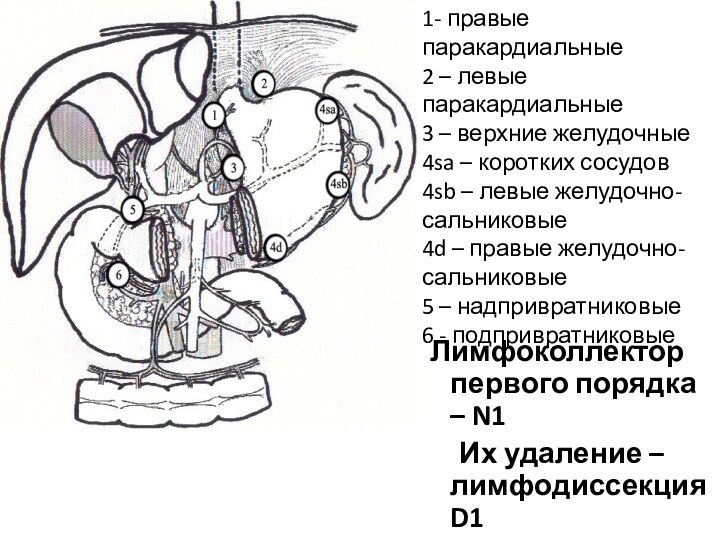
Лимфоколлектор первого порядка – N1
Их удаление –
лимфодиссекция D1
1- правые паракардиальные
2 – левые паракардиальные
3 – верхние
желудочные
4sa – коротких сосудов
4sb – левые желудочно-сальниковые
4d – правые желудочно-сальниковые
5 – надпривратниковые
6 - подпривратниковые
Слайд 27
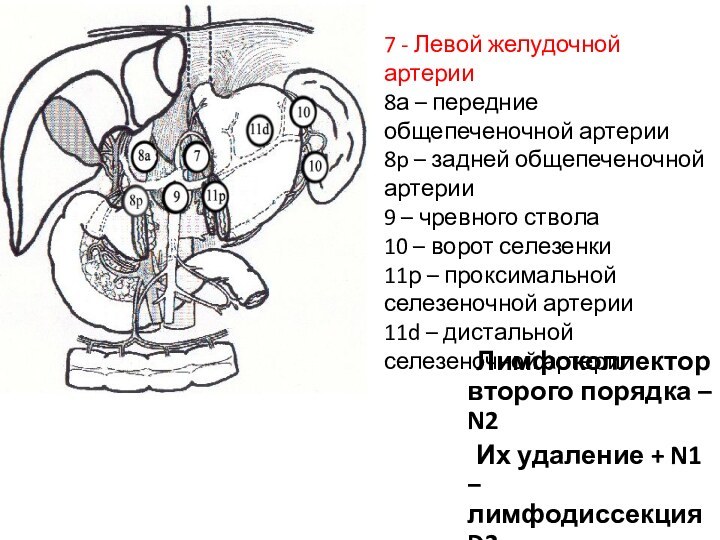
Лимфоколлектор второго порядка – N2
Их удаление + N1
– лимфодиссекция D2
7 - Левой желудочной артерии
8а – передние
общепеченочной артерии
8p – задней общепеченочной артерии
9 – чревного ствола
10 – ворот селезенки
11р – проксимальной селезеночной артерии
11d – дистальной селезеночной артерии
Слайд 28
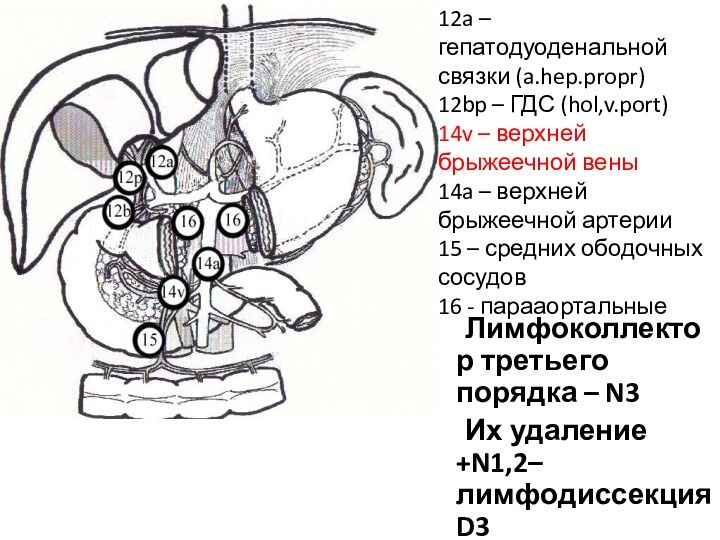
Лимфоколлектор третьего порядка – N3
Их удаление +N1,2– лимфодиссекция
D3
12a – гепатодуоденальной связки (a.hep.propr)
12bp – ГДС (hol,v.port)
14v –
верхней брыжеечной вены
14a – верхней брыжеечной артерии
15 – средних ободочных сосудов
16 - парааортальные
Слайд 29
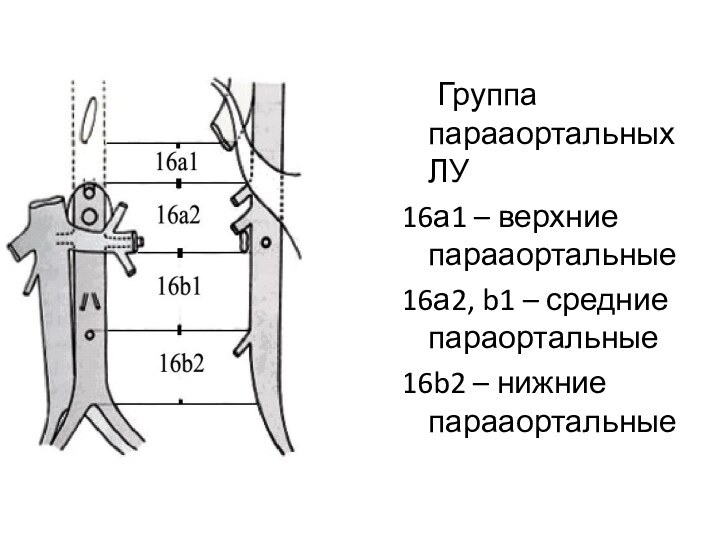
Группа парааортальных ЛУ
16а1 – верхние парааортальные
16а2, b1 –
средние параортальные
16b2 – нижние парааортальные
Слайд 30
«Главные правила» подчеркивают, что группы I, II, III,
обозначают лишь анатомическую локализацию ЛУ, а не подразумевают то,
что соответствующие ЛУ являются первичными, вторичными или третьичными.
Слайд 31
Лимфодиссекция, проводимая по «западной» методике, включала в себя
удаление перигастральных ЛУ вместе с большим и малым сальниками
(1-6 группы), то есть ЛУ, 1 этапа метастазирования, что согласно японской классификации соответствовало ЛД в объеме D1. Тот факт, что инвазия мышечного слоя опухолью приводит к поражению ЛУ 2 этапа метастазирования в 8 – 31 % случаев, а при инвазии серозной оболочки – уже в 40 % случаев, делал очевидным нерадикальность вмешательства с лимфодиссекцией D1 у части больных со стадией заболевания ≥T2. При расширенной (D2) лимфодиссекции, кроме указанных выше 1-6 групп ЛУ, удалению подвергались ЛУ 7- 11 групп. (Yang S.H. et al., 2009; Kunisaki C. et al., 1999).
Слайд 33
На IV Международном конгрессе по раку желудка (Нью-Йорк,
2001) ЛД в объеме D2 признана обязательным стандартным элементом
хирургического лечения рака желудка
В настоящее время рекомендуется выполнение D2 резекции без удаления селезенки и резекции поджелудочной железы (рекомендации ESMO – 2010г)
Слайд 34
ОДНАКО!
В рандомизированных клинических исследованиях не было показано преимущества
D2 над D1 резекцией, что, по-видимому, обусловлено большей частотой
осложнений после диссекции по D2.
Слайд 35
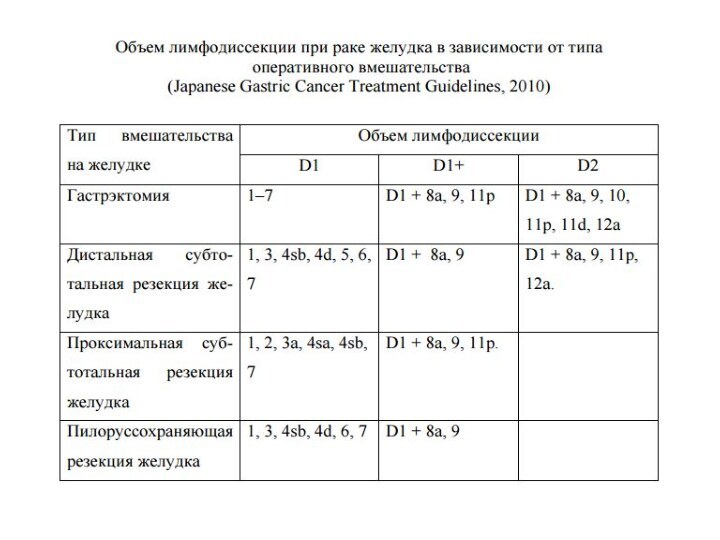
В 2010 году в Японии - новые стандарты

лечения РЖ (Japanese Gastric Cancer Treatment Guidelines, ver. 3),
в которых выбор объема лимфодиссекции (D1, D1+ или D2) связан не с локализацией опухоли в желудке, а с видом оперативного вмешательства (гастрэктомия, ДСРЖ, ПСРЖ, и т.п.).
Из видов лимфодиссекции исключена суперрасширенная (D3) лимфодиссекция, как не оправдавшая себя с учетом ближайших и отдаленных результатов (Sasako M. et al., 2008).
В объем D1 лимфодиссекции включено удаление ЛУ вдоль левой желудочной артерии (группа №7), ранее относящихся ко второму этапу (N2), тогда как удаление 14v группы ЛУ (вдоль верхней брыжеечной вены) при D2 лимфодиссекции в настоящее время не требуется даже при дистальных типах опухоли.
Спленэктомия и корпорокаудальная резекция ПЖ показаны в случаях прямой инвазии опухоли в эти органы при условии возможности выполнения R0 резекции либо в случаях гастрэктомии при локализации опухоли в области большой кривизны желудка и наличии метастазов в ЛУ вдоль левых желудочно-сальниковых сосудов
Слайд 37
JGCA рекомендует выполнение D2 лимфодиссекции во всех случаях
потенциально курабельного рака желудка в стадии Т2 и выше.
Выполнение D1 или D1+ лимфодиссекции может быть рассмотрено в случаях раннего рака желудка, когда не показаны радикальные эндоскопические вмешательства, а также у пациентов группы риска расширенных операций
Слайд 39
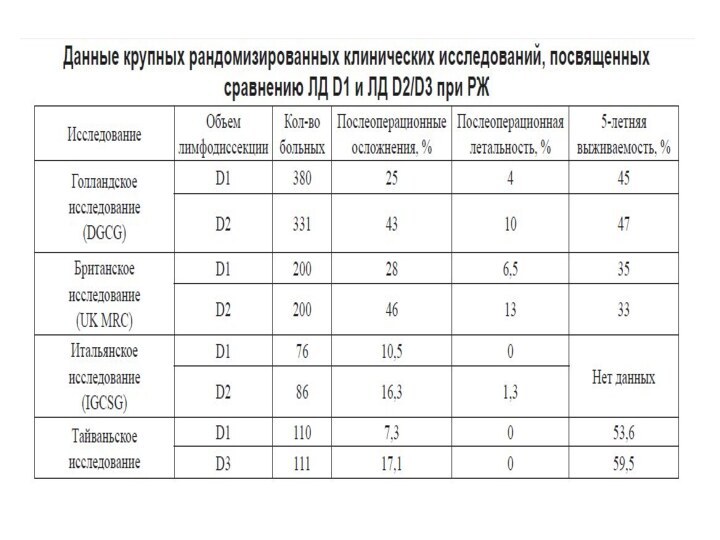
Сравнение D1 и D2 лимфодиссекции в клинических исследованиях
В
Японии нет сомнений в целесообразности применения расширенной лимфодиссекции.
Возведена в
ранг национальной доктрины
Сравнение расширенной лимфодиссекции с D1 считаются неэтичными
Нет ни одного проспективного рандомизированного исследования этого сравнения
Слайд 41
Итоги рандомизированных исследований
Метаанализ на основе 6-и рандомизированных клинических
исследований M. Memon в 2011 году.
Включено 1876 пациентов
(D1 – 946, D2 – 930).
Отмечены статистически значимые различия в пользу D1 лимфодиссекции в длительности госпитального периода (на 6,37 дня), развитии послеоперационных осложнений (на 58%), несостоятельности швов анастомозов (на 60%), риска повторного вмешательства (на 67%) и уровне 30-дневной послеоперационной летальности (на 41%).
Не отмечено статистически значимых различий в показателях общей 5-летней выживаемости между группами больных с D1 и D2 лимфодиссекцией.
Jiang L, Yang KH, Guan QL, et al. Survival and recurrence free benefits with different lymphadenectomy for resectable gastric cancer: a meta-analysis. J Surg Oncol 2013;107:807-814
Memon et al. Meta-Analysis of D1 Versus D2 Gastrectomy for Gastric Adenocarcinoma. Annals of Surgery Volume 253, Number 5, May 2011
Слайд 42
Сравнение D2 и D2+ лимфодиссекции
С начала 80-х гг.
XX века в Японии применялась сверхрасширенная лимфаденэктомия, которая заключалась
в удалении парааортальных ЛУ, частота микрометастазов в которые при РЖ колеблется в пределах от 6 до 33 %
В исследовании, проведенном в период с 1995 по 2001 г. Японской онкологической группой, 263 пациента с курабельным РЖ были рандомизированы в группу ЛД D2, 260 – в группу ЛД D2+ парааортальная лимфодиссекция. В группе ЛД D2+ большая продолжительность операции и кровопотеря.
По частоте п/о осложнений и летальности различия статистически незначимы
Общая 5-летняя выживаемость при ЛД D2 составила 69,2 %, при ЛД D2+ – 70,3 %. (статист. Незначимы)
Yonemura Y., Wu C.C., Fukushima N. et al. Randomized clinical trial of D2 and extended paraaortic lymphadenectomy in patients with gastric cancer // Int. J. Clin. Oncol. 2008. Vol. 13. P. 132–137.
Слайд 43
Сравнение D2 и D2+ лимфодиссекции
Выводы:
1. Относительная безопасность
ЛД D2+
2. На основании результатов рандомизированного исследования [1], учитывая
отсутствие статистически значимых различий в показателях 5-летней выживаемости, сверхрасширенная ЛД при РЖ исключена из стандартов по лечению РЖ в Японии с 2010 г. [2].
Sasako M., Sano T., Yamamoto S. et al. D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer // N. Engl. J. Med. 2008. Vol . 359. P. 453–462
Sano T., Aiko T. New Japanese classifications and treatment guidelines for gastric cancer: revision concepts and major revised points // Gastric Cancer. 2011. Vol. 14. P. 97–100
Слайд 44
Дисскусия
Выбора оптимального объема ЛД при РЖ остается
дискутабельным.
В Японии, D2 ЛД выполняется рутинно во всех
случаях курабельного нераннего РЖ
Наиболее частые осложнения для ЛД D2 - внутрибрюшные абсцессы и кровотечения, раневая инфекция, ятрогенные повреждения селезенки, несостоятельность швов анастомозов.
Крупные многоцентровые рандомизированные исследования, проведенные на Западе, не показали преимуществ расширенной ЛД
Слайд 45
Дисскусия
Проведенные РКИ нельзя признать идеальными а их
результаты – абсолютно доказанными
В 2 наиболее крупных европейских РКИ
опыт хирургов был минимальным.
Отклонения от протокола в сторону выполнения меньшей по объему ЛД в голландском исследовании встретились в 84 % случаев (!)
Спленэктомия и корпорокаудальная резекция ПЖ были рекомендованы при ЛД D2 во 2-ой англоязычной редакции JGCA и выполнялись в РКИ, проведенных в Гонконге и Тайване.
Это повлияло на точность диагностики стадии по TNM (феномен «миграции стадии») и сделало анализируемые группы больных мало сопоставимыми.
Слайд 46
Феномен «миграции стадии»
После расширенной ЛД происходит «миграция стадии»,
известная также как «феномен Will Rogers»
У пациентов, которые перенесли
ограниченную ЛД, в действительности может быть существенно большее распространение заболевания с худшим прогнозом, чем у пациентов с такой же стадией, но установленной после расширенной ЛД.
По разным оценкам, только указанный феномен дает увеличение показателей пятилетней выживаемости на 15 % при III стадии после ЛД D2 по сравнению с ЛД D1.
Dent D.M., Madden M.V., Price S.K. Randomized comparison of R1 and R2 gastrectomy for gastric carcinoma // Br. J. Surg. 1988. Vol. 75. P. 110–112яё
Слайд 47
Вывод
ЛД D2 связана с большей частотой интра-
и послеоперационных осложнений, а также более высокой п/о летальностью,
чем ЛД D1 по данным РКИ.
Показатели 5-летней выживаемости у перенесших ЛД D1 или ЛД D2, не имеют статистически значимых отличий (в РКИ).
Можно согласиться с мнением, что частота п/о осложнений и п/о летальность после ЛД D2 при условии овладения соответствующей хирургической техникой окажутся сопоставимыми с таковыми после ЛД D1, что, возможно, отразится на показателях общей 5-летней выживаемости.