- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электрический Ток в Растворах и Расплавах Электролитов
Содержание
- 2. Растворы солей, кислот и оснований называются электролитами. Химически
- 3. Электрической диссоциацией называется расщепление в воде солей, кислот
- 4. Электронная теория позволяет рассчитать массу вещества, выделившегося
- 5. Величины NA и е являются универсальными постоянными, а
- 6. Скачать презентацию
- 7. Похожие презентации

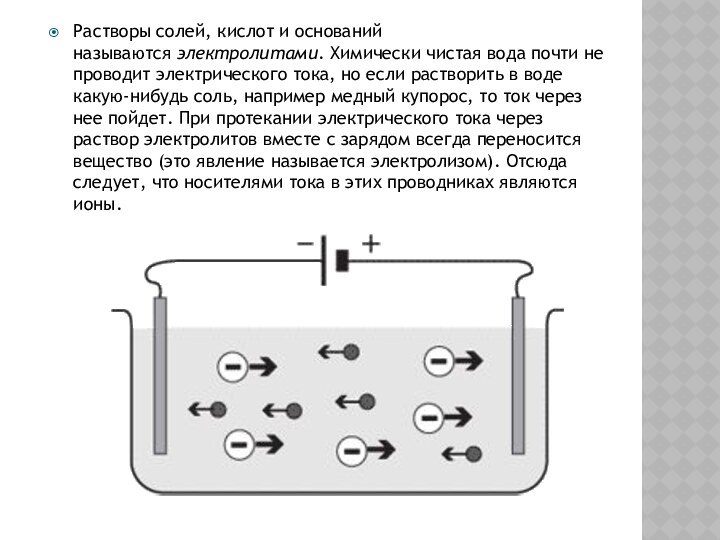




Слайд 3 Электрической диссоциацией называется расщепление в воде солей, кислот и
щелочей на положительные и отрицательные ионы. Растворы электролитов всегда
содержат некоторое число ионов: катионов (положительных ионов) и анионов (отрицательных ионов). Пока электрическое поле отсутствует, ионы совершают только беспорядочное тепловое движение. Но в электрическом поле ионы, подобно электронам в металлах, начинают дрейфовать в направлении действующей на них силы: катионы - к катоду, анионы - к аноду.Электрический ток в растворах (или расплавах) электролитов представляет собой перемещение ионов обоих знаков в противоположных направлениях. Опыт показывает, что сила тока при постоянном сопротивлении электролитов линейно зависит от напряжения, т. е. для растворов электролитов справедлив закон Ома.
Слайд 4 Электронная теория позволяет рассчитать массу вещества, выделившегося на
электродах при электролизе. Она равна массе одного иона m0,
умноженной на число ионов N, которые осели на электродах. Масса одного ионаСлайд 5 Величины NA и е являются универсальными постоянными, а М
и z постоянны для данного вещества.
Поэтому выражение
- величина,
постоянная для данного вещества.Масса вещества, выделившегося на электроде, пропорциональна заряду, прошедшему через раствор (или пропорциональна силе тока и времени). Эта зависимость носит название закона Фарадея.
Коэффициент k называется электрохимическим эквивалентом данного вещества. Он выражается в килограммах на кулон (кг/Кл).
Закон Фарадея позволяет определить заряд одновалентного иона:





























