Слайд 2
Электрохимическая коррозия – самопроизвольное разрушение металлических материалов вследствие
их электрохимического взаимодействия с окружающей, электролитически проводящей средой.
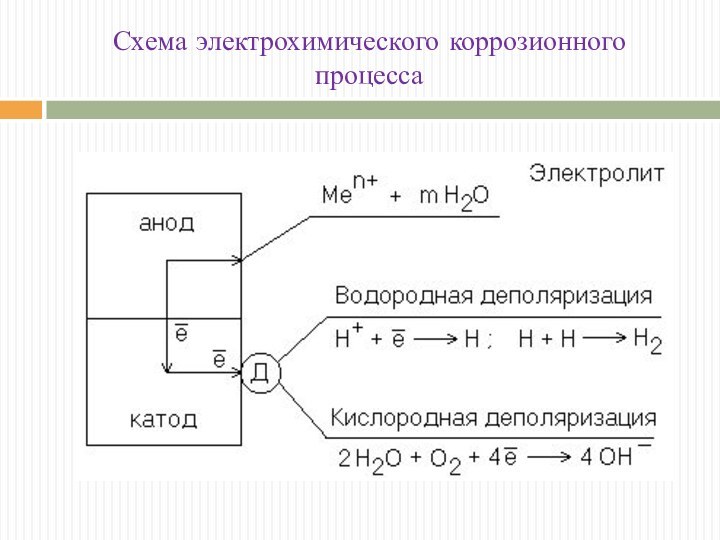
анодный
процесс - ионизация атомов металла с образованием гидратированных ионов металла в растворе электролита и свободных электронов на анодных участках в металле
(ne-)a ne-Men+ mH20 Men+*mH20;
процесс переноса электронов в металле от зон анодной реакции и участками, на которых термодинамически и кинетически возможен катодных процесс (процесс перетока электронов в металле от анодных к катодным участкам и соответствующего перемещения ионов в электролите)
(ne-)a (ne-)k ;
процесс подвода окислителя-деполяризатора к катодным зонам
катодный процесс - присоединения (ассимиляции) электронов какими - либо молекулами или ионами раствора (деполяризаторами), способными восстанавливаться на катодных участках:
D + ne- = [Dne-].
Слайд 3
Схема электрохимического коррозионного процесса
Слайд 4
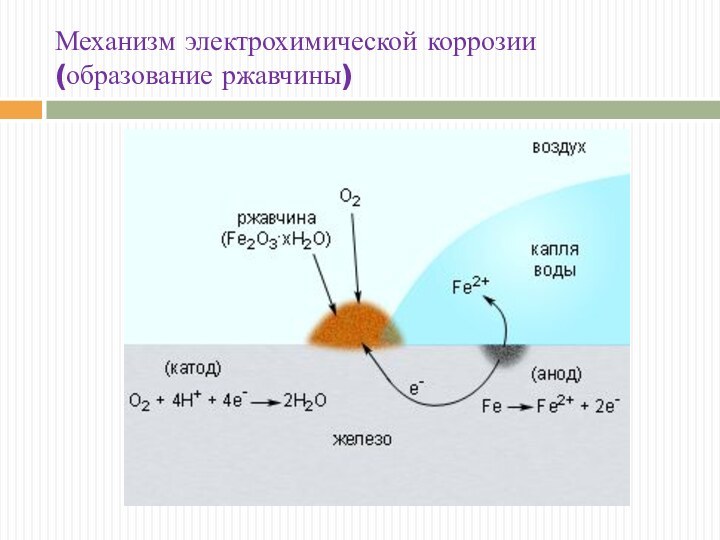
Механизм электрохимической коррозии (образование ржавчины)
Слайд 5
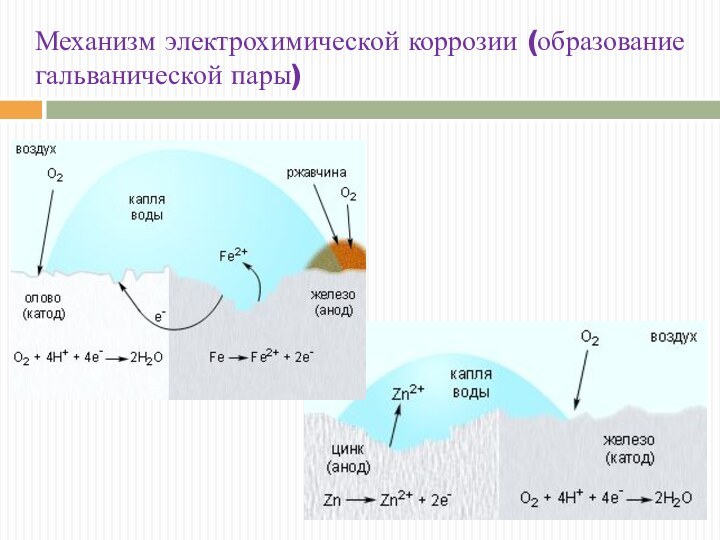
Механизм электрохимической коррозии (образование гальванической пары)
Слайд 6
Условия, способствующие электрохимической коррозии
Положение металла в ряду
активности металлов: чем они дальше расположены друг от друга,
тем быстрее происходит коррозия.
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Слайд 7
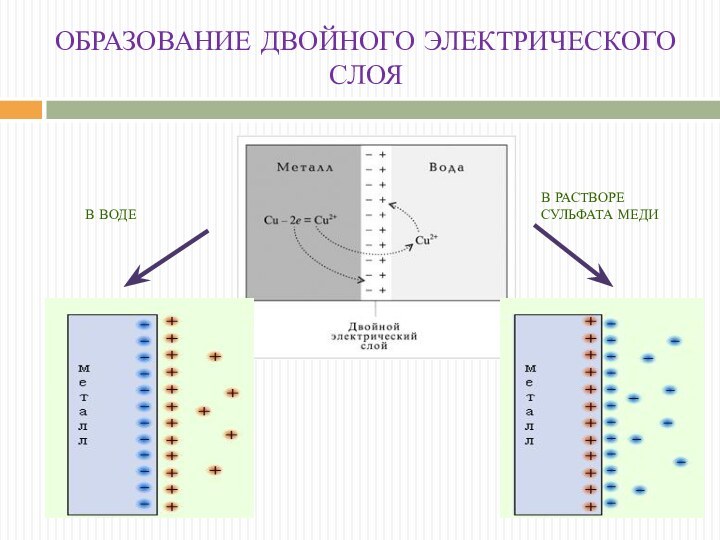
МЕХАНИЗМ ОБРАЗОВАНИЯ ДЭС
Переход ионов или электронов из одной
фазы в другую (поверхностная ионизация). Примером может служить диссоциация
поверхностных функциональных групп, принадлежащих одной из фаз (как правило, твердой). Для определения знака заряда поверхности используется правило Фаянса — Пескова — Панета (на поверхности твердого вещества преимущественно адсорбируются ионы, которые могут достраивать кристаллическую решетку, то есть входят в ее состав, изоморфны или образуют труднорастворимое соединение с ионами, составляющими кристаллическую решетку).
Преимущественная адсорбция в межфазном слое ионов одного знака.
Ориентирование полярных молекул в поверхностном слое. По этому механизму ДЭС образуется в случае, если вещества, составляющие фазы системы не могут обмениваться зарядами. Для определения знака заряда поверхности используют правило Кёна (Правило Кёна: из двух соприкасающихся фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость).
Слайд 8
ОБРАЗОВАНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ
В ВОДЕ
В РАСТВОРЕ
СУЛЬФАТА
МЕДИ
Слайд 9
При погружении медного электрода в раствор СuSО4, содержащий
ионы меди в концентрации С возможны три случая:
1. С
< Сo. Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в поверхностном слое раствора катионов будет больше, чем анионов.
2. С > Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО42-
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
Слайд 10
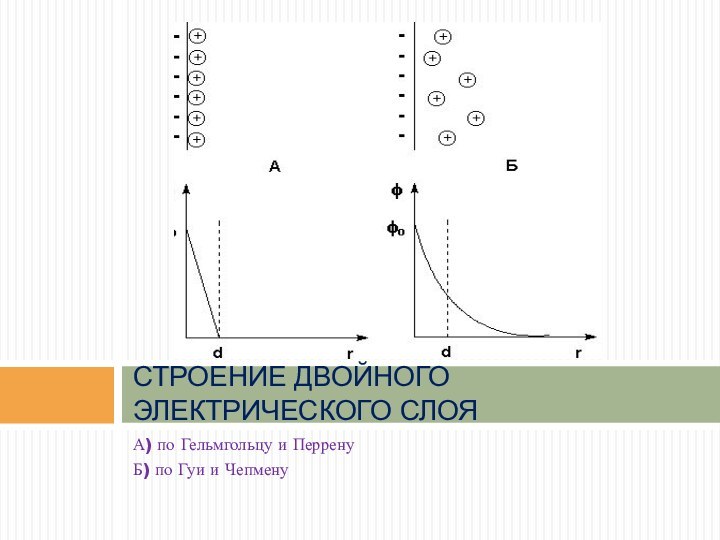
А) по Гельмгольцу и Перрену
Б) по Гуи и
Чепмену
СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ
Слайд 11
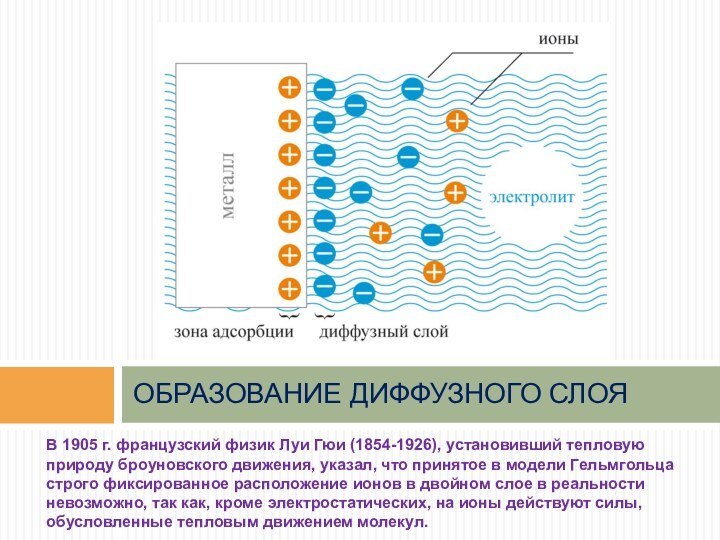
В 1905 г. французский физик Луи Гюи (1854-1926),
установивший тепловую природу броуновского движения, указал, что принятое в
модели Гельмгольца строго фиксированное расположение ионов в двойном слое в реальности невозможно, так как, кроме электростатических, на ионы действуют силы, обусловленные тепловым движением молекул.
ОБРАЗОВАНИЕ ДИФФУЗНОГО СЛОЯ
Слайд 12
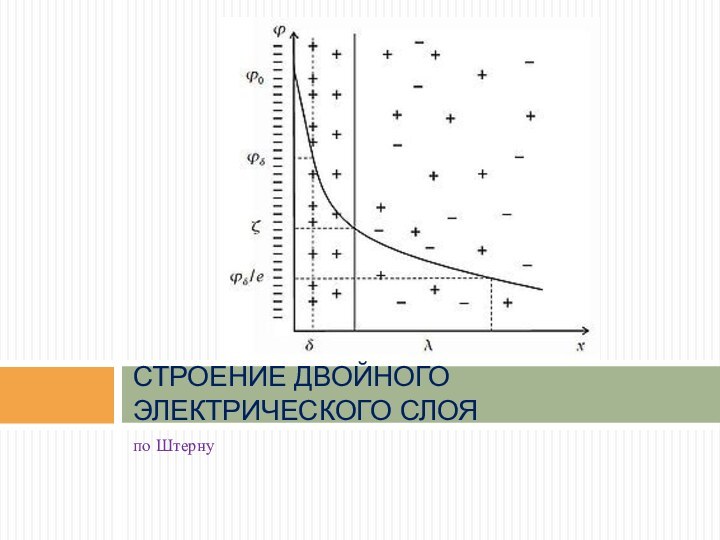
по Штерну
СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ
Слайд 13
ПОЛУЭЛЕМЕНТ — электрод, погруженный в электролит.
Полный электролитический
элемент состоит из двух соединенных полуэлементов, в которых растворы
разделены мембраной или управляющим мостиком, пропускающим электричество и предотвращающим смешивание растворов.
ВОДОРО́ДНЫЙ ЭЛЕКТРО́Д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией.
В состав гальванического элемента входят два разнородных электрода (один - содержащий окислитель, другой - восстановитель), контактирующие с электролитом.
Слайд 14
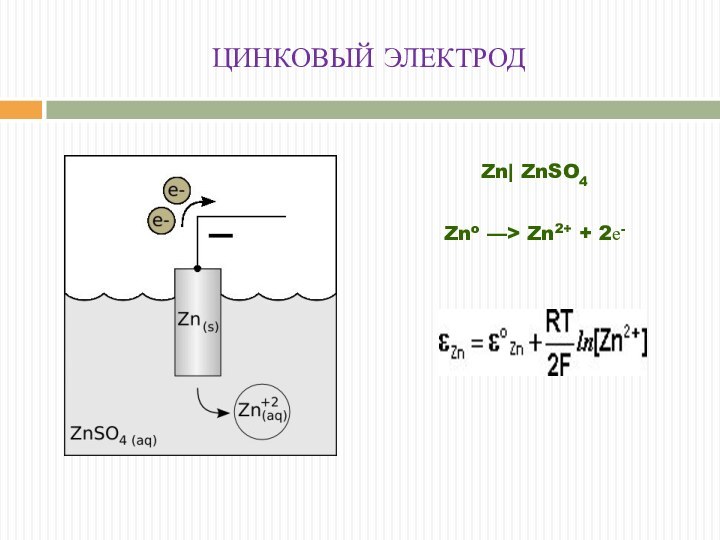
ЦИНКОВЫЙ ЭЛЕКТРОД
Zn| ZnSO4
Zno ––> Zn2+ + 2е-
Слайд 15
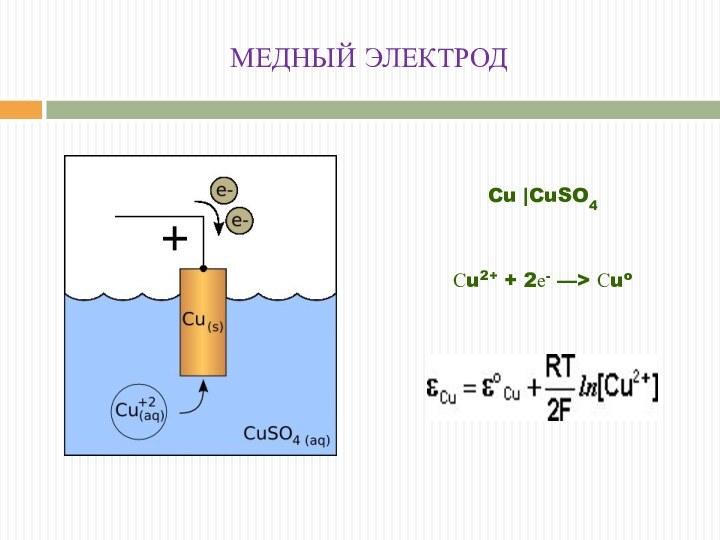
МЕДНЫЙ ЭЛЕКТРОД
Сu2+ + 2е- ––> Сuo
Cu |CuSO4
Слайд 16
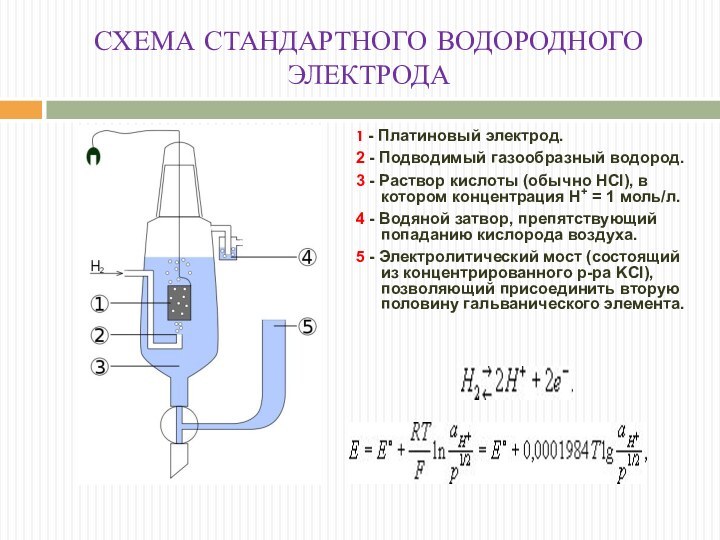
СХЕМА СТАНДАРТНОГО ВОДОРОДНОГО ЭЛЕКТРОДА
1 - Платиновый электрод.
2 -
Подводимый газообразный водород.
3 - Раствор кислоты (обычно HCl), в
котором концентрация H+ = 1 моль/л.
4 - Водяной затвор, препятствующий попаданию кислорода воздуха.
5 - Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Слайд 17
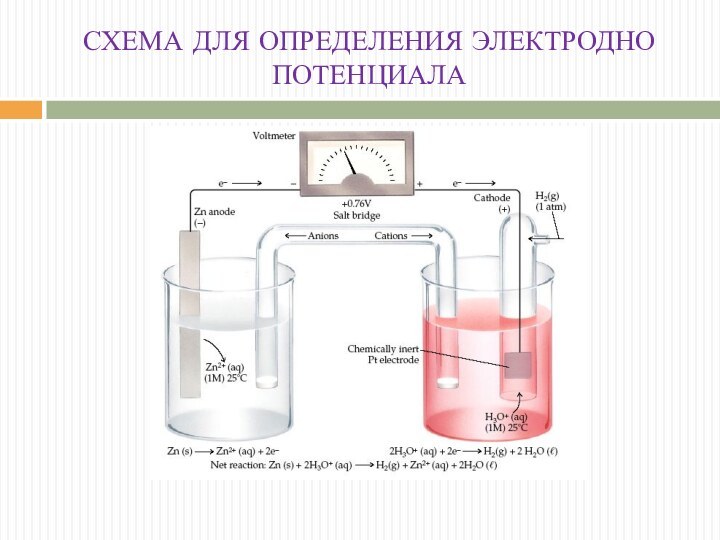
СХЕМА ДЛЯ ОПРЕДЕЛЕНИЯ ЭЛЕКТРОДНО ПОТЕНЦИАЛА
Слайд 18
ЭДС электрохимического элемента
ЭДС электрохимического элемента φ равна разности
электродных
потенциалов:
Е =φ 1 - φ2
Величина электродного
потенциала металлического электрода зависит
от температуры и активности (концентрации) иона металла в растворе, в
который опущен электрод; математически эта зависимость
выражается уравнением Нернста :
F – постоянная Фарадея
z – заряд иона
ε° – стандартный электродный потенциал, равный потенциалу
электрода при активности иона металла, равной 1 моль/л.
Слайд 19
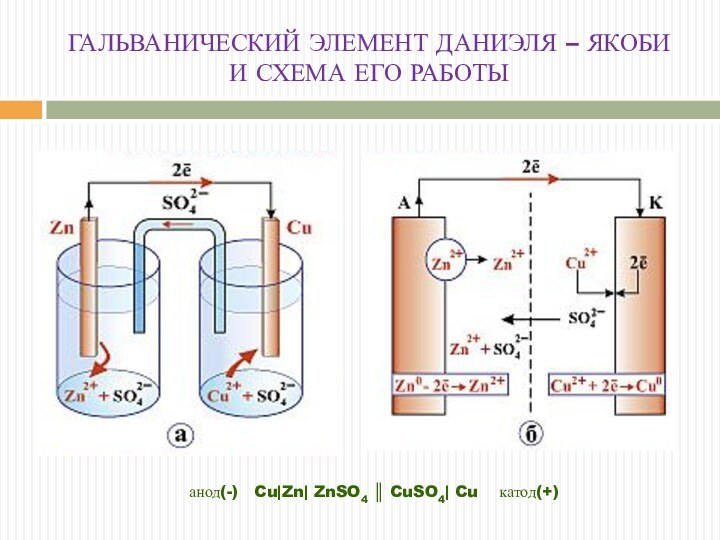
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ И СХЕМА ЕГО
РАБОТЫ
анод(-) Cu|Zn| ZnSO4 ║ CuSO4| Cu катод(+)
Слайд 20
Анод: Zno ––> Zn2+ + 2е-
Катод: Сu2+ +
2е- ––> Сuo
Суммарное уравнение: Сu2+ + Zno ––> Сuo
+ Zn2+
Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
dA=∆Φ•dq
Слайд 21
Если отсчитывать абсолютный электродный потенциал, полагая положительным переход
от раствора к металлу, то для электродвижущей силы ЭДС
данного гальванического элемента можно написать равенство:
Е = φCu - φZn + φк
а для гальванического элемента, содержащего металлы 1 и 2:
Е = φ1 - φ2 + φ12
φCu - абсолютный электродный потенциал меди
φZn - абсолютный электродный потенциал цинка
Φк - контактный потенциал в месте соприкосновения меди и
цинка
φ1 - абсолютный электродный потенциал 1-го металла
φ2 - абсолютный электродный потенциал 2-го металла
φ12 - контактный потенциал в месте соприкосновения металлов
Слайд 23
Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных
условиях, можно рассчитать по уравнению Нернста:
φ - электродный потенциал
окислительно-восстановительного электрода, В;
φ° - стандартный электродный потенциал этого электрода, В;
R - универсальная газовая постоянная, равная 8,314 Дж/моль· К
T - температура, K;
n - число электронов в уравнении электродной реакции;
F - число Фарадея, равное 96500 Кл/моль ;
a ок., a восст. - активности окисленной формы восстановителя (Меn+) и восстановленной формы окислителя (Ме) в электродной реакции.
Слайд 24
Подставив в уравнение Нернста T = 298 K,
R, F и введя множитель 2,3 (переход к десятичным
логарифмам), получим:
Уравнение Нернста для металлического электрода имеет вид:
Для разбавленных растворов, в которых активности мало отличаются от концентрации (a ≈ С):
Слайд 25
стандартный электродный потенциал - напряжение гальванического элемента, содержащего
в качестве левого электрода стандартный водородный электрод, а в
качестве правого электрода - измеряемый электрод, в условиях, когда активности всех участников окислительно-восстановительной реакции равны единице, а внешнее давление составляет 1 атм.
Из ряда напряжений вытекает, что каждый металл будет вытеснять все следующие за ним металлы из водного раствора их солей. Например,
Fe + CuSO4 = FeSO4 + Cu
Металлы, находящиеся в ряду напряжений до водорода, вытесняют его из растворов кислот, металлы, расположенные после - не вытесняют.
Слайд 26
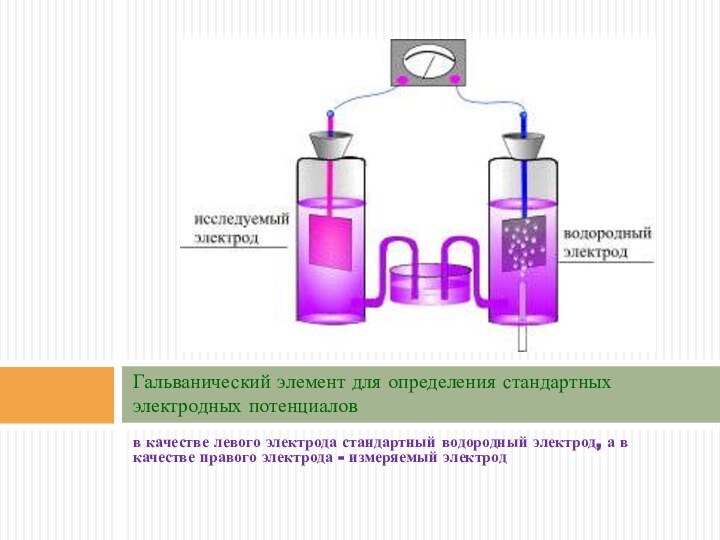
Гальванический элемент для определения стандартных электродных потенциалов
в качестве
левого электрода стандартный водородный электрод, а в качестве правого
электрода - измеряемый электрод
Слайд 27
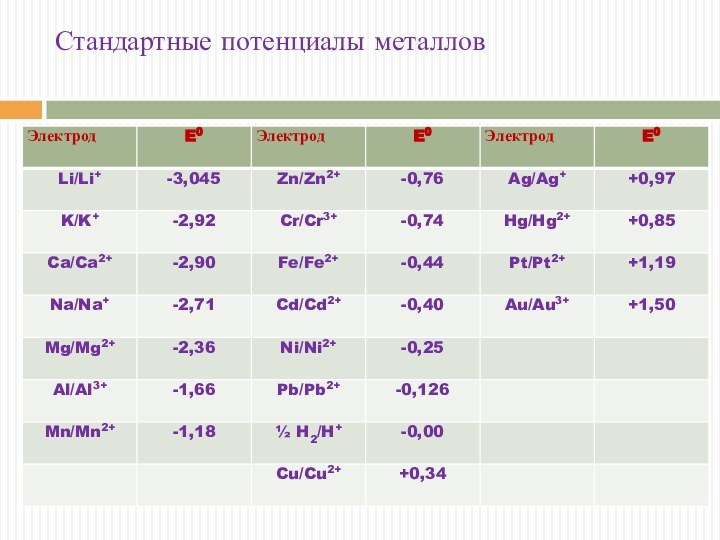
Стандартные потенциалы металлов
Слайд 28
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
электроды первого рода
электроды второго рода
окислительно-восстановительные электроды
амальгамные электроды
ион-селективные
электроды
газовые электроды и т.д.
Слайд 29
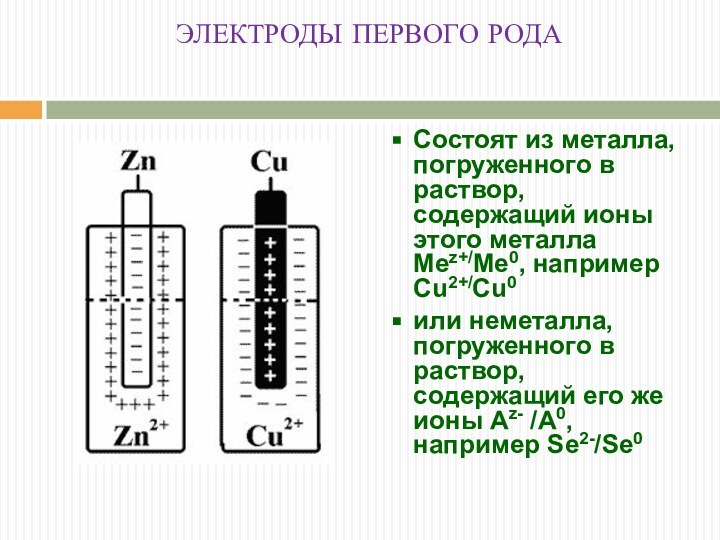
ЭЛЕКТРОДЫ ПЕРВОГО РОДА
Состоят из металла, погруженного в раствор,
содержащий ионы этого металла Меz+/Me0, например Cu2+/Cu0
или неметалла, погруженного
в раствор, содержащий его же ионы Аz- /A0, например Se2-/Se0
Слайд 30
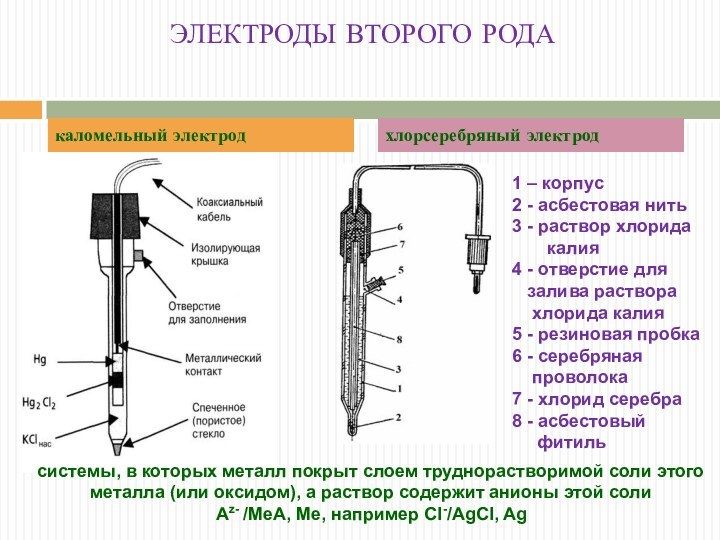
ЭЛЕКТРОДЫ ВТОРОГО РОДА
каломельный электрод
хлорсеребряный электрод
системы, в которых
металл покрыт слоем труднорастворимой соли этого металла (или оксидом),
а раствор содержит анионы этой соли
Аz- /МеА, Ме, например Cl-/AgCl, Ag
1 – корпус
2 - асбестовая нить
3 - раствор хлорида
калия
4 - отверстие для
залива раствора
хлорида калия
5 - резиновая пробка
6 - серебряная
проволока
7 - хлорид серебра
8 - асбестовый
фитиль
Слайд 31
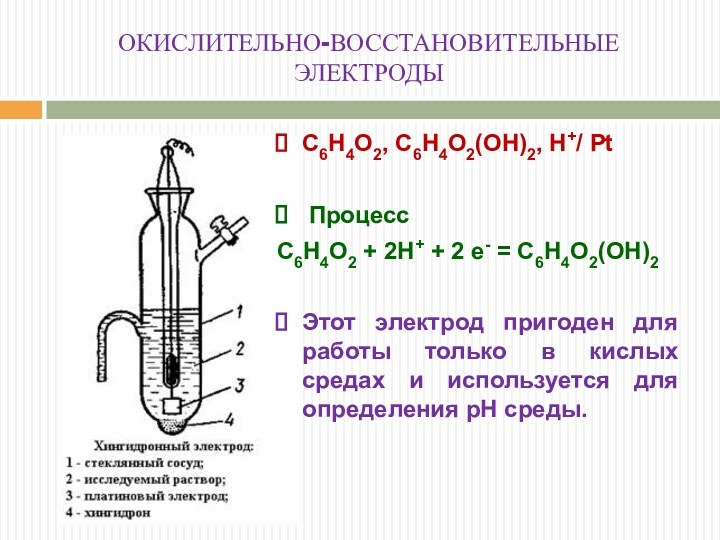
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
ЭЛЕКТРОДЫ
С6Н4О2, С6Н4О2(ОН)2, Н+/ Рt
Процесс
С6Н4О2
+ 2Н+ + 2 е- = С6Н4О2(ОН)2
Этот электрод пригоден
для работы только в кислых средах и используется для определения рН среды.