- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические реакции
Содержание
- 2. Протекание реакций целиком в твердой фазе не
- 3. Твердые тела, как правило, не взаимодействуют друг
- 4. Расчет свободной энергии может сказать лишь способна
- 5. Взаимодействие смеси порошков MgO и Al2O3 становится
- 6. Причем сначала образуются зародыши MgAl2O4. Значительные структурные
- 7. Ионы Mg+2 в MgO и Al+3 в
- 8. Одновременно происходит взаимный обмен ионов Mg+2 и
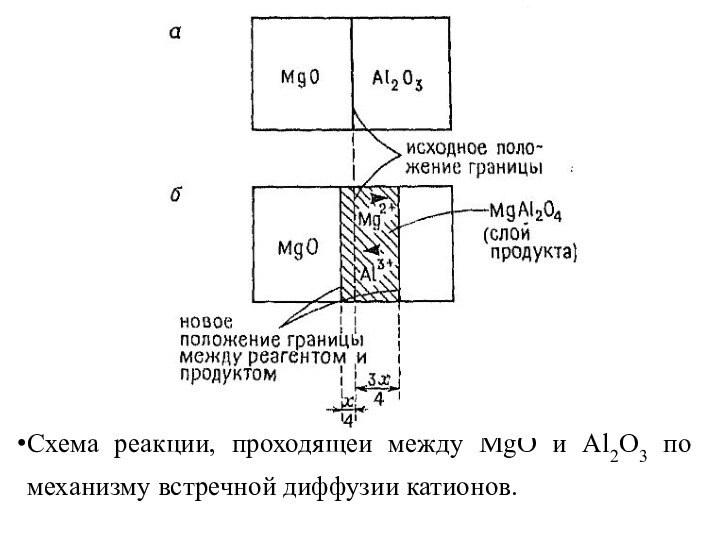
- 9. Схема реакции, проходящей между MgO и Al2O3 по механизму встречной диффузии катионов.
- 10. Реакции внедрения и ионного обмена как методы
- 11. Для того чтобы твердое соединение могло вступать
- 12. Структуры графита и TiS2, образующих соединение внедрения
- 13. В соединениях типа -глинозема (-Al2O3) также имеются
- 14. Структура цеолитов (молекулярных сит) образована трехмерным алюмосиликатным
- 15. Перечисленные типы соединений и реакций интересны не
- 16. В дисульфид титана TiS2 можно электрохимически вводить
- 17. Соединения внедрения на основе графита (СВГ)Графит –
- 19. Многие из приведенных реакций обратимы. Так, в
- 20. Рассмотрим более детально структуру графита и одного
- 21. Эта упаковка отличается от обычной гексагональной тем,
- 22. Эта р-орбиталь перекрывается с такими же орбиталями
- 23. Вследствие делокализации -электронов, которая с позиций зонной
- 24. Слабое взаимодействие соседних слоев друг с другом
- 26. Относительное расположение углеродных слоев в этом соединении
- 27. Заполнение всех имеющихся в структуре позиций этого
- 28. Она обозначается как С8-К+, то есть в
- 29. Соединения внедрения на основе дихалькогенидов переходных металлов
- 31. Показательным примером реакции внедрения является взаимодействие TiS2
- 32. Эту реакцию обычно проводят при комнатной температуре
- 33. LixTiS2 можно получить также электрохимически. Катод электрохимической
- 35. Анодом является полоска металлического лития, опущенная в
- 36. В самом начале реакции электродвижущая сила ячейки,
- 37. Рассмотренные методы синтеза могут быть с успехом
- 38. Среди них можно назвать Ta2S2C, NiPS3, FeOCl,
- 39. Реакции ионного обменаС помощью реакций ионного обмена
- 40. Много примеров применения реакций ионного обмена для
- 42. Ионы натрия, благодаря неплотной упаковке кислорода имеют
- 43. Возможно также замещение натрия на двухзарядные ионы.
- 44. Особенно легко осуществляется замещение ионов натрия на
- 46. Катионное замещение в -глиноземе можно проводить электрохимически.Основные
- 47. Как и любые химические процессы, реакции ионного
- 48. При 3000С ионы щелочных металлов весьма подвижны
- 49. Значительно сложнее проходит обмен при участии катионов
- 50. Синтез метастабильных фаз с использованием приемов мягкой
- 51. Используя образование промежуточных соединений, удается в некоторых
- 52. Их структура и структура промежуточного соединения чрезвычайно
- 53. Новая полиморфная модификация диоксида титана TiO2 (В)
- 54. Структура этой формы близка к структуре K2Ti4O9
- 55. Методы электрохимического восстановленияПутем электрохимического восстановления удалось получить
- 56. Электрохимическое восстановление сводится к электролизу расплава смеси
- 57. Условия, необходимые для синтеза того или иного
- 58. Смесь помещают в тигель из инертного к
- 60. Получение материалов в виде тонких слоев и
- 61. В некоторых случаях переход к тонкопленочному состоянию
- 62. Реакции образования пленок на поверхности твердого телаРассмотрим
- 63. Типичным примером подобных реакций может служить окисление
- 64. Пластина из металлического серебра была изолирована от
- 66. Оказалось, что вес серебряной пластины уменьшился. Однако
- 67. Серебро диффундирует через -Ag2S в виде ионов,
- 68. Кинетика роста толстых пленокРост пленок на поверхности
- 69. Линейный закон применим к реакции на поверхности
- 70. В более общем случае этот закон применим
- 71. Отклонения от параболического и линейного закона роста
- 72. Предполагается, что МХ содержит катионные вакансии VМ,
- 73. Поток вакансий от внешней поверхности к поверхности
- 74. В стационарном состоянии образуется направленный внутрь диффузионный
- 75. Соответствующий этому электрический ток точно эквивалентен потоку
- 77. Если концентрации вакансий и дырок повсюду точно
- 78. Это должно привести к разделению зарядов и
- 79. где D- коэффициент диффузии, - подвижность.Потоки
- 80. Первые члены в правой части уравнения соответствуют
- 81. Используем уравнение Эйнштейна, связывающее коэффициент диффузии с
- 82. Поскольку полная электропроводность выражается в виде
- 83. Кроме того,так что проводимость во многом определяется
- 84. Если число ионов металла на единицу объема
- 85. Рост пленки в этом случае описывается параболическим
- 86. Они возникают на внешней поверхности пленки и
- 87. Можно ожидать, что концентрация вакансий меди на
- 89. Если вакансии не ионизированы, их концентрация должна
- 90. Поскольку скорость реакции зависит от процесса диффузии
- 91. Причем на каждый ион Cd+2 приходится вакантный
- 92. Соотношение скоростей окисления серебра с добавкой кадмия
- 93. Кинетика роста тонких пленокЕсли толщина пленки менее
- 94. При расчете распределения потенциала и его влияния
- 95. Кроме того, изменение кинетических закономерностей, вследствие изменения
- 96. При изучении роста очень тонких пленок следует
- 97. Скорость окисления алюминия определяется стадией перехода алюминия
- 98. Этот барьер намного больше того, который приходится
- 99. Скорость переходов повышается под действием электрического поля,
- 100. Эта зависимость показывает, что при очень малой
- 101. Химические и электрохимические методыНанесение катодных покрытий. Разность
- 102. Безэлектродное нанесение покрытий. Этот процесс отличается от
- 103. Анодное оксидирование. Этот метод применяют для нанесения
- 104. При увеличении напряжения на электродах рост оксидной
- 105. Анодные оксидные слои на поверхности металла образуются
- 106. Так, на поверхности алюминия в присутствии кислорода
- 107. В частности обработка некоторых металлов в атмосфере
- 108. Образование пленок происходит в момент разложения газов
- 109. смещается вправо при понижении температуры, что можно
- 110. Пленки, осажденные из паровой фазы, часто наследуют
- 111. Физические методыКатодное распыление. Схема установки изображена на
- 113. Положительные ионы газа, двигаясь к катоду. Разгоняются
- 114. В современном оборудовании для катодного распыления используют
- 115. Таким образом получают пленки чистых металлов, сплавов,
- 116. Выбор материала подложки диктуется назначением и требованиями
- 117. Материал контейнера – испарителя, выдерживающий очень высокие
- 118. Выращивание монокристалловМонокристаллы могут быть получены при кристаллизации
- 119. Метод ЧохральскогоЭтот метод в основном применяется для
- 120. При постепенном движении затравки вверх на ее
- 122. Это позволяет уменьшить температурные и концентрационные неоднородности
- 123. Для предотвращения потерь за счет испарения при
- 124. Метод Бриджмена и СтокбаргераЭти методы также основаны
- 125. В методе Стокбаргера это осуществляется путем относительного
- 126. Рис. 216 а. Метод Стокбаргера
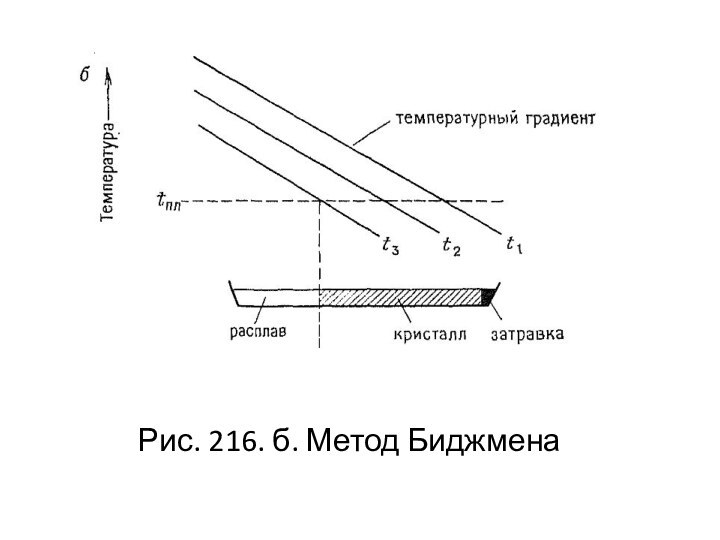
- 127. Рис. 216. б. Метод Биджмена
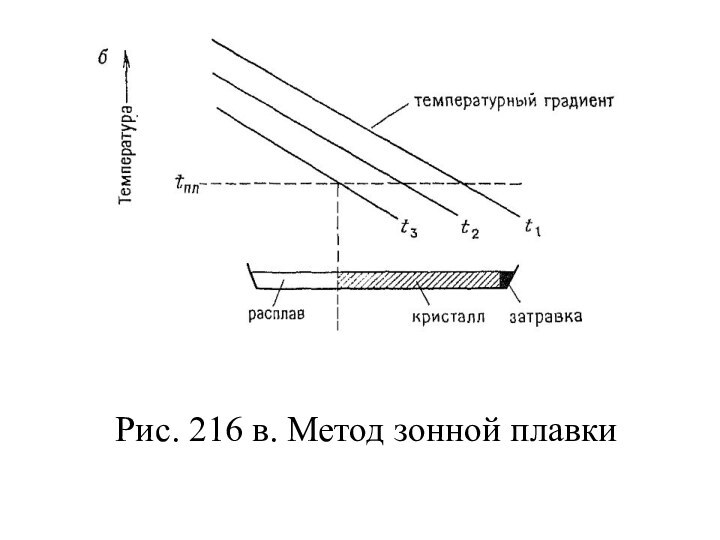
- 128. Зонная плавкаЭтот метод похож на метод Стокбаргера,
- 129. Рис. 216 в. Метод зонной плавки
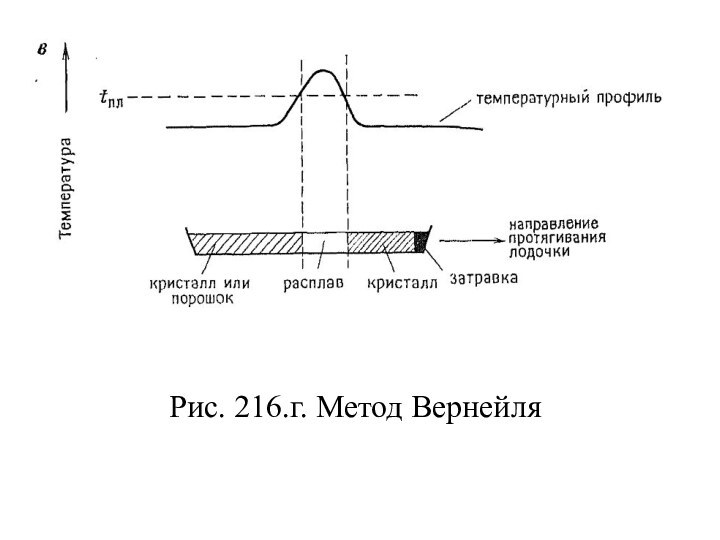
- 130. Рис. 216.г. Метод Вернейля
- 131. При дальнейшем протягивании лодочки через печь и
- 132. Метод зонной плавки используют для очистки и роста монокристаллов даже таких тугоплавких металлов, как вольфрам
- 133. Кристаллизация из растворов или расплавовВ отличие от
- 134. Например, кристаллы SiO2 и различных силикатов с
- 135. В частности, разработана методика получения монокристаллов твердых электролитов - и ”-Al2O3 из боратных расплавов.
- 136. Эпитаксиальный рост тонких слоевДля получения монокристаллических тонких
- 137. Рост кристалла при сохранении двумерного соответствия называется
- 138. В качестве подложки могут быть использованы кристаллы
- 139. Так, тонкие слои GaAs выращивают, осаждая из
- 140. Газоплазменный метод ВернейляВпервые этот метод был использован
- 141. Скачать презентацию
- 142. Похожие презентации
Протекание реакций целиком в твердой фазе не столь типично как их протекание в газовой фазе или в жидкости, тем не менее такие процессы известны. Реакции между газом и твердым телом также лимитируются стадией переноса вещества внутри


































































































































Слайд 3 Твердые тела, как правило, не взаимодействуют друг с
другом при комнатной температуре. Для того, чтобы реакция между
ними протекала с заметной скоростью, необходимо нагревание до 1000 – 15000 С. таким образом, протекание реакции в твердой фазе определяется и термодинамическим и кинетическими факторами.Слайд 4 Расчет свободной энергии может сказать лишь способна или
не способна данная реакция протекать, тогда как кинетический фактор
определяет скорость реакции. Например, согласно термодинамическому расчету MgO и Al2O3 должны реагировать с образованиемMgAl2O4, однако на практике скорость этой реакции при комнатной температуре очень мала.
Слайд 5 Взаимодействие смеси порошков MgO и Al2O3 становится сколь-либо
заметным лишь при температуре выше 12000 С.
На рис.
2.1.а представлено взаимодействие порошков MgO и Al2O3, тесно соприкасающихся по общей плоскости. В результате теплового воздействия на границе раздела кристаллов возникает слой MgAl2O4 (рис. 2.1.б).Слайд 6 Причем сначала образуются зародыши MgAl2O4. Значительные структурные различия
исходных веществ и продукта затрудняют зародышеобразование, поскольку совершающаяся при
этом перестройка, требует разрыва имеющихся связей и образование новых, а также миграции атомов на расстояние, которое в некоторых случаях может быть весьма значительным.Слайд 7 Ионы Mg+2 в MgO и Al+3 в Al2O3
размещаются в регулярных узлах решетки и их перемещение в
соседний незанятый узел происходит с большим трудом. Только при высокой температуре тот или иной ион способен покинуть свой узел и начать диффундировать через кристалл. Образование зародышей MgAl2O4 требует перегруппировки кислородных ионов к месту локализации будущего зародыша.Слайд 8 Одновременно происходит взаимный обмен ионов Mg+2 и Al+3
через поверхность раздела двух кристаллов.Следующий этап взаимодействия – рост
образовавшегося слоя продуктов реакции. Здесь необходима встречная диффузия Mg+2 и Al+3 через имеющийся слой шпинели к новым реакционным поверхностям (их становится уже две).Слайд 10 Реакции внедрения и ионного обмена как методы получения
новых соединений на основе существующих структур
Реакции внедрения (встраивания в
кристаллическую структуру дополнительных атомов, ионов или молекул) и ионного обмена (замещения ионов одного вида на другие при обработке твердых фаз расплавами солей или растворами) применяют при получении новых твердофазных соединений.Слайд 11 Для того чтобы твердое соединение могло вступать в
эти реакции, его структура должна удовлетворять ряду требований, важнейшим
из которых является высокая степень открытости структуры, позволяющая посторонним атомам или ионам легко диффундировать в объеме кристалла и легко покидать его. Вот некоторые примеры соединений, обладающих такими свойствами.Слайд 12 Структуры графита и TiS2, образующих соединение внедрения (интеркалаты),
имеют слоистый характер. При внедрении посторонних атомов или ионов
в межслойное пространство слои раздвигаются, а при последующем удалении внедрившихся частиц вновь сближаются.Слайд 13 В соединениях типа -глинозема (-Al2O3) также имеются открытые
слои, структура которых позволяет ионам Na+ легко передвигаться внутри
слоя. При обработке натриевой формы -глинозема расплавами соответствующих солей ионы натрия могут быть замещены на ряд других катионов.Слайд 14 Структура цеолитов (молекулярных сит) образована трехмерным алюмосиликатным каркасом,
образующим сеть пересекающихся каналов и пустот. Гидратированные катионы, локализованные
в этих пустотах, склонны к ионному обмену.Слайд 15 Перечисленные типы соединений и реакций интересны не только
тем, что расширяют возможности препаративной неорганической химии, но с
их помощью можно решить многие технологические задачи.Так, цеолиты благодаря их способности к ионному обмену, наряду с другими применениями могут также служить в качестве ионнообменников для уменьшения жесткости воды
Слайд 16 В дисульфид титана TiS2 можно электрохимически вводить ионы
лития благодаря этой особенности TiS2 и другие дихалькогениды переходных
металлов перспективны в качестве материалов обратимых электродов твердофазных аккумуляторов
Слайд 17
Соединения внедрения на основе графита (СВГ)
Графит – классическая
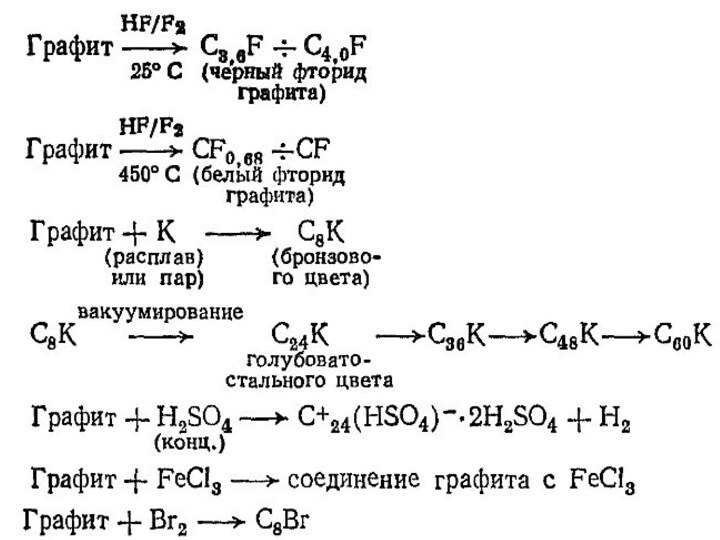
матрица для проведения реакций внедрения. Его способность к включению
в свою структуру атомов, ионов или молекул достаточно хорошо изучена. Соединения внедрения в графит могут быть получены, в частности с катионами щелочных металлов, галогенид-ионами, аммиаком и аминами, солями галогенводородных и кислородсодержащих кислот. Некоторые представления о типичных реакциях внедрения можно представить:Слайд 19 Многие из приведенных реакций обратимы. Так, в расплаве
калия графит образует соединение С8К, которое при последующем вакуумировании
разлагается на компоненты. Таким образом, реакцию довольно легко осуществить как в прямом, так и в обратном направлениях, что объясняется структурными особенностями участников реакции: слоистая структура графита при образовании соединений внедрения не претерпевает изменений.Слайд 20 Рассмотрим более детально структуру графита и одного из
соединений внедрения. Координационное число углерода в плоских слоях структуры
графита равно трем, следовательно эти слои не являются плотноупакованными. Период повторяемости слоев равен двум, т.е. структура построена по типу АВАВА…Слайд 21 Эта упаковка отличается от обычной гексагональной тем, что
некоторые атомы углерода расположены над атомами углерода соседнего слоя,
тогда как другие – над центром углеродного кольца в нижнем слое. Электроны углерода находятся в состоянии sp2-гибридизации. Не подвергшаяся гибридизации р-орбиталь с неспаренным электроном направлена перпендикулярно плоскости углеродного кольца.Слайд 22 Эта р-орбиталь перекрывается с такими же орбиталями трех
примыкающих атомов углерода, в итоге возникает бесконечная (в двумерном
пространстве, т.е. в данной плоскости) делокализованная -система, близкая к той, которая образуется в ароматических соединениях. Расстояния между атомами углерода в слое составляет 1,41 А0 (в бензоле 1,40)Слайд 23 Вследствие делокализации -электронов, которая с позиций зонной теории
означает образование зонной проводимости, графит обладает высокой тепло- и
электропроводностью. Внутри слоя атомы углерода связаны прочно (кратность связи 1,5), тогда как между слоями существует лишь слабое притяжение ван-дер-ваальсового типа.Слайд 24 Слабое взаимодействие соседних слоев друг с другом –
причина значительного межслоевого расстояния (3,35 А0), что делает возможным
внедрение посторонних атомов между ними, при этом межслоевое расстояния еще больше увеличивается. Например в С8К оно составляет 5,41 А0, а в CF ~ 6,6 А0. Структуры многих соединений внедрения в графит (СВГ) достоверно неизвестны, предполагаемая структура С8К – приведена на рис. 2.8 б.Слайд 26 Относительное расположение углеродных слоев в этом соединении отличается
от их расположения в чистом графите: в С8К слои
образуют последовательность …ААА… Каждый ион калия расположен между центрами двух углеродных колец, принадлежащих соседним слоям. Таким образом, координационное число калия равно 12.Слайд 27 Заполнение всех имеющихся в структуре позиций этого типа
соответствует стехиометрии С2М, а формула С8К отвечает заполнению только
¼ этих позиций, причем упорядоченным образом. Образование СВГ вызывает изменение электронной структуры графита: наблюдается частичный перенос электронной плотности от калия к углероду, в результате чего возникает полярная структура.Слайд 28 Она обозначается как С8-К+, то есть в этом
соединении графит проявляет себя как акцептор электронов, но в
других соединениях он может выступать как донор. Так обстоит дело в соединениях с галогенами, что отражает условная электронная формула, например бромида С8+Br-. Как при донорном, так и при акцепторном поведении углерода, зона проводимости в СВГ заполнена лишь частично и соединения С8-К+ и С8+Br- являются хорошими проводниками электричества.Слайд 29 Соединения внедрения на основе дихалькогенидов переходных металлов и
других слоистых и туннельных структур
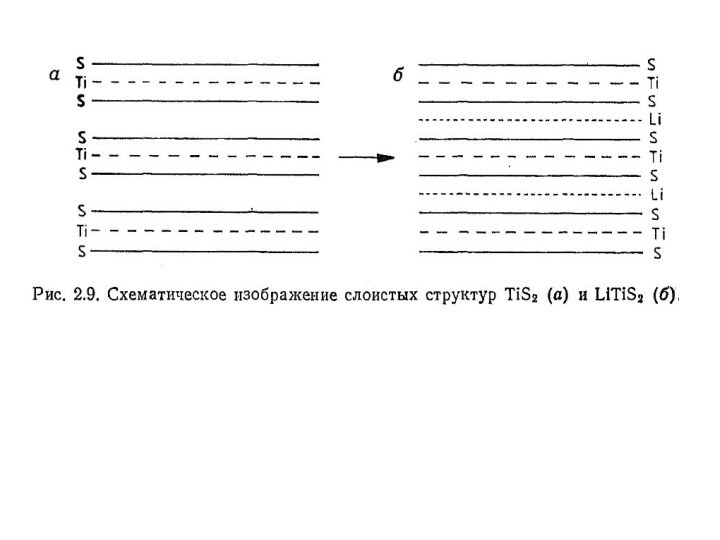
Дисульфиды переходных металлов IV, V
и VI групп имеют слоистые структуры и могут образовывать соединения внедрения. Наиболее детально изучена структура и поведение дисульфида титана TiS2. Сандвичевая структура этого соединения схематично представлена на рис. 2.9.аСлайд 31 Показательным примером реакции внедрения является взаимодействие TiS2 с
литием, приводящее к образованию LixTiS2 (0 < x
1). Внедряясь в пространство между сандвичами TiS2 ионы лития вызывают расширение решетки в направлении, перпендикулярным слоям, на 10% (при х = 1). Одновременно происходит восстановление Ti+4 до Ti+3 в количестве, эквивалентном х.Слайд 32 Эту реакцию обычно проводят при комнатной температуре в
органическом растворителе, используя в качестве источника н-бутилат лития:
После завершения
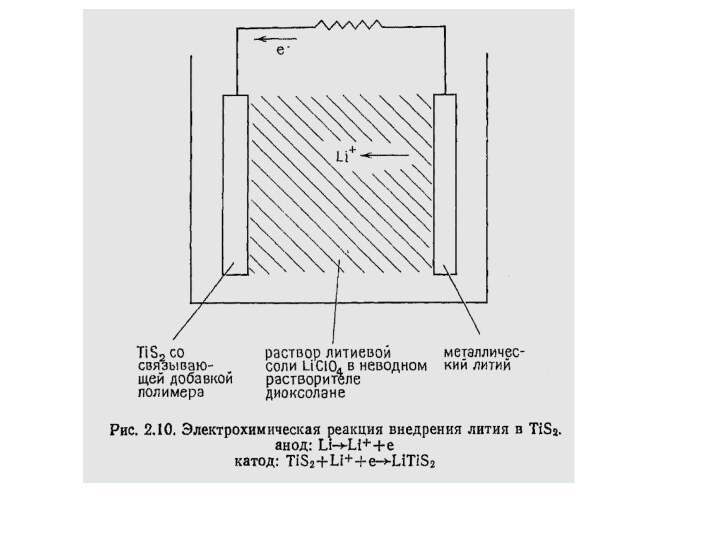
реакции образовавшийся твердый продукт отфильтровывают и промывают гексаном.Слайд 33 LixTiS2 можно получить также электрохимически. Катод электрохимической ячейки
изготовлен из порошка TiS2, смешанного для обеспечения механической прочности
с порошком тефлона и затем напресованного на металлическую сетку. Электролит представляет собой раствор соли лития (LiClO4) в неводном полярном растворителе, например диоксалане.Слайд 35 Анодом является полоска металлического лития, опущенная в электролит.
При замыкании внешней цепи, соединяющей электроды, в ней возникает
поток электронов от Li к TiS2, а ионы Li+ переносятся к катоду, где внедряются в TiS2 Скоростью внедрения, равно как и количеством внедренного лития, можно легко управлять, включив во внешнюю цепь источник регулируемого напряжения встречной полярности.Слайд 36 В самом начале реакции электродвижущая сила ячейки, изображенной
на рис. 2.10, составляет ~2,5 В, на основании чего
гальваническая пара Li/TiS2 представляет собой систему аккумулирования энергии. Аккумуляторные батареи такого типа способны при одинаковой массе хранить энергии в 3 – 4 раза большие, чем свинцово-кислотные батареи.Слайд 37 Рассмотренные методы синтеза могут быть с успехом применены
для получения других соединений внедрения, в частности образуемых катионами
щелочных металлов, ионами Cu+, Ag+, H+, NH3+, органическими аминами и металлоценами. Помимо графита и дихалькогенидов переходных металлов способность образовывать соединения внедрения проявляют и другие вещества со слоистой или туннельной структурой.Слайд 38 Среди них можно назвать Ta2S2C, NiPS3, FeOCl, V2O5,
MoO3, WO3, TiO2, MnO2 и др. Особенно хорошо изучено
образование вольфрамовых бронз, в частности NaxWO3.
Слайд 39
Реакции ионного обмена
С помощью реакций ионного обмена также
можно получить новые соединения. В структурах, анионный состав которых
имеют открытые слои или взаимопересекающиеся каналы, одни катионы способны к замещению на другиеСлайд 40 Много примеров применения реакций ионного обмена для синтетических
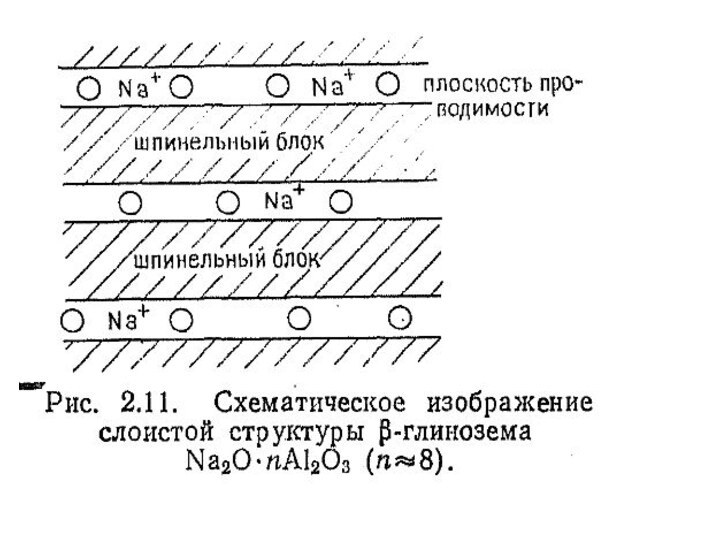
целей можно найти в химии соединений со структурой -глинозема.
Структура которого изображена на рис. 2.11. Структура -глинозема построена из шпинелеподобных блоков толщиной ~ 9А0, разделенных плоскостями проводимости. В этих плоскостях расположены ионы кислорода, играющие роль мостиков между шпинельными блоками.Слайд 42 Ионы натрия, благодаря неплотной упаковке кислорода имеют высокую
двумерную подвижность, придающую -глинозему свойства катионпроводящего твердого электролита. Выдерживая
-глинозем в расплавах соответствующих солей (при температуре 3000С), можно осуществить замещение иона натрия на такие катионы как: Li+, K+, Rb+, Ag+, Cu+, Tl+, NH4+, In+,Ga+, NO+, NH3+Слайд 43 Возможно также замещение натрия на двухзарядные ионы. Например
обмен на Ca+2 происходит при 600 - 8000 С.
Понятно, что для сохранения электронейтральности один ион кальция должен быть замещен на два иона натрия. Равновесная степень замещения, которая достигается при выдерживании кристаллов -глинозема в расплаве, зависит от состава последнего.Слайд 44 Особенно легко осуществляется замещение ионов натрия на ионы
серебра. На рис. 2.12 приведена такая зависимость для бинарных
смесей нитратов в расплаве (300 – 3500С). Ею можно воспользоваться для получения частично замещенных -глиноземов с заданным отношением подвижных катионов.
Слайд 46
Катионное замещение в -глиноземе можно проводить электрохимически.
Основные закономерности
реакций ионного обмена, установленные при изучении поведения соединений со
структурой -глинозема, справедливы и для многих других кристаллов, в первую очередь содержащих ионы щелочных металлов.Слайд 47 Как и любые химические процессы, реакции ионного обмена
регламентируются термодинамическим и кинетическим факторами. Принципиальная возможность прохождения ионного
обмена и равновесная степень замещения определяются термодинамическим фактором. Кинетика процесса в основном определяется подвижностью ионов в кристаллах.Слайд 48 При 3000С ионы щелочных металлов весьма подвижны во
многих структурах, поэтому такие кристаллы могли бы претерпевать ионный
обмен в расплавах. Так, Ag2Si2O5 (силикат со слоистой структурой) был приготовлен путем обработки кристаллов Na2Si2O5 в расплаве AgNO3 при 2800С.Слайд 49 Значительно сложнее проходит обмен при участии катионов с
зарядом, больше единицы, так как образуемые ими прочные связи
делают их малоподвижными. Однако при значительном повышении температуры это затруднение можно преодолеть.
Слайд 50
Синтез метастабильных фаз с использованием приемов мягкой химии
Методы,
основанные на предварительном получении промежуточных фаз, дают возможность существенно
снизить температуру образования конечного продукта по сравнению с обычным твердофазным взаимодействием.Слайд 51 Используя образование промежуточных соединений, удается в некоторых случаях
синтезировать новые метастабильные фазы, которые невозможно получить другими методами.
Будучи термодинамически неустойчивы, такие фазы в силу кинетических затруднений сохраняются до достаточно высоких температур.Слайд 52 Их структура и структура промежуточного соединения чрезвычайно близки,
а свойства интересны. Приемы синтеза таких метастабильных фаз получили
название “мягкой химии”, что выразительно характеризует экспериментальные особенности этих методов. Рассмотрим два типичных примера.Слайд 53 Новая полиморфная модификация диоксида титана TiO2 (В) синтезирована
из промежуточного соединения K2Ti4O9, которое было предварительно получено по
твердофазной реакции между KNO3 (источник K2O) и TiO2 (10000С). Обработка K2Ti4O9 азотной кислотой при комнатной температуре привела к образованию твердого продукта состава H2Ti4O9·H2O, из которого после дегидратации при 5000С и образовалась полиморфная модификация TiO2 (В).
Слайд 54
Структура этой формы близка к структуре K2Ti4O9
Новая
гексагональная форма WO3 была получена через промежуточную стадию образования
геля вольфрамовой кислоты. Гель, образовавшийся при подкислении раствора Na2WO4, подвергали гидротермальной обработке при 1200С и получали кристаллический гидрат 3WO3H2O. После обезвоживания гидрата при медленном нагревании на воздухе до 4200С была получена новая фаза.
Слайд 55
Методы электрохимического восстановления
Путем электрохимического восстановления удалось получить очень
многие кристаллические соединения, в том числе в виде монокристаллов
с хорошей огранкой. Некоторые соединения получены впервые благодаря этому методу.Слайд 56 Электрохимическое восстановление сводится к электролизу расплава смеси компонентов,
из которой при этом кристаллизуется конечный продукт. Примерами таких
процессов является восстановление ионов переходных металлов до низших степеней окисления и восстановление анионов кислородсодержащих кислот (фосфатов до фосфидов, карбонатов до карбидов, боратов до боридов и т.д.).Слайд 57 Условия, необходимые для синтеза того или иного соединения,
находят преимущественно эмпирически, а происходящие при этом реакции часто
не вполне понятны, потенциалы ионов при температуре расплава, как правило неизвестны.В состав расплава обычно входят оксид металла, борат (фосфат, карбонат и т.п.) щелочного металла и галогенид щелочного металла.
Слайд 58 Смесь помещают в тигель из инертного к расплаву
и продуктам электролиза материала. Электроды, которые также должны быть
инертны, изготавливают из платины или графита. Представление о полученных соединениях и условиях их синтеза приведены в табл.
Слайд 60
Получение материалов в виде тонких слоев и пленок
В
современной технологии большую роль играют материалы в виде тонких
слоев и пленок, как кристаллических, так и аморфных. В частности без пленок немыслима миниатюризация электронных устройств Тонкослойные покрытия относятся к одним из самых прогрессивных способов защиты других материалов от разнообразных воздействий.Слайд 61 В некоторых случаях переход к тонкопленочному состоянию приводит
к появлению уникальных свойств, обусловленных ничтожной толщиной и большим
отношением площади поверхности к объему.Для получения тонких пленок разработано множество различных методов, которые можно разделить на две большие группы: физические и химические.
Слайд 62
Реакции образования пленок на поверхности твердого тела
Рассмотрим вначале
реакции, приводящие к образованию пленок на поверхности твердого тела.
Такие реакции происходят при взаимодействии твердого тела с жидкостью или газом. В наиболее простых случаях это процессы образования соединений из твердых тел элементарного состава.Слайд 63 Типичным примером подобных реакций может служить окисление металлов.
Значение процессов переноса в этих и других реакциях с
участием твердой фазы можно проиллюстрировать на примере классического исследования сульфидирования металлического серебра, выполненного Вагнером.Слайд 64 Пластина из металлического серебра была изолирована от расплавленной
серы, с которой она должна была реагировать с помощью
двух пластин из -Ag2S, причем все слои находились в непосредственном контакте (рис. 77). Реакция осуществлялась при нагреве всей системы до 2000С.Слайд 66 Оказалось, что вес серебряной пластины уменьшился. Однако изменения
веса пластины -Ag2S, прилегающей к серебряной, не произошло. Вес
другой пластины -Ag2S, соприкасающейся с расплавленной серой, возрос на величину, в точности равную убыли веса серябряной пластины. Это показывает, что механизм реакции включает диффузию серебра через слой сульфида серебра и реакции на поверхности Ag2S - S .Слайд 67 Серебро диффундирует через -Ag2S в виде ионов, а
электронейтральность сохраняется за счет эквивалентного потока электронов через слой
сульфида. Эти электроны затем восстанавливают серу на внешней поверхности, причем скорость всего процесса лимитируется диффузией ионов серебра через слой -Ag2S.
Слайд 68
Кинетика роста толстых пленок
Рост пленок на поверхности твердого
тела в зависимости от их толщины подчиняется различным законам.
Для толстых пленок, толщиной 1000 А и более, толщина пленок может изменяться со временем или линейно = At
или по параболическому закону
2 = В + Сt
Слайд 69 Линейный закон применим к реакции на поверхности твердого
тела, приводящей к образованию пленки, слабо связанной с поверхностью,
такая пленка легко отслаивается от металла, поэтому возле металла всегда имеется избыток газа. Скорость реакции d/dt = A не зависит от времени. Подобным образом протекает окисление щелочных и щелочноземельных металлов.Слайд 70 В более общем случае этот закон применим к
системам, в которых скорость реакции определяется реакциями на границе
между металлом и пленкой.Параболический закон описывает процесс роста, лимитируемый диффузией через пленку, прочно связанную с поверхностью
Слайд 71 Отклонения от параболического и линейного закона роста могут
быть следствием побочных явлений, таких как повторяющиеся процессы растрескивания
и залечивания трещин.Рассмотрим взаимодействие металла М с газом Х, которое приводит к образованию соединения МХ.
Слайд 72 Предполагается, что МХ содержит катионные вакансии VМ, являющиеся
акцепторами электронов. Положительно заряженные дырки и отрицательно заряженные вакансии
VM- почти полностью ионизированы.Вакансии образуются на внешней поверхности пленки МХ вследствие избыточного давления в этом месте атомов Х, а их концентрация в направлении поверхности раздела металл – пленка, уменьшаются.
Слайд 73 Поток вакансий от внешней поверхности к поверхности раздела
соответствует диффузии атомов металла в обратном направлении, т.е. к
внешней поверхности, где они взаимодействуют с атомами газа Х.Движущей силой возникновения градиента концентраций атомов М по толщине пленки является изменение свободной энергии при протекании химической реакции.
Слайд 74 В стационарном состоянии образуется направленный внутрь диффузионный поток
вакансий VM- . Дырки, образующиеся в результате ионизации вакансий,
также формируют поток через пленку, в том же направлении.Слайд 75 Соответствующий этому электрический ток точно эквивалентен потоку заряженных
вакансий, поскольку в стационарном состоянии результирующий поток электрических зарядов
должен быть равен нулю. Это схематически показано на рис. 78.Слайд 77 Если концентрации вакансий и дырок повсюду точно равны,
их концентрационные градиенты также должны быть равными. Однако вследствие
различия в подвижности поток частиц одного типа, должен превышать поток частиц другого типа, за счет чего нарушается равномерность в распределении зарядов.Слайд 78 Это должно привести к разделению зарядов и постепенному
накоплению пространственного заряда в пленке. Однако разность потенциалов по
толщине пленки, возникающая вследствие разделения зарядов, препятствует дальнейшему протеканию процесса, и в действительности разность потенциалов достигает значений, соответствующих равенству двух потоков электричества в стационарных условиях и наличия небольшого слоя пространственного заряда в пленке.
Слайд 79
где D- коэффициент диффузии, - подвижность.
Потоки частиц
через 1 см2 плоскости пленки на расстоянии х от
металла:Слайд 80 Первые члены в правой части уравнения соответствуют потоку,
обусловленному градиентами концентраций носителей того и другого типа, а
вторые члены – потокам, обусловленным возникающим градиентом потенциала. Градиент потенциала – отрицателен, а концентрационные градиенты - положительныСлайд 81 Используем уравнение Эйнштейна, связывающее коэффициент диффузии с подвижностями,
и подставим уравнение (9.3) в (9.4), чтобы вычислить d/dx
Слайд 82 Поскольку полная электропроводность выражается в виде суммы
вкладов дырок и заряженных вакансий
Чтобы вычислить полный поток частиц,
который определяет скорость роста, подставим d/dx из (9.5) в (9.3б). Результирующее выражение можно упростить, если учесть, что по всей пленке.
Слайд 83
Кроме того,
так что проводимость во многом определяется первым
членом в правой части уравнения (9.6). После этого находим,
что скорость потока металла М к внешней поверхности равна:Таким образом, в результате только одной диффузии в поле возникает двойной поток.
Слайд 84 Если число ионов металла на единицу объема равно
М, скорость увеличения толщины пленки
где [VM-] –
разность концентраций вакансий на внешней поверхности и на границе раздела между пленкой и металллом.
Слайд 85
Рост пленки в этом случае описывается параболическим законом.
В
общем случае вакансии и междоузельные атомы всех типов участвуют
в реакции на поверхности. Часто однако достаточно рассмотреть лишь один тип дефектов. Например, в реакции окисления меди до Cu2O необходимо учитывать только катионные вакансии.Слайд 86 Они возникают на внешней поверхности пленки и разряжаются
на поверхности раздела окисел – медь. Концентрации [Vcu-] и
[h+] повсюду приблизительно равны и уменьшаются по линейному закону в направлении от внешней поверхности к поверхности раздела. Полученное уравнение скорости роста пленки применимо и в этом случае.Слайд 87 Можно ожидать, что концентрация вакансий меди на поверхности
раздела окисел – газ будет пропорциональна давлению кислорода в
степени 1/8:Слайд 89 Если вакансии не ионизированы, их концентрация должна зависеть
от давления в степени ¼. Экспериментально найденная зависимость является
промежуточной между указанными выражениями. Частичная ионизация не нарушает параболическую зависимость, поскольку отношение числа заряженных вакансий к числу незаряженных от концентрации не зависит.Слайд 90 Поскольку скорость реакции зависит от процесса диффузии в
твердом теле, примеси которые изменяют условия диффузии, должны приводить
к изменению скорость реакции окисления. Это наблюдалось в реакции серебра с бромом, приводящей к образованию AgBr. Если к серебру добавить кадмий, он также входит в состав продукта взаимодействия.Слайд 91 Причем на каждый ион Cd+2 приходится вакантный узел,
ранее занятый серебром. Это приводит к снижению концентрации ионов
серебра в междоузлиях и дырок, а в итоге, как следует из данных анализа, и к уменьшению скорости окисления серебра.Слайд 92 Соотношение скоростей окисления серебра с добавкой кадмия и
без добавки приблизительно равно
(1- Кf1/2[Cd]), где Кf – константа
равновесия для дефектов по Френкелю.
Слайд 93
Кинетика роста тонких пленок
Если толщина пленки менее ~
1000 А0, ее рост подчиняется несколько иным закономерностям. Так,
при исследовании тонких пленок наблюдалось три вида зависимости скорости роста тонкой пленки от времениСлайд 94 При расчете распределения потенциала и его влияния на
диффузию дефектов через пленку необходимо принимать во внимание, что
слой пространственного заряда в поверхностных областях для тонких пленок занимает значительную долю их толщины.Слайд 95 Кроме того, изменение кинетических закономерностей, вследствие изменения глубины
слоя пространственного заряда может происходить при достижении критической толщины
пленки. Это в частности относится к окисным пленкам на поверхности меди и никеля.Слайд 96 При изучении роста очень тонких пленок следует принимать
во внимание возможность ограничения скорости роста процессами переноса по
поверхности пленки, а не переносом через пленку. Процессы переноса по поверхности в свою очередь зависят от распределения потенциала в пленке в близи поверхности. Так, при окислении алюминия скорость резко падает до очень низкого значения после образования нескольких первых слоев.Слайд 97 Скорость окисления алюминия определяется стадией перехода алюминия в
виде ионов Al+3 через границу раздела металл – окисел
в междоузлия решетки окисла. Согласно теории при переходе металла в междоузлие окисла, связанного с металлом, ион металла должен преодолеть потенциальный барьер.Слайд 98 Этот барьер намного больше того, который приходится преодолевать
иону при переходе из одного междоузлия в другое, так
что скорость диффузии в самом окисле не определяет скорости окисления в целом.Вероятность того, что такой переход произойдет определяется выражением e-E/kT, где -частота колебаний атома, Е-высота барьера
Слайд 99 Скорость переходов повышается под действием электрического поля, возникающего
в результате адсорбции на внешней поверхности ионов кислорода, поскольку
они притягивают ионы Al+3 через слой окисла. Скорость роста пленки дается выражениемгде к и к’-константы, - разность потенциалов, обусловленная адсорбированными ионами кислорода
Слайд 100 Эта зависимость показывает, что при очень малой толщине
пленки скорость роста может быть большой, но с
увеличением она очень быстро уменьшается, следовательно толщина пленки почти всегда ограничена.
Слайд 101
Химические и электрохимические методы
Нанесение катодных покрытий. Разность потенциалов,
между двумя электродами, опущенными в раствор электролита, вызывает осаждение
ионов металла на катоде в виде тонкого слоя. Анодный процесс сводится к постепенному окислению и переходу ионов металла в раствор.Слайд 102 Безэлектродное нанесение покрытий. Этот процесс отличается от предыдущего
только тем, что его осуществляют без наложения внешнего электрического
поля. Таким способом обычно получают никелевые покрытия. Применение обоих методов ограничено нанесением металлических слоев на подложки, обладающие электронной проводимостью, т.е. металлы.Слайд 103 Анодное оксидирование. Этот метод применяют для нанесения тонких
оксидных слоев на поверхность таких металлов как Tl, Nb,
Zr, Al, Ti. Анод из одного из перечисленных металлов погружают в раствор соли или кислоты (электролита). Ионы кислорода, транспортируемые к аноду, разряжаясь на нем, образуют тонкий слой оксида.Слайд 104 При увеличении напряжения на электродах рост оксидной пленки
ускоряется благодаря более интенсивному выделению, и следовательно, ускоренному диффузионному
проникновению кислорода через окисленный слой. Обычно достигаемое равновесное значение толщины слоя зависит от величины приложенного напряжения.Слайд 105 Анодные оксидные слои на поверхности металла образуются также
на электродах газоразряженных трубок в условиях тлеющего разряда.
Термическое оксидирование.
Некоторые вещества, окисляясь на воздухе, покрываются инертной оксидной пленкой, препятствующей дальнейшему окислению.Слайд 106 Так, на поверхности алюминия в присутствии кислорода (в
том числе и просто на воздухе) образуется оксидная пленка,
толщина которой меняется симбатно температуре окисления, а для комнатной температуры составляет 30 – 40 А0. В результате таких гетерогенных реакций на поверхности твердых тел можно получать не только оксидные, но и другие покрытия.Слайд 107 В частности обработка некоторых металлов в атмосфере аммиака
при повышенных температурах приводит к образованию на поверхности пленок
нитридов.Покрытия, получаемые при химическом разложении паров. Этот метод используется для получения тонких кристаллических пленок высокочистых полупроводниковых материалов.
Слайд 108 Образование пленок происходит в момент разложения газов или
паров при пиролизе УФ- и ИК-фотолизе или при химическом
взаимодействии. Например:Слайд 109 смещается вправо при понижении температуры, что можно использовать
при нанесении покрытий на поверхность с температурой более низкой,
чем температура газовой фазыКроме того, могут быть использованы некоторые обратимые реакции, равновесие которых значительно смещается при изменении температуры. Например, равновесие диспропорционирования
Слайд 110 Пленки, осажденные из паровой фазы, часто наследуют структуру
подложки благодаря эпитаксиальному механизму роста. Эпитаксиальные пленки могут также
кристаллизоваться из жидкой фазы. Для этого используют охлаждение растворов осаждаемого соединения в расплавах легкоплавких металлов таких как индий или свинец.
Слайд 111
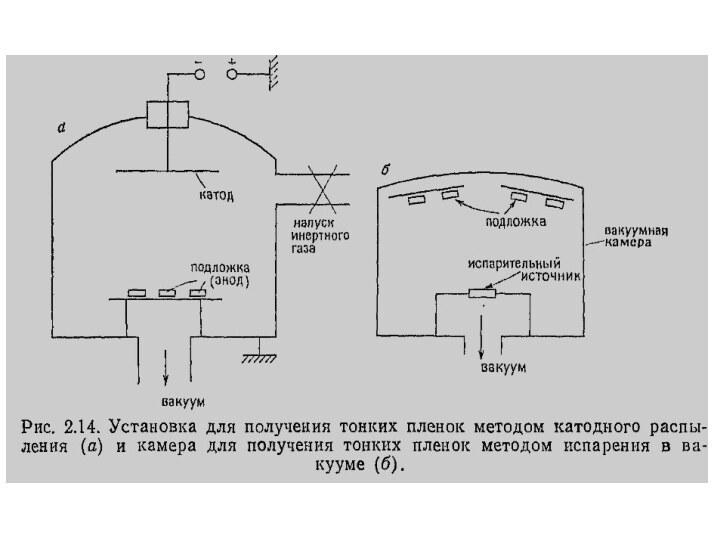
Физические методы
Катодное распыление. Схема установки изображена на рис.
2.14 а. Анод и катод расположены в камере, заполненной
инертным газом (Ar, Xe) под давлением 10 = 100 Па. Напряжение в несколько киловольт, приложенное к электродам вызывает в газе тлеющий разрядСлайд 113 Положительные ионы газа, двигаясь к катоду. Разгоняются и
бомбардируют мишень, выбивая при этом частицы материала мишени, которые
далее осаждаются на окружающие поверхности, включая подложку. Последнюю предварительно устанавливают на определенном расстоянии и под определенным углом относительно мишени.Слайд 114 В современном оборудовании для катодного распыления используют различные
усовершенствования, в том числе предотвращающие загрязнение пленки атомами или
ионами инертного газа.Испарение в вакууме как наиболее простой метод изготовления тонких пленок имеет наибольшее распространение.
Слайд 115 Таким образом получают пленки чистых металлов, сплавов, полупроводниковых
и изоляционных материалов, неорганических солей и т.п. Схема установки
изображена на рис. 2.14 б., рабочее давление в такой установке должно быть 10-1Па. Под действием электрического нагрева вещество из испаряемого источника переходит в газовую фазу и конденсируется на подложке.Слайд 116 Выбор материала подложки диктуется назначением и требованиями к
качеству напыляемой пленки. В частности для пленок, применяемых в
электронике, подложка, выполняющая роль механической основы, должна быть изолятором. Типичные материалы таких подложек – керамика из Al2O3, стекла, галогениды щелочных металлов, кремний, германий…Слайд 117 Материал контейнера – испарителя, выдерживающий очень высокие температуры,
должен быть инертен по отношению к испаряемому веществу. Для
этой цели используют тантал, вольфрам и молибден. Нередко очень важна чистота поверхности подложки, подвергаемой напылению. В частности, глубокая очистка подложки необходима для хорошей адгезии пленки и получения пленок высокочистых веществ.
Слайд 118
Выращивание монокристаллов
Монокристаллы могут быть получены при кристаллизации из
газовой, жидкой и твердой фаз. Однако монокристаллы с размерами,
пригодными для практического использования или измерения свойств, обычно получают только из газовой или жидкой сред.
Слайд 119
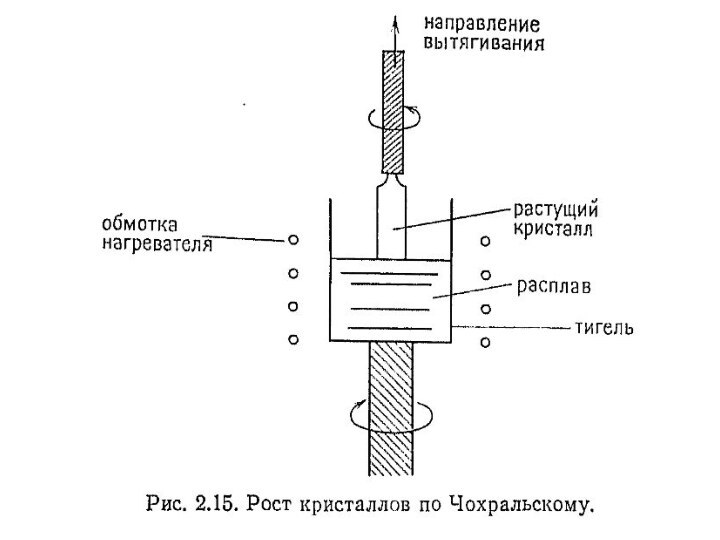
Метод Чохральского
Этот метод в основном применяется для получения
монокристаллов, состав которых тождественен исходному расплаву. Затравочный кристалл приводят
в соприкосновение с поверхностью расплава, температура которого немного превышает температуру расплава.Слайд 120 При постепенном движении затравки вверх на ее поверхности,
обращенной к расплаву, происходит кристаллизация, в результате чего получаются
удлиненные кристаллы с той же кристаллографической ориентацией, которой обладала затравка. При вытягивании кристалла расплав и кристалл вращаются в противоположных направлениях (рис. 2 15).Слайд 122 Это позволяет уменьшить температурные и концентрационные неоднородности при
кристаллизации и таким образом улучшить качество полученного монокристалла.
Метод Чохральского
широко используется при получении монокристаллов полупроводниковых материалов таких как Si, Ge, GaAs.Слайд 123 Для предотвращения потерь за счет испарения при работе
с летучими элементами (As, P и др.) процесс проводят
как правило при высоком давлении инертного газа. Выращиваются также и более сложные по составу материалы, например легированный неодимом Ca(NbO3)2, применяемый в качестве рабочего вещества в лазерах.
Слайд 124
Метод Бриджмена и Стокбаргера
Эти методы также основаны на
кристаллизации расплава, стехиометрия которого в точности соответствует стехиометрии будущего
кристалла. Однако в этом методе кристаллизация осуществляется в наиболее холодной части расплава, находящегося в зоне с температурным градиентом.Слайд 125 В методе Стокбаргера это осуществляется путем относительного перемещения
расплава и градиентной зоны, а в методе Бриджмена –
путем постепенного охлаждения печи с температурным градиентом, в которой неподвижно расположен расплав. Рекомендуют также вводить затравку и контролировать состав газовой фазы.
Слайд 128
Зонная плавка
Этот метод похож на метод Стокбаргера, однако
температурный профиль печи таков, что только небольшая часть вещества,
из которой должен расти монокристалл, в каждый момент времени находится в расплавленном состоянии (рис. 2.16 в). Вначале плавят ту часть вещества, которая примыкает к затравочному кристаллуСлайд 131 При дальнейшем протягивании лодочки через печь и последовательном
плавлении остального вещества происходит направленная кристаллизация. На этом принципе
основана также зонная очистка – широко известный метод очистки твердых тел. Используя тот факт, что примеси концентрируются преимущественно в расплаве, постепенно перемещая зону расплава, их “выгоняют” из расплаваСлайд 132 Метод зонной плавки используют для очистки и роста
монокристаллов даже таких тугоплавких металлов, как вольфрам
Слайд 133
Кристаллизация из растворов или расплавов
В отличие от предыдущих
методов, в которых расплав затвердевает в виде кристаллов тождественного
состава, в методе кристаллизации из растворов состав полученного кристалла отличается от состава раствора. Растворитель может быть одним из компонентов будущего кристалла или нет.Слайд 134 Например, кристаллы SiO2 и различных силикатов с высокими
температурами плавления получают из расплавов легкоплавких боратов или галогенидов,
в которых интересующий компонент растворен.В этих и подобных случаях расплав-растворитель выполняют роль флюса, понижающего температуру плавления целевого кристаллического продукта.





























