Слайд 2
Строение металлов
Все вещества в твердом состоянии
могут иметь:
кристаллическое строение;
аморфное строение.
В аморфном
веществе атомы расположены хаотично, а в кристаллическом — в строго определенном порядке.
Все металлы в твердом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки.
Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристалли-ческой ячейкой.
Слайд 3
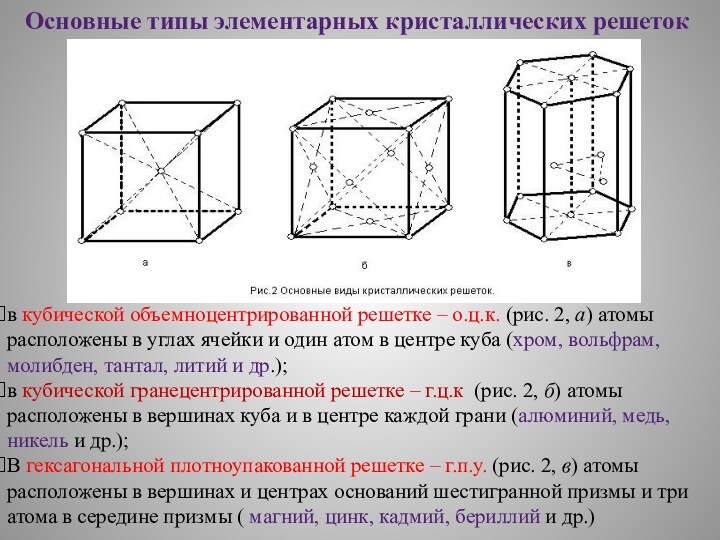
Основные типы элементарных кристаллических решеток
в кубической объемноцентрированной решетке
– о.ц.к. (рис. 2, а) атомы расположены в углах
ячейки и один атом в центре куба (хром, вольфрам, молибден, тантал, литий и др.);
в кубической гранецентрированной решетке – г.ц.к (рис. 2, б) атомы расположены в вершинах куба и в центре каждой грани (алюминий, медь, никель и др.);
В гексагональной плотноупакованной решетке – г.п.у. (рис. 2, в) атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома в середине призмы ( магний, цинк, кадмий, бериллий и др.)
Слайд 4
Механизм и закономерности кристаллизации металлов
Любое вещество может находиться
в трех агрегатных состояниях:
твердом;
жидком;
газообразном.
Возможен переход
из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
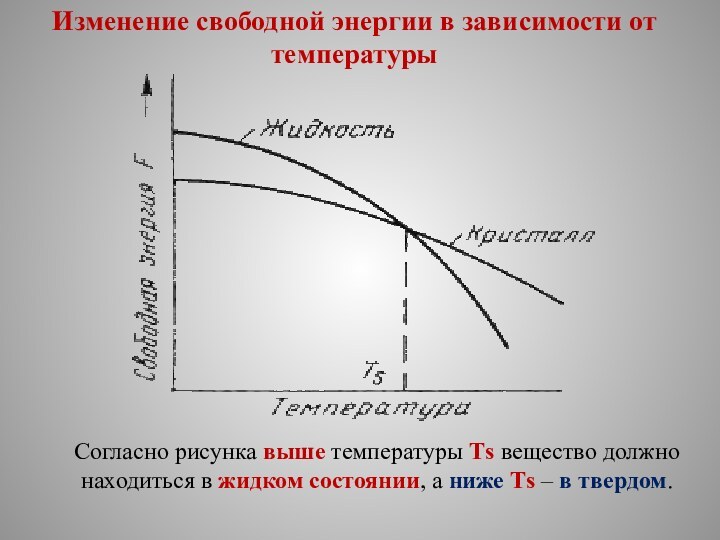
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний.
Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1.
Слайд 5
Изменение свободной энергии в зависимости от температуры
Согласно рисунка
выше температуры Тs вещество должно находиться в жидком состоянии,
а ниже Тs – в твердом.
Слайд 6
Пояснения к механизму кристаллизации
При температуре равной Тs жидкая
и твердая фаза обладают одинаковой энергией, металл в обоих
состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго.
Температура Тs – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы.
Это возможно при охлаждении жидкости ниже температуры Тs.
Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации.
Слайд 7
Переход металла из жидкого состояния в твердое
При нагреве
всех кристаллических тел наблюдается четкая граница перехода из твердого
состояния в жидкое.
Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
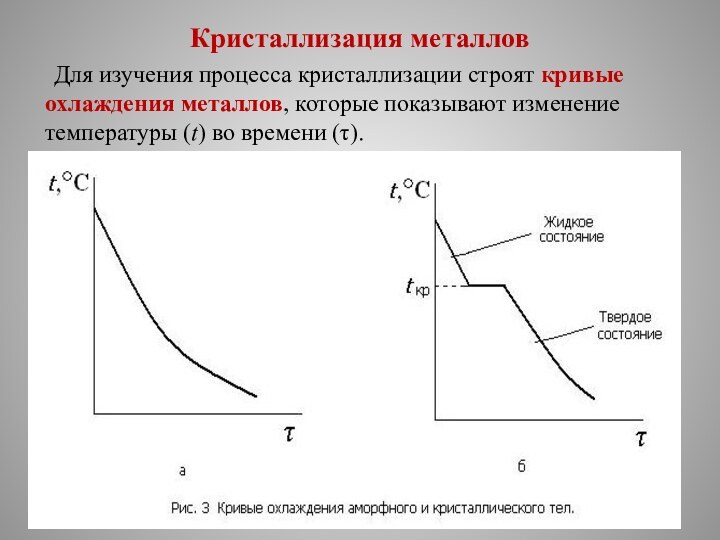
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура , так называемые кривые охлаждения чистого металла.
Слайд 8
Кристаллизация металлов
Для изучения процесса кристаллизации
строят кривые охлаждения металлов, которые показывают изменение температуры (t)
во времени (τ).
Слайд 9
Затвердевание аморфного вещества (рис. 3, а) происходит постепенно,
без резко выраженной границы между жидким и твердым состоянием.
На
кривой охлаждения кристаллического вещества (рис. 3, б) имеется горизонтальный участок с температурой tкр, называемой температурой кристаллизации.
Наличие этого участка говорит о том, что процесс сопровож-дается выделением скрытой теплоты кристаллизации.
Длина горизонтального участка — это время кристалли-зации.
Кристаллизация металла происходит постепенно. Она объединяет два процесса, происходящих одновременно:
возникновение центров кристаллизации;
рост кристаллов.
В процессе кристаллизации когда растущий кристалл окружен жидкостью, он имеет правильную геометрическую форму.
Слайд 10
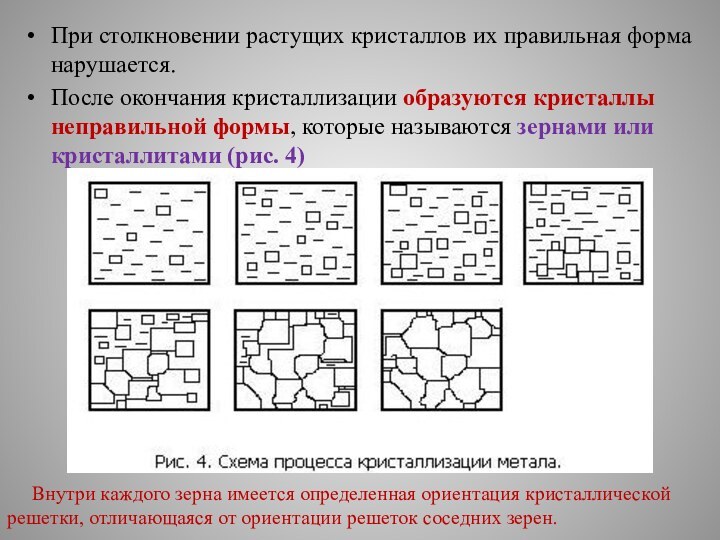
При столкновении растущих кристаллов их правильная форма нарушается.
После окончания кристаллизации образуются кристаллы неправильной формы, которые называются
зернами или кристаллитами (рис. 4)
Внутри каждого зерна имеется определенная ориентация кристаллической решетки, отличающаяся от ориентации решеток соседних зерен.
Слайд 11
Полиморфизм
Некоторые металлы в зависимости от температуры могут существовать
в различных кристаллических формах.
Это явление называется полиморфизм или
аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями.
Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением.
Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре.
Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Слайд 12
Полиморфизм железа
Полиморфные превращения характери-зуются горизонтальными участками на кривой
охлаждения, так как при них происходит полная перекристал-лизация металла.
До
911°С устойчиво Feα, имеющее кубическую объемноцентрированную решетку.
В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ.
До 768 °С железо магнитно, а выше — немагнитно.
Слайд 13
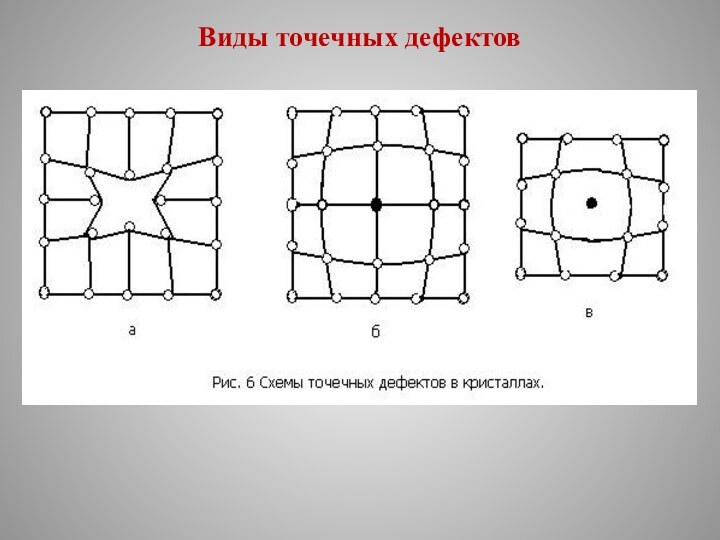
Дефекты кристаллического строения
Реальный металлический кристалл
всегда имеет дефекты кристаллического строения, которые подразделяются на:
точечные;
линейные;
поверхностные.
Точечные дефекты малы во всех трех измерениях.
К точечным дефектам относятся:
вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а);
замещенные атомы примеси (рис. 6, б);
внедренные атомы (рис. 6, в), которые могут быть как примесными, так и атомами основного металла.
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
Слайд 15
Описание точечных дефектов
Вакансия – отсутствие атомов в узлах
кристаллической решетки, «дырки», которые образовались в результате различных причин:
при переходе атомов с поверхности в окружающую среду;
при выходе атомов из узлов решетки на поверхность (границы зерен, пустоты, трещины и т. д. ).
Вакансии образуются либо в результате пластической деформации, либо при облучении тела атомами или частицами высоких энергий.
Концентрация вакансий в значительной степени определяет-ся температурой тела.
Перемещаясь по кристаллу, одиночные вакансии могут встречаться и объединяться в дивакансии.
Скопление многих вакансий может привести к образованию пор и пустот.
Слайд 16
Дислоцированный атом – это атом, вышедший из узла
решетки и занявший место в междоузлие (внедренный атом).
Концентрация
дислоцированных атомов значительно меньше, чем вакансий, так как для их образования требуются существенные затраты энергии.
При этом на месте переместившегося атома образуется вакансия.
Замещенные (примесные) атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии.
При перемещении по материалу дефекты могут взаимодейст-вовать.
Слайд 17
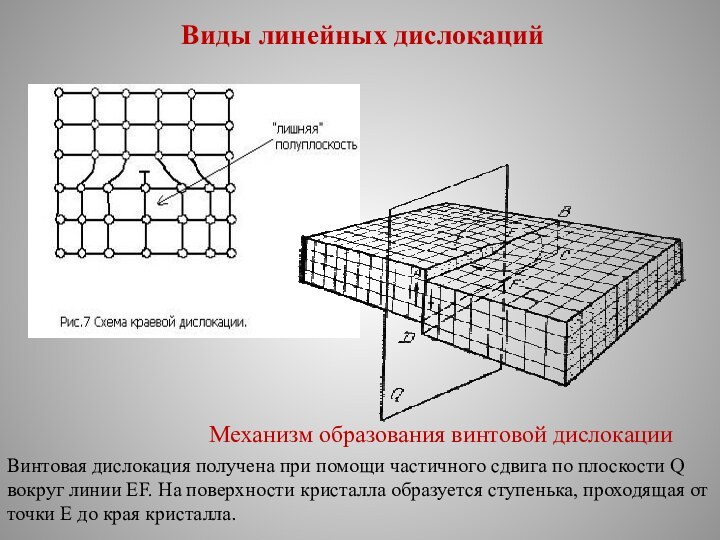
Линейные дефекты
Дефекты, имеющие малые размеры в
двух измерениях и большую протяженность в третьем, называются линейными.
Основными
линейными дефектами являются дислокации.
Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла.
Дислокация – это дефекты кристаллического строения, пред-ставляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.
Простейшие виды дислокаций – краевые и винтовые.
Большинство дислокаций образуются путем сдвигового механизма.
Слайд 18
Виды линейных дислокаций
Механизм образования винтовой дислокации
Винтовая дислокация получена
при помощи частичного сдвига по плоскости Q вокруг линии
EF. На поверхности кристалла образуется ступенька, проходящая от точки Е до края кристалла.
Слайд 19
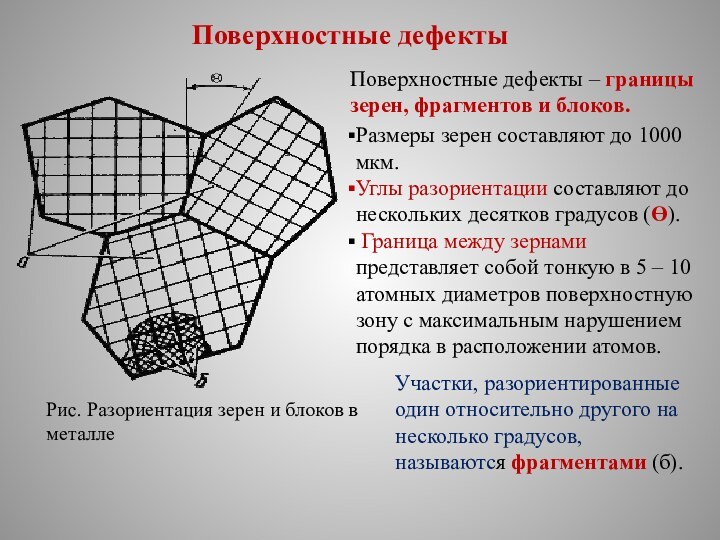
Поверхностные дефекты
Рис. Разориентация зерен и блоков в
металле
Поверхностные дефекты – границы зерен, фрагментов и блоков.
Размеры
зерен составляют до 1000 мкм.
Углы разориентации составляют до нескольких десятков градусов (ϴ).
Граница между зернами представляет собой тонкую в 5 – 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов.
Участки, разориентированные один относительно другого на несколько градусов, называются фрагментами (б).
Слайд 20
Металлические сплавы
Металлическим сплавом называется материал, полученный сплавлением двух
или более металлов или металлов с неметаллами, обладающий металлическими
свойствами.
Вещества, которые образуют сплав называются компонентами.
Фазой называют однородную часть сплава, характеризующуюся определенными составом и строением и отделенную от других частей сплава поверхностью раздела.
Под структурой понимают форму, размер и характер взаимного расположения фаз в металлах и сплавах.
Структурными составляющими называют обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями.
Слайд 21
Виды сплавов по структуре
По характеру взаимодействия компонентов все
сплавы подразделяются на три основных типа:
механические смеси;
химические
соединения;
твердые растворы.
Сплавы механические смеси образуются, когда компоненты А и В:
не способны к взаимному растворению в твердом состоянии;
не вступают в химическую реакцию с образованием соединения.
Механические смеси образуются между элементами, значи-тельно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше, чем между разнородными.
Слайд 22
Схема микроструктуры механической смеси (на рис.)
В сплавах сохраняются кристаллические решетки компонентов.
Структура механических смесей неоднородная, состоящая из отдельных зерен компонента А и компонента В.
Свойства механических смесей зависят от количественного соотношения компонентов: чем больше в сплаве данного компонента, тем ближе к его свойствам свойства смеси.
Слайд 23
Сплавы химические соединения
Сплавы химические соединения образуются между элементами,
значительно различающимися по строению и свойствам, если сила взаимодействия
между разно-родными атомами больше, чем между однородными.
Химическое соединение образуется когда компоненты сплава А и В вступают в химическое взаимодействие.
Для химических соединений характерно постоянство состава, то есть сплав образуется при определенном соотношении компонентов, химическое соединение обозначается АmВn .
Химическое соединение имеет свою кристаллическую решетку, которая отличается от кристаллических решеток компонентов.
Химические соединения имеют однородную структуру, состоящую из одинаковых по составу и свойствам зерен.
Слайд 24
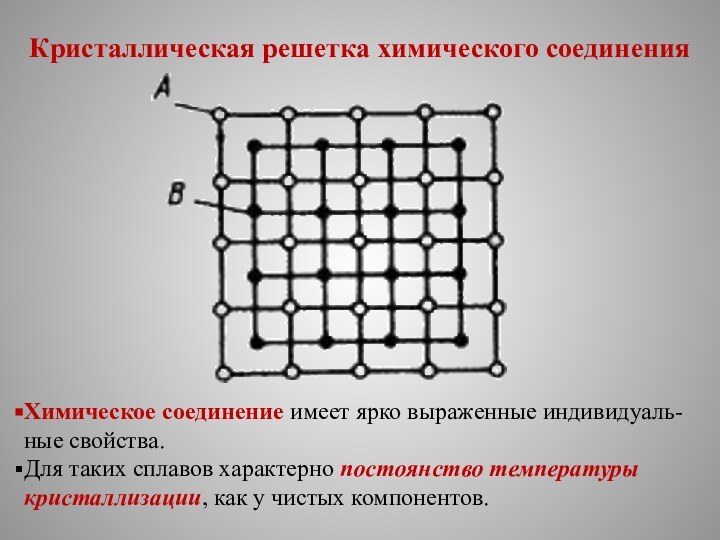
Кристаллическая решетка химического соединения
Химическое соединение имеет ярко выраженные
индивидуаль-ные свойства.
Для таких сплавов характерно постоянство температуры кристаллизации, как
у чистых компонентов.
Слайд 25
Сплавы твердые растворы
Сплавы твердые растворы – это твердые
фазы, в которых соотношения компонентов могут изменяться.
Сплавы твердые
растворы являются кристаллическими веществами.
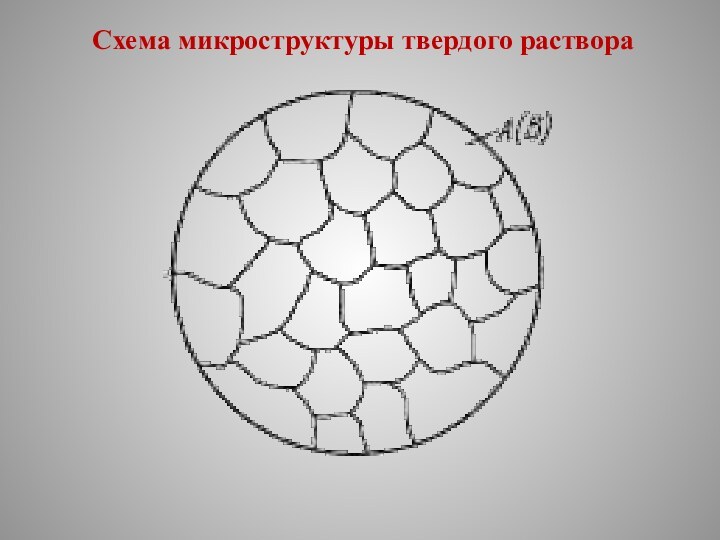
Характерной особенностью твердых растворов является: наличие в их кристаллической решетке разнородных атомов при сохранении типа решетки растворителя.
Твердый раствор состоит из однородных зерен.
При образовании твердого раствора атомы одного компонента входят в кристаллическую решетку другого.
Слайд 26
Схема микроструктуры твердого раствора
Слайд 27
Классификация сплавов твердых растворов
По степеням растворимости компонентов различают
твердые растворы:
с неограниченной растворимостью компонентов;
с ограниченной растворимостью компонентов.
При неограниченной
растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку раство-ренного компонента.
При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела.
При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси.
Слайд 28
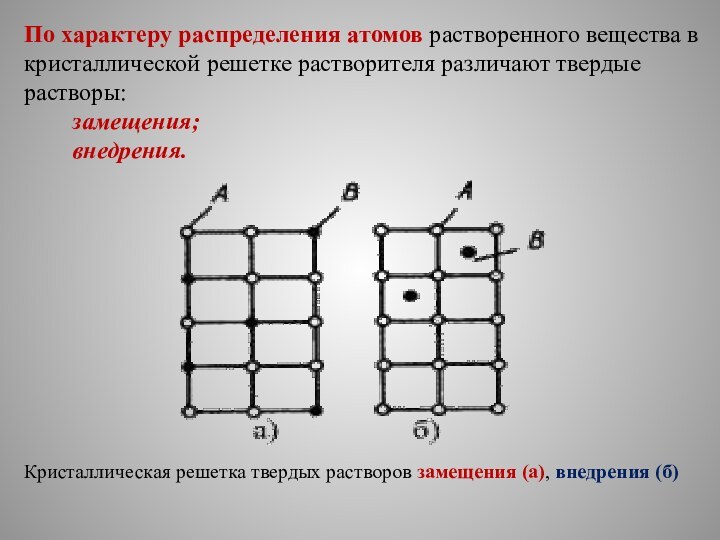
По характеру распределения атомов растворенного вещества в кристаллической
решетке растворителя различают твердые растворы:
замещения;
внедрения.
Кристаллическая решетка твердых растворов замещения (а), внедрения (б)
Слайд 29
Твердые растворы замещения
В растворах замещения в кристаллической решетке
растворителя часть его атомов замещена атомами растворенного элемента (а).
Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя.
Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются.
В первом приближении это изменение пропорционально концентрации растворенного компонента.
Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств.
Уменьшение параметра ведет к большему упрочнению, чем его увеличение.
Слайд 30
Твердые растворы внедрения
Твердые растворы внедрения образуются внедрением атомов
растворенного компонента в поры кристаллической решетки растворителя.
Образование таких
растворов возможно, если атомы растворенного элемента имеют малые размеры.
Такими являются элементы, находящиеся в начале периодической системы Менделеева:
углерод;
водород;
азот;
бор.
Если размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла - это вызывает искажение решетки и возникновение в ней напряжения.
Концентрация таких растворов не превышает 2-2,5%.
Слайд 31
Кристаллизация сплавов
Кристаллизация сплавов подчиняется тем же закономер-ностям, что
и кристаллизация чистых металлов.
Основным отличием является большая роль
диффузионных процессов между жидкостью и кристаллизующейся фазой.
Эти процессы необходимы для перераспределения разнород-ных атомов, равномерно распределенных в жидкой фазе.
В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные:
аллотропическими превращениями компонентов сплава;
распадом твердых растворов;
выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры.
Слайд 32
Эти превращения называют фазовыми превращениями в твердом состоянии.
При перекристаллизации в твердом состоянии образуются центры кристаллизации и
происходит их рост.
Твердый раствор существует не при строго определенном соотношении компонентов, а в интервале концентраций.
Обозначают твердые растворы строчными буквами греческого алфавита: α, β, γ, δ и т. д.
Процессы кристаллизации сплавов изучаются по диаграммам состояния.
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры.
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Слайд 33
Построение диаграмм состояния наиболее часто осуществляется при помощи
термического анализа.
В результате получают серию кривых охлаждения, на
которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Диаграмма состояния строится экспериментально по кривым охлаждения сплавов.
Слайд 35
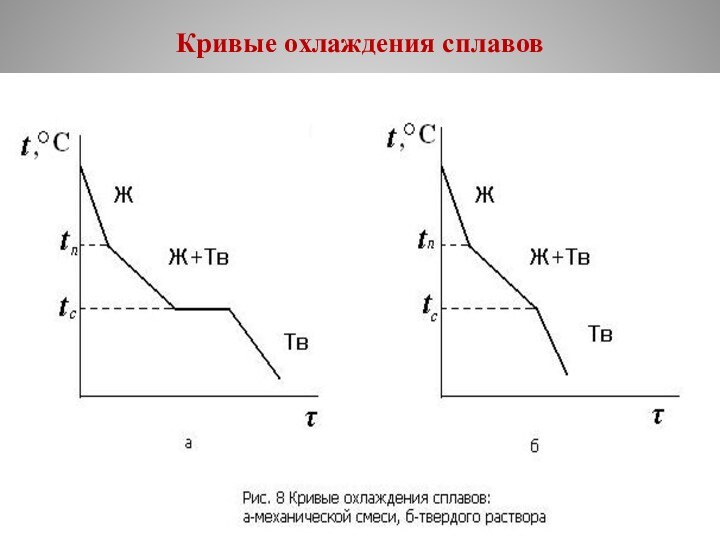
Пояснения к кривым охлаждения
В отличие от чистых металлов
сплавы кристаллизуются не при постоянной температуре, а в интервале
температур.
Температуры, соответствующие фазовым превращениям, называют критическими точками.
На кривых охлаждения сплавов имеется две критические точки:
в верхней критической точке, называемой точкой ликвидус (tл), начинается кристаллизация;
в нижней критической точке, которая называется точкой солидус (tc), кристаллизация завершается.
Кривая охлаждения механической смеси (рис. 8, а) отличается от кривой охлаждения твердого раствора (рис. 8, б) наличием горизонтального участка.
На этом участке происходит кристаллизация эвтектики.
Эвтектикой называют механическую смесь двух фаз, одновременно кристаллизовавшихся из жидкого сплава.
Слайд 36
Эвтектика имеет определенный химический состав и образуется при
постоянной температуре.
Диаграмма состояния показывает строение сплава в зависи-мости от
соотношения компонентов и от температуры.
Температуры, соответствующие фазовым превращениям, называют критическими точками.
Линии диаграммы состояния:
линия, на которой при охлаждении начинается кристаллизация сплава, называется линией ликвидус;
линия, на которой кристаллизация завершается — линией солидус.
Все типы сплавов имеют разные виды диаграмм состояния.
Слайд 37
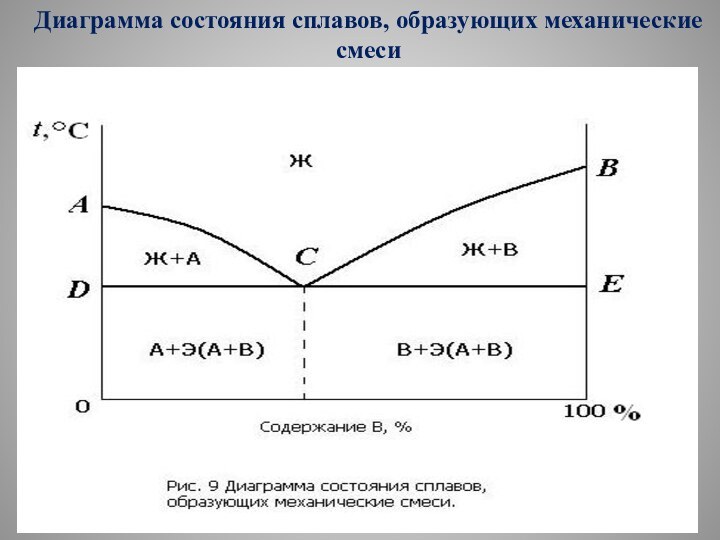
Диаграмма состояния сплавов, образующих механические смеси
Слайд 38
Пояснения к диаграмме состояния
Диаграмма состояния сплавов, образующих механические
смеси (рис. 9), характеризуется отсутствием растворения компонентов в твердом
состоянии.
Поэтому в этом сплаве возможно образование трех фаз:
жидкого сплава Ж;
кристаллов А;
кристаллов В.
Линия АСВ диаграммы является линией ликвидус:
на участке АС при охлаждении начинается кристаллизация компонента А;
на участке СВ начинается кристаллизация компонента В.
Слайд 39
Линия DСЕ является линией солидус, на ней завершается
кристаллизация компонента А или В и при постоянной температуре
происходит кристаллизация эвтектики Э.
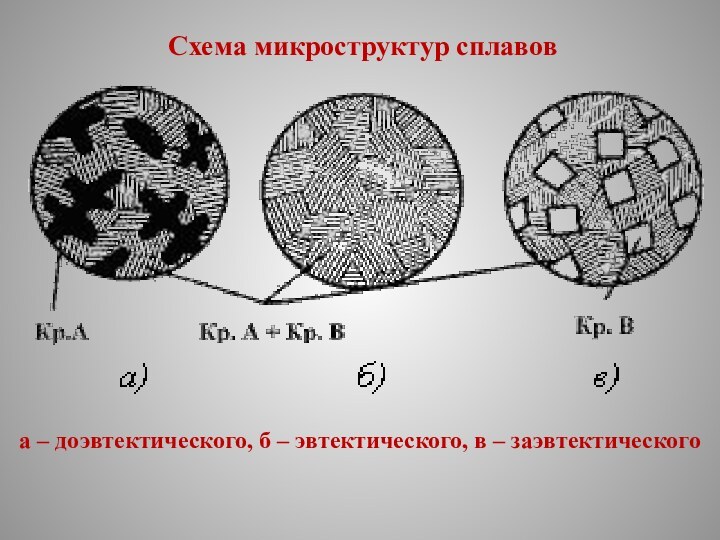
Сплавы, концентрация которых соответствует точке С диаграммы называются эвтектическими, их структура представляет собой чистую эвтектику.
Эвтектикой называют механическую смесь двух фаз, одновременно кристаллизовавшихся из жидкого сплава.
Сплавы, расположенные на диаграмме левее эвтектичес-кого, называются доэвтектическими, их структура состоит из зерен А и эвтектики.
Сплавы, которые на диаграмме расположены правее эвтектического, называются заэвтектическими, их структура представляет собой зерна В, окруженные эвтектикой.
Слайд 40
Схема микроструктур сплавов
а – доэвтектического, б – эвтектического,
в – заэвтектического
Слайд 41
Диаграммы состояния твердых растворов
Слайд 42
Пояснения к диаграмме
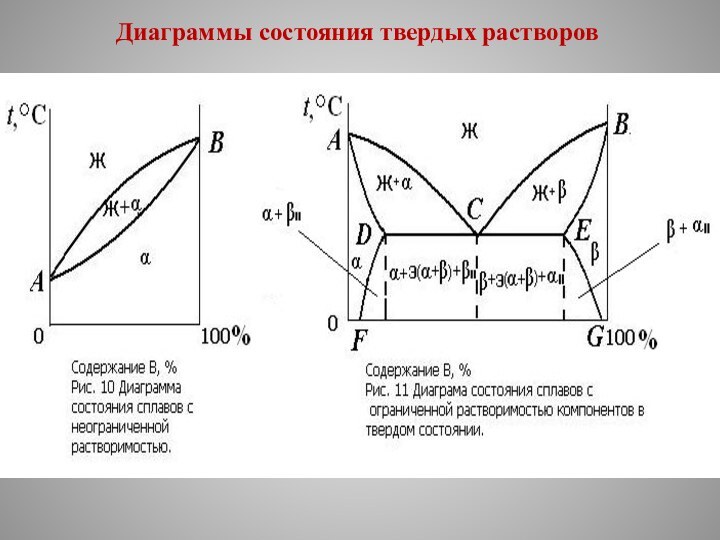
Диаграмма состояния сплавов с неограниченной растворимостью
компонентов в твердом состоянии изображена на рис. 10.
Для
этого сплава возможно образование двух фаз: жидкого сплава и твердого раствора а.
На диаграмме имеется всего две линии, верхняя является линией ликвидус, а нижняя — линией солидус.
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии показана на рис 11.
В этом сплаве могут существовать три фазы:
жидкий сплав;
твердый раствор α компонента В в компоненте А;
твердый раствор β компонента А в компоненте В.
Слайд 43
Линия АСВ является линией ликвидус, линия АDСЕВ —
линией солидус.
Здесь также образуется эвтектика, имеются сплавы :
эвтектический;
доэвтектический;
заэвтектический.
По линиям FD и EG происходит выделение вторичных кристаллов αII и βII (вследствие уменьшения растворимости с понижением температуры).
Процесс выделения вторичных кристаллов из твердой фазы называется вторичной кристаллизацией.
Слайд 44
Диаграмма состояния сплавов, образующих химическое соединение
Слайд 45
Пояснения к диаграмме
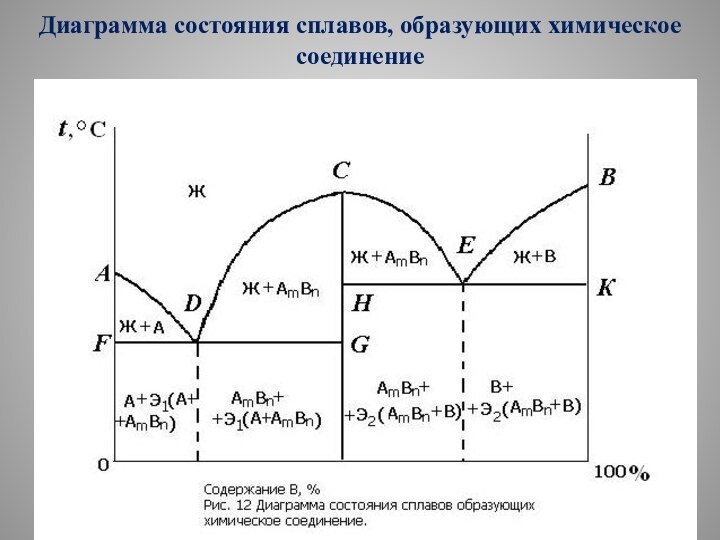
Диаграмма состояния сплавов, образующих химическое соединение
(рис. 12) характеризуется наличием вертикальной линии, соответствующей соотношением компонентов
в химическом соединении АmВn.
Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых одним из компонентов с химическим соединением.
На рисунке изображена диаграмма для случая, когда каждый из компонентов образует с химическим соединением механи-ческую смесь.
Слайд 46
Сплавы железа с углеродом
Характеристики железа
Твердость - НВ
80;
Температура плавления — 1539 °С;
Плотность 7,83 г/см3.
С углеродом железо образует химическое соединение и твердые растворы.
Цементит — это химическое соединение железа с углеродом (карбид железа) Fe3С.
Характеристики цементита
Содержание углерода - 6,67 % (по массе).
Сложная ромбическая кристаллическая решетка.
Высокая твердость - НВ 800;
Низкая пластичность и хрупкость.
Слайд 47
Ферритом называется твердый раствор углерода в α- железе.
Содержание углерода в феррите очень невелико — максималь-ное 0,02%
при температуре 727 °С.
Из-за малого содержания углерода свойства феррита совпадают со свойствами железа (низкая твердость и высокая пластичность).
Твердый раствор углерода в высокотемпературной модификации Feα (т. е. в Feδ) называют δ - ферритом или высокотемператур-ным ферритом.
Аустенит — это твердый раствор углерода в γ- железе.
Свойства аустенита
Максимальное содержание углерода - 2,14 % (при темпера-туре 1147 °С);
Твердость - НВ 220.
Слайд 48
Перлит — это механическая смесь феррита с цементитом.
Характеристики перлита
Содержание углерода - 0,8% ;
Образуется из аустенита
при температуре 727°С.
Пластинчатое строение, т.е. его зерна состоят из чередующихся пластинок феррита и цементита;
Является эвтектоидом - механической смесью двух фаз, образующейся из твердого раствора (а не из жидкого сплава, как эвтектика).
Ледебурит - это эвтектическая смесь аустенита с цементитом.
Ледебурит содержит 4,3 % углерода, образуется из жидкого сплава при температуре 1147 °С.
Слайд 49
Фаза цементита имеет пять структурных форм:
цементит первичный,
образующийся из жидкого сплава;
цементит вторичный, образующийся из аустенита;
цементит третичный, образующийся из феррита;
цементит ледебурита;
цементит перлита.
Слайд 51
Пояснения к диаграмме
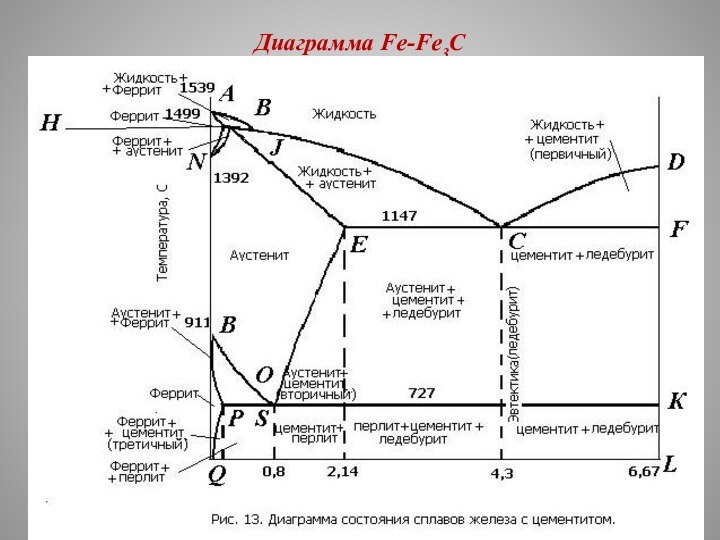
На горизонтальной оси концентраций отложено содержание
углерода от 0 до 6,67 %.
Левая вертикальная ось
соответствует 100 % содержанию железа.
На ней отложены температура плавления железа и температуры его полиморфных превращений.
Правая вертикальная ось (6,67 % углерода) соответствует 100% содержанию цементита.
Линия АВСД диаграммы является линией ликвидус.
На ней начинается кристаллизация:
на участке АВ — феррита;
на участке ВС — аустенита;
на участке СД — первичного цементита.
Линия AHJECF является линией солидус диаграммы.
Слайд 52
Железоуглеродистые сплавы
Железоуглеродистые сплавы в зависимости от содержания углерода
делятся на:
техническое железо (до 0,02 % С);
сталь
(от 0,02 до 2,14 % С);
чугун (от 2,14 до 6,67 % С).
Сталь называется при содержании углерода:
до 0,8 % С - доэвтектоидной;
0,8 % С — эвтектоидной;
свыше 0,8 % С — заэвтектоидной.
Чугун называется при содержании углерода:
от 2,14 до 4,3 % С - доэвтектическим;
ровно 4,3% С — эвтектическим;
от 4,3 до 6,67 % С — заэвтектическим.
Слайд 53
Структура железоуглеродистых сталей
Структура технического железа представляет собой зерна
феррита или феррит с небольшим количеством третичного цементита.
Микроструктуры
технического железа:
а – содержание углерода менее 0,006%;
б – содержание углерода 0,006…0,02 %
Слайд 54
Углеродистые стали
Обязательной структурной составляющей стали является перлит:
структура
доэвтектоидной стали, состоит из равномерно распределенных зерен феррита и
перлита (Ф+П) - содержание углерода ;
эвтектоидная сталь состоит только из перлита (П) - содержание углерода С=0,8 % (перлит может быть пластинчатым или зернистым).
структура заэвтектоидной стали представляет собой зерна перлита, окруженные сплошной или прерывистой сеткой вторичного цементита (П+Ц2) - содержание углерода
.
По микроструктуре сплавов можно приблизительно определить количество углерода в составе сплава, учитывая следующее: количество углерода в перлите составляет 0,8 %, в цементите – 6,67 %.
Ввиду малой ратворимости углерода в феррите, принимается, что в нем углерода нет. .
Слайд 55
Микроструктура сталей
а – доэвтектоидная сталь ; б –
эвтектоидная сталь (пластинчатый перлит); в – эвтектоидная сталь (зернистый
перлит); г – заэвтектоидная сталь
Слайд 56
Чугуны
Сплавы железа с углеродом, содержащие углерода более 2,14
% (до 6,67 %), заканчивающие кристаллизацию образованием эвтектики (ледебурита),
называют чугунами.
Наличие легкоплавкого ледебурита в структуре чугунов повышает их литейные свойства.
Чугуны, кристаллизующиеся в соответствии с диаграммой состояния железо – цементит, отличаются высокой хрупкостью.
Цвет их излома – серебристо-белый.
Такие чугуны называются белыми чугунами.
Для чугуна характерно наличие ледебурита в структуре:
структура доэвтектического чугуна состоит из перлита, вторичного цементита и ледебурита (П+Л+Ц2) – содержание углерода ;
эвтектического — из ледебурита (Л) - содержание углерода С=4,3%;
заэвтектического — из ледебурита и первичного цементита (Л+Ц1) - содержание углерода .