Слайд 2
Редактирование генома
Набор молекулярно-биологических методов по направленной модификации
(делеции, вставки, точечные замены) геномной ДНК с использованием искусственных
высокоспецифичных сайт-направленных нуклеаз (молекулярных ножниц).
Genome Editing with Engineered Nucleases (GEEN)
Недостатки предшествующих технологий:
Ограниченный круг организмов (гомологичная рекомбинация у дрожжей или “recombineering” (recombination-mediated genetic engineering) у мышей),
Необходимость использования селективных маркеров (антибиотиков),
Наличие остаточных последовательностей ДНК (loxP sites from Cre recombinase-mediated excision).
Слайд 3
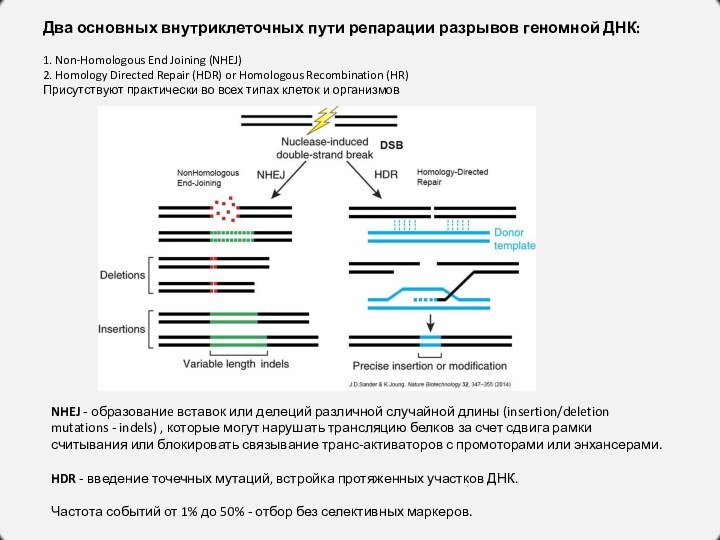
Два основных внутриклеточных пути репарации разрывов геномной ДНК:
1.
Non-Homologous End Joining (NHEJ)
2. Homology Directed Repair (HDR)
or Homologous Recombination (HR)
Присутствуют практически во всех типах клеток и организмов
NHEJ - образованиe вставок или делеций различной случайной длины (insertion/deletion mutations - indels) , которые могут нарушать трансляцию белков за счет сдвига рамки считывания или блокировать связывание транс-активаторов с промоторами или энхансерами.
HDR - введение точечных мутаций, встройка протяженных участков ДНК.
Частота событий от 1% до 50% - отбор без селективных маркеров.
Слайд 4
4 типа или семейства искусственных сайт-направленных нуклеаз:
1. Meganucleases
(re-engineered homing endonucleases)
2. ZFNs (Zinc Finger Nucleases)
3. TALENs (Transcription
Activator-Like Effector Nucleases)
4. CRISPR/Cas System (Clustered Regularly Interspaced Short Palindromic Repeats/Cas9 Nuclease)
Слайд 5
Мегануклеазы
Мегануклеазы - искусственно сконструированные варианты природных эндонуклеаз рестрикции,
хоминг нуклеаз (homing nuclease), с протяженными сайтами узнавания от
14 до 40 пн.
"Эгоистичные" белки – обеспечивают перемещение собственного нуклеазного гена и фланкирующих его последовательностей по геному.
Впервые обнаружены в 1990-х годах.
Известно несколько сотен мегануклеаз с различными сайтами узнавания длиной до 40 пн.
Последовательности узнавания вырождены.
Основной способ получения новых искусственных нуклеаз - введение аминокислотных замен в сайты узнавания с последующим анализом и отбором.
Основной недостаток - ограниченность набора сайтов узнавания и большая трудоемкость получения новых нуклеаз с заданной специфичностью.
Слайд 6
Zinc Finger Nucleases (ZFNs)
Цинковый палец - небольшой домен
в составе ДНК-связывающих белков (около 20 аминокислотных остатков), содержащий
ионы цинка.
Часто встречается в составе транскрипционных факторов, обеспечивая их специфическое связывание с промоторами.
В зависимости от аминокислотного состава цинковые пальцы могут распознавать и связываться с различными фрагментами ДНК длиной от 3-х до 6-ти нп.
В состав ДНК-связывающего домена (DNA Binding Domain, DBD) входит более 3-х цинковых пальцев.
ZFNs получают слиянием ДНК-связывающего домена (DNA Binding Domain, DBD), образованного набором цинковых пальцев определенной специфичности, с ДНК-разрезающим центром какой либо рестриктазы, обычно FokI.
Новые ZFNs желаемой специфичности конструируют путем различной комбинации цинковых пальцев, распознающих 3 пн.
В свою очередь, цинковые пальцы с новой специфичностью получают, используя технологии фагового дисплея, one- or two-hybrid system в дрожжах и бактериях.
Слайд 7
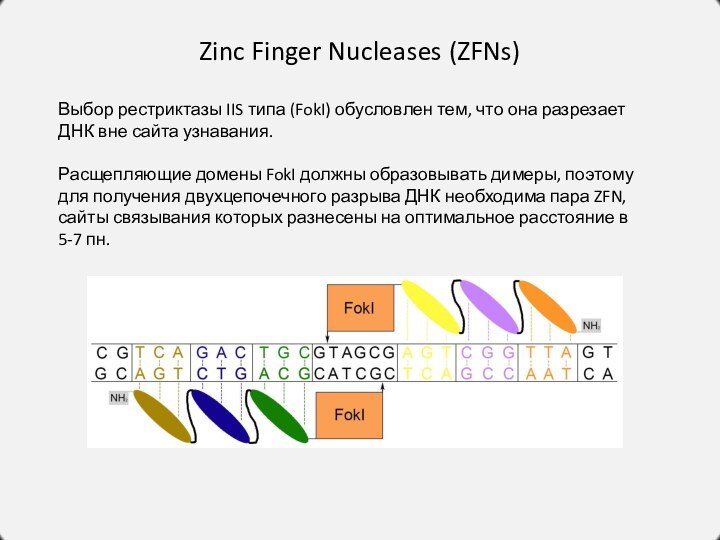
Zinc Finger Nucleases (ZFNs)
Выбор рестриктазы IIS типа (FokI)
обусловлен тем, что она разрезает ДНК вне сайта узнавания.
Расщепляющие
домены FokI должны образовывать димеры, поэтому для получения двухцепочечного разрыва ДНК необходима пара ZFN, сайты связывания которых разнесены на оптимальное расстояние в 5-7 пн.
Слайд 8
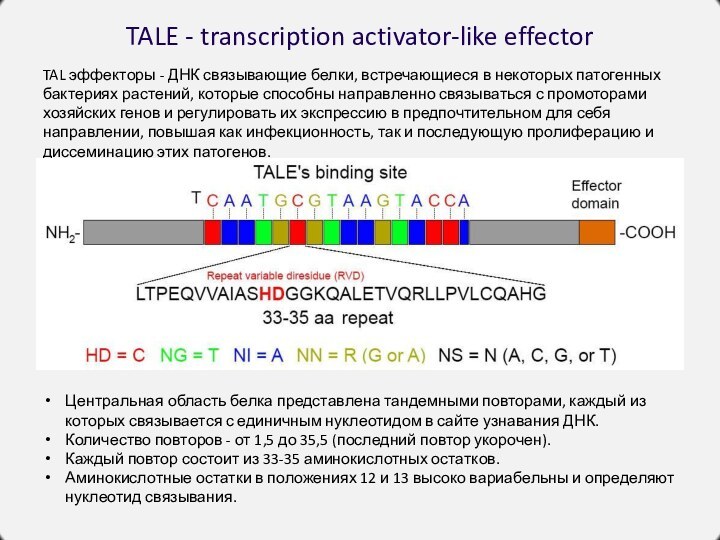
TALE - transcription activator-like effector
TAL эффекторы -
ДНК связывающие белки, встречающиеся в некоторых патогенных бактериях растений,
которые способны направленно связываться с промоторами хозяйских генов и регулировать их экспрессию в предпочтительном для себя направлении, повышая как инфекционность, так и последующую пролиферацию и диссеминацию этих патогенов.
Центральная область белка представлена тандемными повторами, каждый из которых связывается с единичным нуклеотидом в сайте узнавания ДНК.
Количество повторов - от 1,5 до 35,5 (последний повтор укорочен).
Каждый повтор состоит из 33-35 аминокислотных остатков.
Аминокислотные остатки в положениях 12 и 13 высоко вариабельны и определяют нуклеотид связывания.
Слайд 9
TALEN - transcription activator-like effector nuclease.
Эффекторный домен
природного ТАЛЕ - небольшой пептид, способный взаимодействовать с компонентами
транскрипционного комплекса, обеспечивая либо его активацию, либо репрессию.
По аналогии с ZFN для целей редактирования генома эффекторный домен TALE может быть заменен ДНК-разрезающим центром рестриктазы FokI, с образованием TALEN (transcription activator-like effector nuclease).
Наличие простого, не зависящего от окружающего контекста кода между аминокислотной последовательностью повтора и единичным нуклеотидом связывания дает возможность конструирования TALEN с любым сайтом связывания.
Ограничение - необходимость иметь нуклеотид Т перед сайтом связывания. На практики это не создает особых проблем.
Более серьезная проблема - конструирование и синтез кодирующих TALE фрагментов ДНК, содержащих многочисленные повторы.
Слайд 10
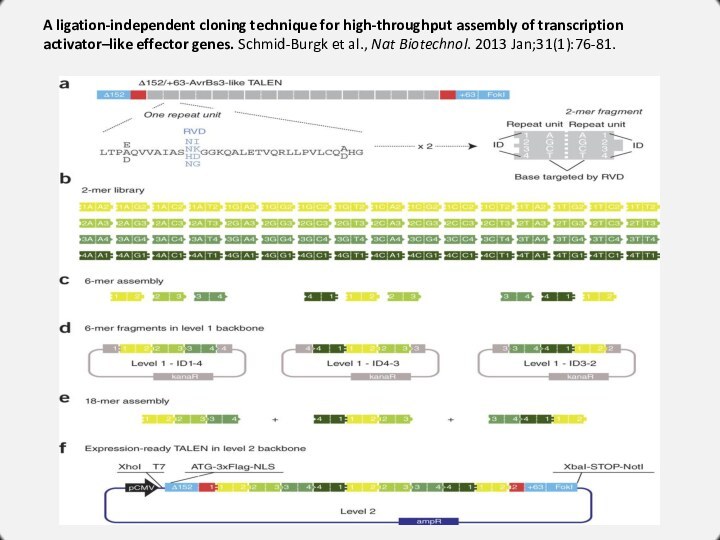
A ligation-independent cloning technique for high-throughput assembly of
transcription activator–like effector genes. Schmid-Burgk et al., Nat Biotechnol.
2013 Jan;31(1):76-81.
Слайд 11
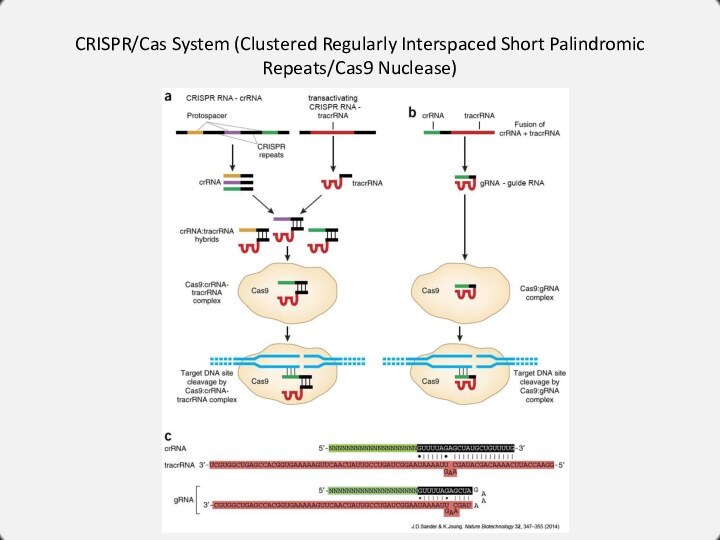
CRISPR/Cas System (Clustered Regularly Interspaced Short Palindromic Repeats/Cas9
Nuclease)
Система CRISPR/Cas является адаптивным иммунным механизмом архей и бактерий,
защищающий их от чужеродных генетических элементов, таких как ДНК фагов или плазмид.
Деградация чужеродной ДНК осуществляется с помощью эндонуклеаз Cas (CRISPR-associated), однако ее распознавание происходит на уровне РНК/ДНК-ового взаимодействия.
В качестве распознающих элементов выступают короткие эндогенные РНК, комплементарные участкам чужеродной ДНК, в комплексе с нуклеазами Cas.
Первые эксперименты по редактированию генома с помощью системы CRISPR/Cas9 были осуществлены в 2012 году.
Слайд 12
CRISPR/Cas System (Clustered Regularly Interspaced Short Palindromic Repeats/Cas9
Nuclease)
Слайд 13
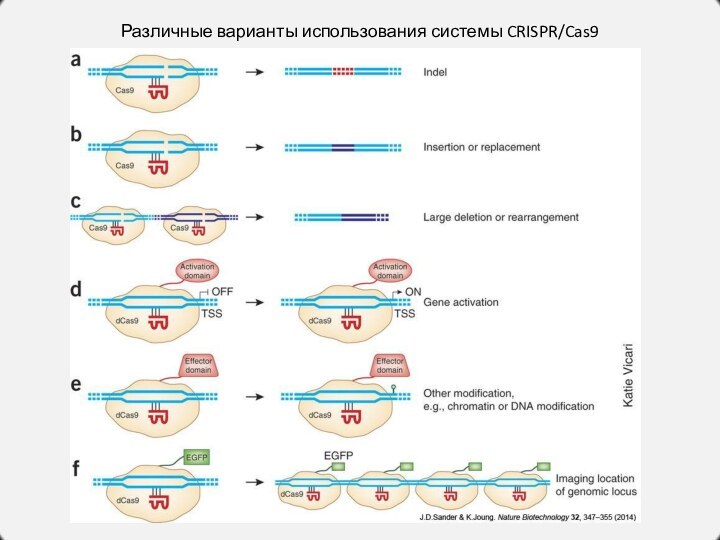
Различные варианты использования системы CRISPR/Cas9
Слайд 14
Различные варианты использования системы CRISPR/Cas9
Слайд 15
Практические приложения техники редактирования генома
Слайд 16
Иммуноглобулины Y, IgY
Иммуноглобулины Y птиц, рептилий и
двоякодышащих рыб - функциональные аналоги IgG млекопитающих.
Так же, как
и IgG, молекулы IgY состоят из двух тяжелых и двух легких цепей.
Основные отличия связаны с тяжелыми цепями.
Тяжелая цепь немного больше чем у IgG, а легкая, наоборот, меньше.
В отличии от IgG, IgY не связываются с белками А и G, с клеточными рецепторами Fc и не активируют систему комплемента.
В высокой концентрации накапливаются в яичном желтке.
Слайд 17
Практическое использование IgY имеет ряд преимуществ по сравнению
с IgG:
Не инвазивный способ получения материала для выделения IgY
(желток отложенных яиц),
Более низкое перекрестное реагирование с белками млекопитающих по сравнению с IgG,
Более высокий иммунный ответ на ряд антигенов,
В желтке накапливаются исключительно IgY (IgA и IgM отсутствуют)
При этом, содержание IgY в желтке сравнимо с таковым для IgG в сыворотке крови млекопитающих.
Недостатки:
В случае IgG можно напрямую использовать сыворотку, IgY необходимо очистить.
Более сложные способы очистки (не способность связываться с белками А или G).
Слайд 18
Трансгенная курица - константные домены IgY заменены на
аналогичные области IgG человека.
Удобный источник иммуноглобулинов,
Более простой способ их
очистки,
Возможность использования иммуноглобулинов на человеке.
Слайд 19
Гены иммуноглобулинов млекопитающих
Легкие цепи (IgL) - группы сцепления
для к- и А-типов
Тяжелые цепи (IgH) - группа
сцепления одного типа
Каждая группа сцепления имеет V-гены и С-гены
Легкие цепи к-типа - три группы генов:
1) 250 Vk-генов,
2) 5 J-мини-генов
3) Один Ск-ген кодирует константный домен легкой к-цепи.
Слайд 20
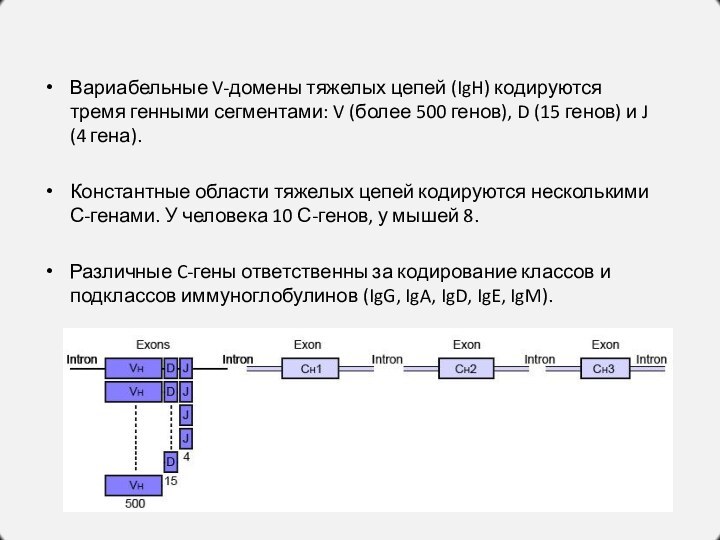
Вариабельные V-домены тяжелых цепей (IgH) кодируются тремя генными
сегментами: V (более 500 генов), D (15 генов) и
J (4 гена).
Константные области тяжелых цепей кодируются несколькими С-генами. У человека 10 С-генов, у мышей 8.
Различные C-гены ответственны за кодирование классов и подклассов иммуноглобулинов (IgG, IgA, IgD, IgE, IgM).
Слайд 21
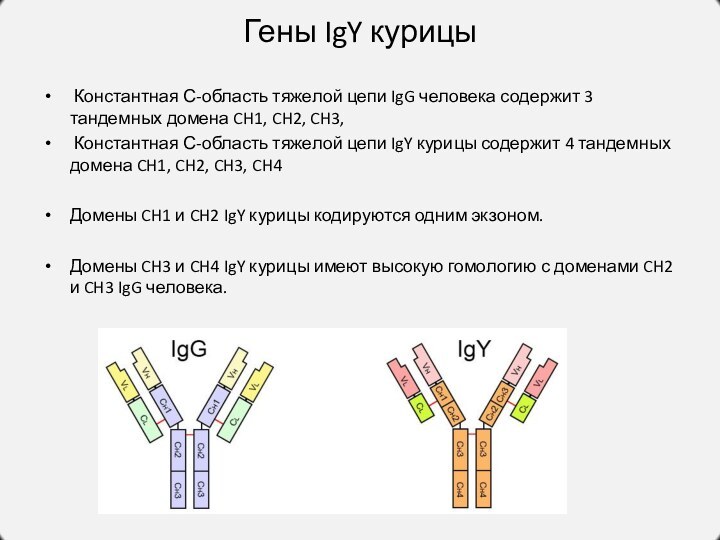
Гены IgY курицы
Константная С-область тяжелой цепи IgG
человека содержит 3 тандемных домена CH1, CH2, CH3,
Константная С-область тяжелой цепи IgY курицы содержит 4 тандемных домена CH1, CH2, CH3, CH4
Домены CH1 и CH2 IgY курицы кодируются одним экзоном.
Домены CH3 и CH4 IgY курицы имеют высокую гомологию с доменами CH2 и CH3 IgG человека.
Слайд 22
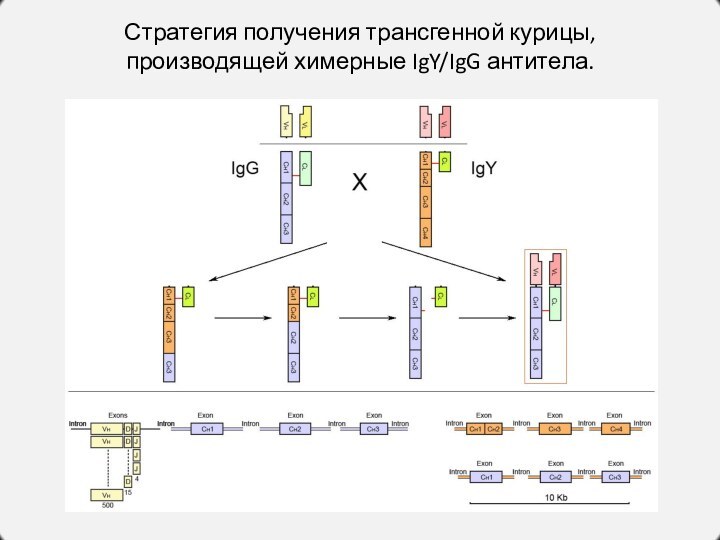
Стратегия получения трансгенной курицы, производящей химерные IgY/IgG антитела.
Слайд 23
Стратегия получения трансгенной курицы, производящей химерные IgY/IgG антитела.
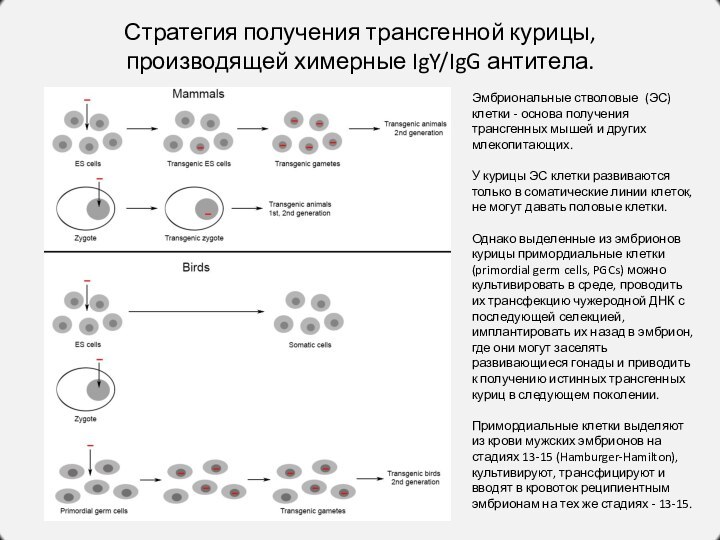
Эмбриональные стволовые (ЭС) клетки - основа получения трансгенных мышей
и других млекопитающих.
У курицы ЭС клетки развиваются только в соматические линии клеток, не могут давать половые клетки.
Однако выделенные из эмбрионов курицы примордиальные клетки (primordial germ cells, PGCs) можно культивировать в среде, проводить их трансфекцию чужеродной ДНК с последующей селекцией, имплантировать их назад в эмбрион, где они могут заселять развивающиеся гонады и приводить к получению истинных трансгенных куриц в следующем поколении.
Примордиальные клетки выделяют из крови мужских эмбрионов на стадиях 13-15 (Hamburger-Hamilton), культивируют, трансфицируют и вводят в кровоток реципиентным эмбрионам на тех же стадиях - 13-15.
Слайд 24
Immunoglobulin knockout chickens via efficient homologous recombination in
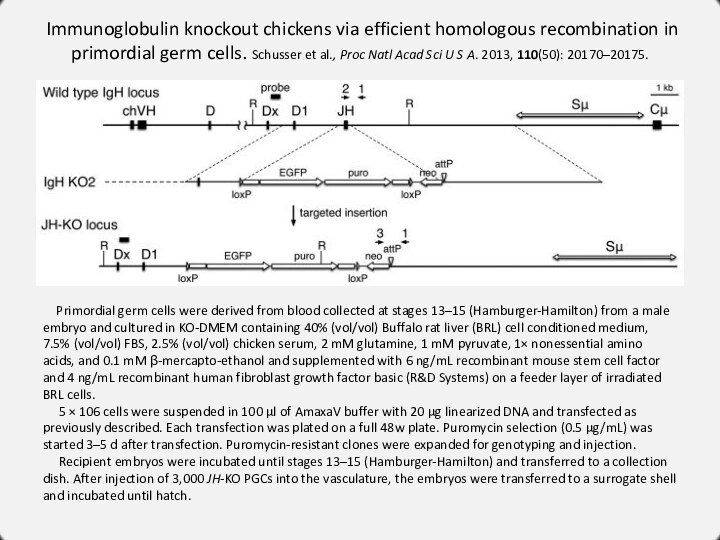
primordial germ cells. Schusser et al., Proc Natl Acad
Sci U S A. 2013, 110(50): 20170–20175.
Primordial germ cells were derived from blood collected at stages 13–15 (Hamburger-Hamilton) from a male embryo and cultured in KO-DMEM containing 40% (vol/vol) Buffalo rat liver (BRL) cell conditioned medium, 7.5% (vol/vol) FBS, 2.5% (vol/vol) chicken serum, 2 mM glutamine, 1 mM pyruvate, 1× nonessential amino acids, and 0.1 mM β-mercapto-ethanol and supplemented with 6 ng/mL recombinant mouse stem cell factor and 4 ng/mL recombinant human fibroblast growth factor basic (R&D Systems) on a feeder layer of irradiated BRL cells.
5 × 106 cells were suspended in 100 µl of AmaxaV buffer with 20 µg linearized DNA and transfected as previously described. Each transfection was plated on a full 48w plate. Puromycin selection (0.5 µg/mL) was started 3–5 d after transfection. Puromycin-resistant clones were expanded for genotyping and injection.
Recipient embryos were incubated until stages 13–15 (Hamburger-Hamilton) and transferred to a collection dish. After injection of 3,000 JH-KO PGCs into the vasculature, the embryos were transferred to a surrogate shell and incubated until hatch.