Слайд 2
Химико-токсикологический анализ включает:
- изолирование ( извлечение ) исследуемых

веществ из биологического материала;
- очистку вытяжек от примесей и
выделение вещества из вытяжек;
- идентификацию вещества;
- количественное определение выделенных веществ.
Методы изолирования ( извлечения ) токсических соединений из биологического материала.
Вещества, которые изолируют из биологического материала перегонкой с водяным паром (синильная кислота и соли, некоторые спирты, формальдегид, ацетон, фенол, хлорпроизводные углеводороды, уксусная кислота, этиленгликоль, тетраэтилсвинец).
Вещества, которые изолируют настаиванием биоматериала в подкисленной этиловым спиртом или подкисленной водой (алкалоиды и их синтетические аналоги, барбитураты и другие органические вещества).
Вещества, которые изолируют водой (щелочи, минеральные кислоты и их соли).
Вещества, которые изолируют органическими растворителями, несмешивающимися с водой (пестициды).
Вещества, для изолирования которых используют минерализацию биологического материала (соли металлов «металлические яды»).
Вещества, которые определяют без изолирования (монооксид углерода в крови).
Изолирование (извлечение) - перевод токсического вещества из биологического материала в жидкую фазу (вытяжку, минерализацат или дистиллят).
Качественные методы идентификации:
- хроматография в тонком слое;
- ГЖХ;
- спектроскопия ( УФС, ИКС )
- электрофорез;
- микрокриссталлоскопия;
- микродиффузия.
Количественное определение:
- фотоколориметрия;
- спектрофотометрия;
- ГЖХ и др.
Слайд 4
ГОСТ Р 52337-2005 Корма, комбикорма, комбикормовое сырье. Методы
определения общей токсичности
Настоящий стандарт распространяется на фуражное зерно (пшеницу,
кукурузу, овес, ячмень) и продукты его переработки (муку, крупу, отруби, лузгу, жмыхи, шроты); растительные корма (сено, солому, травяную муку); комбикорма для продуктивных и непродуктивных животных ( в том числе консервы) и сырье для их производства (корма животного происхождения; продукты микробиологического синтеза; сухое молоко; концентрированные кормовые добавки). Стандарт устанавливает методы определения их общей токсичности: экспресс-методы и основные методы
http://standartgost.ru/%D0%93%D0%9E%D0%A1%D0%A2%20%D0%A0%2052337-2005#texts
Слайд 5
5 Экспресс-методы определения общей токсичности биотестированием кормов на
стилонихиях и колподах
5.1 Биотестирование кормов на стилонихиях
Метод
основан на извлечении из исследуемых кормов различных фракций токсических веществ параллельно ацетоном и водой с последующим воздействием этих экстрактов на стилонихий. Оценку результату биотеста дают по реакции гибели инфузорий. Безопасным в этом случае следует считать корм, определенный как нетоксичный при одновременном параллельном исследовании как ацетонового, так и водного экстракта.
С учетом времени подготовки пробы корма к биотесту определение общей токсичности одной пробы занимает 3,5—4 ч; десяти проб — 4,5—5 ч.
Слайд 6
5.1.1 Средства измерений, вспомогательные устройства, материалы, реактивы
Шкаф

вытяжной с электроснабжением 220В/50ГцМ0А.
Весы лабораторные по ГОСТ 24104
с пределом допускаемой абсолютной погрешности однократного взвешивания не более ± 0.0001 г. Штангенциркуль по ГОСТ 166.
Мельница лабораторная, обеспечивающая крупность помола 0.1 мм.
Микроскоп бинокулярный стереоскопический сувеличением 3.6—100,1 марки МБС. изготовленный ПОД
Шкаф сушильный, обеспечивающий поддержание заданного температурного режима при 220 *С с погрешностью ± 2 °С.
Термостат суховоздушный с диапазоном измерения температур от 15 °С до 55 С и погрешностью регулирования температуры ± 0,5 4С.
Аппарат для встряхивания жидкостей по [2].
Аквадистиллятор с электропроводностью 1,6 или 2.3 мкСм/см. кроме моделей с медными или латунными испарителями или конденсаторами.
Центрифуга с частотой вращения 1000 обУмин.
Блок микроаквариумов луночных размером 15 ч 8,5 х 1,3 см. изготовленный из оргстекла. Стекла предметные 25 ж 75 мм с полированной лункой объемом 0.2 см3.
Колбы конические исполнения 2 (с пришлифованными пробками) вместимостью 50 или 100 см3 по ГОСТ 1770.
Стаканы химические вместимостью 100 смэ по ГОСТ 25336. Пипетки по ГОСТ 29169 и по ГОСТ 29227.
Пробирки исполнения 2 (с пришлифованными пробками) вместимостью 25 см3 по ГОСТ 1770.
Дозаторы пипеточные (автодозаторы) на 20. 200 и 500 мкп по [3].
Чашки Петри (биологические) по ГОСТ 23932.
Штатив для пробирок.
Часы песочные или таймер на 2 мин.
Дрожжи хлебопекарные прессованные по ГОСТ 171.
Бумага фильтровапьная по ГОСТ 12026.
Карандаш по стеклу.
Сито лабораторное с отверстиями диаметром 1 мм по [4].
Тест-культура стилонихии, идентифицированная по морфологическим признакам согласно определителю простейших и протестированная на активность с помощью модельного токсиканта. Ацетон по ГОСТ 2603, чд.а.. осч. Этиловый спирт по ГОСТ 17299. Дистиллированная вода по ГОСТ 6709. Соли для приготовления раствора Лозина-Лоэинекого: натрий хлористый по ГОСТ 4233; калий хлористый по ГОСТ 4234; кальций хлористый 2-водиый по [5]: магний хлористый 6-водиый по ГОСТ 4523; натрий углекислый кислый по ГОСТ 4201. Все соли должны быть марки х.ч. или ч.д.а.
Медь сернокислая 5-водная (II) по ГОСТ 4165 для приготовления модельного токсиканта. Допускается применение других средств измерения, оборудования и реактивов по метрологическим, техническим характеристикам и качеству не ниже указанных в настоящем стандарте.
Слайд 7
5.1.2 Подготовка к проведению испытании
5.1.2.1 Изготовление блока

луночных микроаквариумов (рисунок 1)
Блок луночных микроаквариумов изготовляют из
пластины органического стекла размером 15 х 8.5 х 1,3 см. В пластине высверливают с последующей полировкой 5 рядов по 9 лунок. Диаметр каждой лунки 1,2 см — верхний и 0,8 см — нижний, глубина —0.7 см. Рабочий объем каждой лунки — 0,4 см3. Вместо блока микроаквариумов можно использовать микробиологические предметные стекла с отшлифованной лункой вместимостью 0,2 см3 (по 5 шт. на пробу).
5.1.2.2 Порядок обработки посуды для проведения испытаний
Вся посуда и блоки микроаквариумов, необходимые для биотестирования, должны быть химически чистыми и использоваться только для данного анализа. 8 качестве моющего средства допускается к применению только хозяйственное мыло и мыльный раствор*
Чашки Петри и колбы для приготовления раствора Л о эи на -Лозинского прокаливают в сушильном шкафу в течение 2 ч при температуре 120 °С—150 вС. Блоки из органического стекла сушат только на воздухе. Дистилляцию воды для биотестирования необходимо проводить в химически чистом помещении.
Слайд 8
5.1.2.3 Приготовление рабочего раствора питательной среды для культивирования

стилонихий и разбавления ацетоновых экстрактов образцов кормов.
Средой для
культивирования инфузорий и разбавления ацетоновых экстрактов кормов служит раствор Лозина*Лозинского следующего состава: NaСl_ — 0,01 %, КСl — 0.001 %, СаСlг2-водный — 0.001%, МgСl без водный — 0.001 %, NаНСО3 — 0.002 %.
Для удобства сначала готовят 10-кратный концентрированный раствор. Для этого в дистиллированной воде растворяют 1.0 г хлористого натрия: 0.1 г хлористого калия; 0,1 г 7-водного хлористого магния: 0.1 г 2-водного хлористого кальция: 0.2 г кислого углекислого натрия и доводят объем до 1 дм3. Полученный раствор хранят не более одного месяца в холодильнике в стерильной колбе под оатно-мар-левой пробкой.
Рабочий раствор Лозина-Лозинского готовят путем разбавления в 10 раз (1:9) концентрированной среды дистиллированной водой. Рабочий раствор хранят не более двух недель при комнатной температуре.
5.1.2.4 Приготовление модельного токсиканта и его рабочих концентраций
Для приготовления модельного токсиканта берут 10 мг 5-водной сернокислой меди, растворяют ее в дистиллированной воде и доводят объем до 1 дм3. Срок хранения раствора — не более семи суток в холодильнике в стерильной колбе.
Рабочие концентрации модельного токсиканта готовят последовательным 10-кратным его разбавлением в день проведения анализа. Сначала до концентрации 1 мг/дм3 раствор разбавляют дистиллированной водой, а затем до концентрации 0.1 мг/дм3 — раствором Лозина Лозинского.
Слайд 9
Рабочая концентрация — 0,1 мг/дм3. Рабочий раствор используют

только свежеприготовленным. 5.1.2.5 Приготовление корма для стилонихий
Свежие хлебопекарные
дрожжи предварительно тестируют на общую токсичность. Затем навеску массой 50 г измельчают и высушивают в сушильном шкафу при температуре 50 С—55 °С в течение двух суток.
Хранят готовые дрожжи в стерильной банке с притертой крышкой в сухом прохладном месте не более 12 мес, избегая попадания прямых солнечных лучей и насыщения дрожжей атмосферной влагой. 5*1.2.6 Культивирование стилонихий
Культивирование стилонихий и тестирование кормов проводят в отдельном помещении, изолированном от химических токсичных реактивов (особенно от летучих соединений, хорошо растворимых в воде). В стерильную чашку Петри вносят 25 см3 рабочего раствора Лозина-Лозинского, затем пипеткой переносят в нее массу стилонихий* При этом кончик пипетки, заполненный культурой стилонихий. нужно предварительно погрузить в чашку Петри с рабочим раствором Лозина-Лозинского. Туда же в качестве корма для стилонихий на кончике иглы, продезинфицированной 70 %~ным раствором этилового спирта, вносят 0.003 г высушенных дрожжей (2-3 крошки диаметром 1—2 мм). Чашку Петри помещают в термостат для культивирования стилонихий при температуре 22 °С—24 "С. Пересев культуры для хранения проводят 2 раза в неделю.
Допускается культивирование стилонихий вне термостата при температуре 18 "С—24 *С. В этом случае для поддержания постоянной температуры используют лампу дневного света, установленную на определенном расстоянии от чашек Петри, обеспечивающем заданную температуру. Лампу вместе с чашками накрывают полиэтиленовой пленкой, создав подобие теплички, где температура должна быть постоянной. Во избежание попадания прямых солнечных лучей чашки Петри накрывают бумагой*
Необходимо учитывать, что культура стилонихий не обладает генетической стабильностью. Приблизительно через год—полтора работы с культурой она стареет, теряет однородность, жизнеспособность, подвижность, неадекватно реагирует на токсиканты. 8 этом случае необходимо раз в год подсаживать свежий клон стилонихий к старой культуре или полностью заменять ее на новую. С целью замедления процесса вырождения культуры стилонихий при пересадке на свежую среду необходимо отбирать не топько из предыдущей чашки Петри суточную культуру, но и из двух резервных чашек Петри с 2-, 3*суточными культурами, в которых инфузории имеют наибольшую подвижность и плотность.
Слайд 10
5.1.2.7 Подготовка тест-организмов
Для биотестирования используют только суточную

культуру стилонихий, находящуюся в фазе экспоненциального (активного) роста. С
этой целью за сутки до анализа массу стилонихий пересаживают в новую питательную среду с кормом и помещают в термостат при оптимальной температуре 22 С— 24 °С. При этом стилонихий активно размножаются и концентрируются вокруг корма.
Не допускается использовать культуру стилонихий. зараженную другими видами простейших, микроскопическими грибами или бактериями, что может произойти при использовании нестерильной посуды, плохо подсушенных или просроченных дрожжей.
Для получения достоверных результатов биотестирования необходимо регулярно проверять со* стояние стилонихий. их подвижность, а раз в месяц — реакцию культуры на действие модельного токсиканта (5.1.2.4), для чего каплю со стилонихиями помещают в лунку предметного стекла и после подсчета их количества заливают 0.2 см3 раствора модельного токсиканта рабочей концентрации 0,1 мг/дм3. Через 30 мин подсчитывают количество оставшихся живыми стилонихий. Результат считают удовлетворительным, если выживают не менее 50 % стилонихий.
5.1.2.8 Подготовка исследуемого корма
Среднюю пробу исследуемого корма измельчают и просеивают через сито с отверстиями диаметром 1 мм.
Слайд 11
5.1.2.9 Приготовление водного раствора ацетонового экстракта
Навеску исследуемого
корма массой (10 ± 0,1) г помещают в пробирку
с пришлифованной пробкой вместимостью 25 см или в коническую колбу со шлифом вместимостью 50 или 100 см3 и заливают определенным количеством ацетона в зависимости от вида исследуемого корма.
Для получения ацетонового экстракта пробирку или колбу энергично встряхивают не менее 2 мин, а затем отстаивают в течение не менее 10 мин и не более 15 мин.
При высокой набухаемости (гигроскопичности) исследуемого корма допускается увеличивать количество ацетона на 5—10 см таким образом, чтобы толщина слоя ацетона над кормом была не менее 2 мм. Раствор вновь взбалтывают в течение 2 мин. После повторного отстаивания в течение 10 мин осторожно отбирают автоматической пипеткой или шприцем с длинной иглой 0,5 см3 полученной надо садочной жидкости экстрактов и переносят ее е химический стакан или колбу с водным раствором Лозинского.
Слайд 12
5.1.3 Проведение испытания
Каждую пробу корма исследуют пять

раз (в пяти повторностях). Пересадку и подсчет стилонихий проводят
под микроскопом при увеличении 2x8 или 2 х 14.
Автоматической пипеткой отбирают по 20 мкл среды со стилонихиями и помещают в каждый из пяти микроаквариумов или лунок предметного стекла. Наконечник пипетки, используемый для пересадки стилонихий в микроаквариумы или лунки, должен быть отдельным. Затем туда же автоматической пипеткой с новым наконечником вносят по 20 мкл водного раствора ацетонового экстракта исследуемого корма, подготовленного для биотестирования (5.1.2.9). или водного экстракта исследуемого корма, подготовленного для биотестирования (5,1.2.10).
Через 2 мин в каждом микроаквариуме или лунке подсчитывают количество стилонихий. Оптимальное количество — 10—20 шт.. при этом травмированные клетки стилонихий (неподвижные, округлой формы) не учитывают. Полученные данные заносят в журнал.
После подсчета стилонихий в каждый микроаквариум или лунку другой автоматической пипеткой вносят по 200 мкл водного раствора ацетонового экстракта (5.1.2.9) или водного экстракта исследуемого корма (5.1.2.10) и засекают время.
Слайд 13
Перед каждым внесением раствора экстракта анализируемой пробы в

микроаквариум или лунку наконечник пипетки следует вытирать ватой во
избежание попадания в них жира с наружной стороны пипетки.
Через 1 ч экспозиции при анализе водного раствора ацетонового экстракта исследуемого корма или через 3 ч при анализе водного экстракта исследуемого корма вторично подсчитывают численность стилонихий. В контрольных тестах все стилонихий должны оставаться живыми. Для того, чтобы за время экспозиции растворы в лунках не подсохли, под блок микроаквариумов или предметные стекла подкяа-дывают смоченную водой фильтровальную бумагу и накрывают их стеклянным колпаком.
Параллельно с биотесгированием пробы корма, с целью определения качества ацетона и минерального раствора Лозина-Лозинского проводят контрольные тесты. Для этого в микроаквариумы или лунки (в трех повторностях) помещают вышеуказанным способом стилонихий и заливают их:
а) 200 мкл 1%-ного раствора ацетона — 0,1 см3 (100 мкл) ацетона на 10 см3 раствора Лозина-Лозинского;
б) 200 мкл минерального раствора Лозина-Лозинского.
Качество ацетона проверяют каждый раз в начале использования новой партии реактива, а качество раствора Лозина-Лозинского — при приготовлении новой порции. В случае токсичности исследуемого корма стилонихий;
а) изменяют свою обычную вытянуто-овальную форму на округлую, а движение — на беспорядочное с поворотом вокруг своей поперечной оси;
б) прекращают движение и (или) подвергаются распаду — лизису (количество лизированных клеток зависит от степени токсичности кормов). Токсичность исследуемого корма определяют по выживаемости стилонихий через 1 ч (при экстракции ацетоном) и 3 ч (при экстракции водой) экспозиции.
Слайд 14
5.1.4 Обработка результатов
Выживаемость стилонихий /V, %. вычисляют

по формуле
Ы = Ы2:ЫЛШ. (1)
где Ы2 —
среднеарифметическое (из пяти испытаний) значение количества стилонихий в конце опыта через 1 ч экспозиции, шт.; № — среднеарифметическое (из пяти испытаний) значение количества стилонихий в начале опыта, шт.; 100 — перевод результата в проценты.
Вычисления проводят с точностью до первого десятичного знака, а окончательный результат испытания регистрируют в протоколе с округлением до целого числа. Допускаемое расхождение между результатами двух параллельных определений при доверительной вероятности Р = 0,95 не должно превышать 1 %.
Токсичность исследуемого корма опредепяют из расчета:
а) комбикорма для свиней:
80 % — 100 % выживаемости стилонихий — корм нетоксичный; 40 % — 79 % выживаемости стилонихий — корм слаботоксичный: 0 % — 39 % выживаемости стилонихий — корм токсичный.
б) комбикорма для других видов продуктивных и непродуктивных животных, птиц и рыб; фуражное зерно и продукты его переработки, концентрированные компоненты комбикормов:
70 % — 100 % выживаемости стилонихий — корм нетоксичный; 40 % — 69 % выживаемости стилонихий — корм слаботоксичный: 0 % — 39 % выживаемости стилонихий — корм токсичный.
Слайд 15
5.1.5 Оформление результатов
Результаты испытаний заносят в журнал
и оформляют акт экспертизы или протокол испытаний, где указывают
наличие или отсутствие токсичности корма и возможность его использования.
Нетоксичным следует считать образец корма, определенный нетоксичным при параллельном биотестировании как водного раствора ацетонового экстракта, так и водного раствора испытуемого корма.
Нетоксичный корм дальнейшему исследованию не подлежит и используется по назначению без ограничений.
Слаботоксичные и токсичные корма (хотя бы по одному из исследованных экстрактов) направляют на биотестирование основными методами, а также на микологические, химико-токсикологические и бактериологические исследования.
Слайд 16
Кролик белый (живая масса 2—2,5 кг) с неповрежденной

кожей.
Воротник из фанеры или пластика размером 15 к
20 см.
Ацетон по ГОСТ 2603. ч.д.а., ос.ч.
Масло подсолнечное рафинированное по ГОСТ 1129.
6.1.2 Подготовка к проведению испытаний
Среднюю пробу корма измельчают и просеивают через сито с отверстиями диаметром 1 мм
6.1.2.1 Приготовление ацетонового экстракта испытуемого корма
В колбу с пришлифованной пробкой вместимостью 500 см помещают 50 г измельченного корма, заливают его 150 см3 ацетона и оставляют для экстракции на 24 ч или экстрагируют 3 ч на аппарате для встряхивания жидкостей. Слой экстрагента над пробой должен быть не менее 1 см.
После окончания экстракции жидкость фильтруют через бумажный фильтр и помещают в чашку для выпаривания. Оставшийся в колбе корм дополнительно промывают небольшой порцией экстрагента (не менее 20 см3), эту промывную жидкость фильтруют через тот же фильтр в ту же чашку.
Экстракт концентрируют в вытяжном шкафу до полного удаления запаха растворителя и получения маслянистого остатка желтоватого или коричневого оттенка. Для ускорения процесса чашку для выпаривания с экстрактом помещают на водяную баню температурой 45 =С—50 *С.
Периодически оседающий на стенках чашки осадок смывают на дно чашки, покачивая ее и обмывая стенки растворителем. Экстракт, оставшийся на стенках чашки, смывают экстрагентом на дно, затем снова концентрируют. В чашку, при необходимости, добавляют растительного масла в таком количестве, чтобы общий объем пробы был не менее 1 см3. Экстракт хранят в холодильнике.
При одновременном тестировании ацетонового экстракта данного образца на кроликах и мышах следует брать навеску в 150 г, помещать ее в коническую колбу на 1000 см3 и заливать 300 — 400 смэ ацетона.
Слайд 17
6.1.2.2 Приготовление тест-организма
У кролика на участке кожи

размером 6 х 6 см в области бедра, лопатки
или бока вдень постановки испытания тщательно выстригают волосяной покров (до полного оголения). Не допускается для испытания кожа поврежденная, пигментированная, а также с признаками шелушения. На одном кролике допускается ставить одновременно не более четырех проб. Повторное использование кролика для постановки биопробы допускается лишь при получении отрицательных результатов предыдущих испытаний и полного восстановления шерстного покрова.
Все корма для вивариумных животных, используемых в биотестировании, должны быть непременно проверены на общую токсичность и иметь отрицательные результаты. В противном случае в крови животных будет идти процесс накопления антигенов, который выражается в аллергической реакции кожи. Постановка биотеста на таком животном даст искаженные результаты испытания.
6.1.3 Проведение испытания
На выстриженный участок кожи кролика стеклянной или пластиковой лопаткой наносят, слегка втирая, половину экстракта, вторую половину экстракта оставляют для повторного нанесения на еле* дующий день в холодильнике. В качестве контроля используют один оголенный участок кожи размером 6x6 см, на который не наносят экстракт. С целью предупреждения слизывания экстракта, нанесенного на кожу, на шею кролика надевают воротник, который снимают не ранее чем через 3 сут после первого нанесения экстракта.
Наблюдение за реакцией начинают на следующий день после повторного нанесения экстракта и продолжают в течение 3 сут.
Новую партию растительного масла, используемого для разбавления экстракта, необходимо предварительно проверить на токсичность. Для этого выстриженный участок кожи дважды (с интервалом в сутки) смазывают растительным маслом и учитывают кожную реакцию. Масло не должно вызывать покраснения кожи.
Слайд 18
6.1.4 Обработка результатов
Токсичность исследуемых кормов определяют по
наличию воспалительного процесса на участке с нанесенным экстрактом.
Корм
нетоксичный — отсутствие воспалительной реакции. Допускается наличие гиперемии, сохраняющейся не более 2 суг после повторного нанесения экстракта и не сопровождающейся шелушением кожи.
Корм токсичный — гиперемия, сохраняющаяся 3 сут и более после повторного нанесения экстракта на кожу, шелушение, болезненность, уплотнение или отечность кожи, возможны точечные капиллярные кровоизлияния. 8 крайней степени токсичности по всей поверхности участка появляются язвы, затем образуется сплошной струп.
6.1.5 Оформление результатов испытания
Результаты испытаний кормов заносят в журнал и оформляют экспертизу или протокол испытаний, где указывают наличие или отсутствие токсичности корма и возможность его применения. Нетоксичный корм используют по назначению без ограничений. Токсичные корма использованию не подлежат.
Слайд 19
6.2 Определение общей токсичности кормов в опыте на

мышах
Метод основан на извлечении токсичных веществ из кормов
растительного и животного происхождения, комбикормов и кормовых добавок ацетоном или водой (в зависимости от результатов экспресс-биотеста) и введении экстракта однократно в желудок белым мышам.
6.2.1 Средства измерений, вспомогательные устройства, материалы, реактивы Шкаф вытяжной с электроснабжением 220В/50ГцП0А.
Весы лабораторные по ГОСТ 24104 с пределом допускаемой абсолютной погрешности однократного взвешивания не более ± 0.01 г.
Мельница лабораторная, обеспечивающая крупность помола 0,1 мм. Аппарат для встряхивания жидкостей по [2].
Баня водяная с максимальной температурой нагрева 100 *С, обеспечивающая точность поддержания температуры ± 0,5 °С.
Колбы с пришлифованными пробками исполнения 2 вместимостью 1000, 500 или 100 см второго класса точности по ГОСТ 1770.
Чашки для выпаривания № 5 вместимостью 250 см3 по ГОСТ 25336.
Цилиндры мерные вместимостью 250 см3 по ГОСТ 1770.
Шприцы на 1—2 см с тупыми изогнутыми иглами.
Сито металлическое с отверстиями диаметром 1 мм по [4].
Бумага фильтровальная по ГОСТ 12026.
Мыши белые живой массой 16—25 г.
Ацетон по ГОСТ 2603, чд.а.. ос.ч.
Вода дистиллированная по ГОСТ 6709.
Масло растительное.
Слайд 20
6.2.2 Подготовка к проведению испытаний
6.2.2.1 Подготовка пробы

для испытаний
Среднюю пробу исследуемого корма измельчают и просеивают
через сито с отверстиями диаметром 1 мм.
Концентрированные компоненты комбикормов и кормовые добавки анализируют по схеме биотестирования комбикормов, предварительно введя эти вещества в количестве, определенном рецептом или зоотехническими нормами в размолотый образец проверенного биотестированием, нетоксичного на 100 % зерна пшеницы.
6.2.2.2 Приготовление ацетонового экстракта испытуемого образца
В колбу с пришлифованной пробкой вместимостью 500 см помещают 100 г измельченного корма, заливают 200 — 300 см3 ацетона и экстрагируют 3 ч на аппарате для встряхивания жидкостей. Слой экстрагента над пробой должен быть не менее 1 см.
После окончания экстракции жидкость фильтруют через бумажный фильтр (белая лента) и помещают в чашку для выпаривания. Оставшийся в колбе корм дополнительно промывают небольшой порцией экстрагента (не менее 20 см3), промывную порцию фильтруют через тот же фильтр. Экстракт концентрируют в вытяжном шкафу до полного удаления запаха растворитепя и получения маслянистого остатка желтоватого или коричневого оттенка. Для ускорения процесса чашку для выпаривания с экстра ктом гюмещают на водяную баню с температурой 45 *С — 50 *С. Периодически оседающий на стенках чашки осадок смывают на дно чашки, покачивая ее и обмывая растворителем.
Экстракт, оставшийся все же на стенках чашки, смывают эксграгентом на дно. затем снова концентрируют. Добавляют в чашку 2.5 см3 растительного масла (кроме экстракта из жмыхов). При необходимости экстракт можно хранить в холодильнике не более 3 сут.
6.2.2.3 Приготовление водного экстракта испытуемого образца
Слайд 21
6.2.2.3 Приготовление водного экстракта испытуемого образца
Навеску корма

массой 50 г помещают в коническую колбу на 500
см и приливают 200 см дистиллированной воды. Колбу помещают на аппарат для встряхивания жидкостей на 20 мин. По окончании экстракции содержимое колбы фильтруют через бумажный фильтр (белая лента). Полученный водный экстракт можно хранить в холодильнике не более 2 сут.
6.2.2.4 Подготовка тест-организма
Для опыта отсаживают в отдельную клетку пять белых мышей весом 16—25 г и выдерживают их без корма 4 — 5 ч.
Все корма для кормления вивариумных животных, используемых в биотестировании, должны быть непременно проверены на общую токсичность и иметь отрицательные результаты.
6.2.3 Проведение испытания
Пяти мышам с помощью шприца с тупой изогнутой иглой длиной 3—4 см вводят однократно через рот в желудок 0,5 см выпаренного остатка ацетонового экстракта или 0,5 см водного экстракта. Наблюдают за мышами в течение 3 сут, не ограничивая их в кормах и воде. При отсутствии падежа мышей убивают (усыпляют медицинским эфиром) и вскрывают.
В качестве контрольного теста пяти белым мышам вводят:
а) растительное масло (в случае ацетоновой экстракции), которым разводили экстракт корма;
б) дистиллированную воду (в случае водной экстракции). Контрольный тест на масло ставят каждый раз при смене партии масла. Необходимо соблюдать сроки хранения масла. Контрольный тест на воду ставят каждый раз.
Слайд 22
6.2.4 Обработка результатов
Учет реакции ведут на основании

анализа состояния внутренних органов (желудочно-кишечного тракта, печени, селезенки, почек)
при вскрытии мышей.
Корм нетоксичный — все мыши живы, при вскрытии убитых мышей патолого-анатомических изменений не обнаружено.
Корм токсичный — гибнут все или хотя бы одна мышь и при вскрытии павших и убитых животных устанавливают геморрагическое воспаление желудочно-кишечного тракта, часто сопровождающееся дегенерацией печени, почек, селезенки или кровоизлияниями в паренхиматозных органах.
При параллельном анализе на кроликах и мышах нетоксичным считают корм, который окажется нетоксичным в обоих вариантах анализа.
6.2.5 Оформление результатов испытания
Результаты испытаний кормов заносят в журнал и оформляют экспертизу или протокол испытания о наличии или отсутствии токсичности корма и возможности его применения. Нетоксичные корма используют по назначению без ограничений. Токсичные корма использованию не подлежат
7 Требования безопасности
Все испытания, связанные с работой в вытяжном шкафу, с пожароопасными, взрывчатыми и вредными веществами, с использованием электрооборудования должны проводиться в соответствии с требованиями ГОСТ 12.1.004, ГОСТ 12.1.005. ГОСТ 12.1.007 и ГОСТ 12.1.030.
Слайд 23
Хроматографические методы анализа
Хроматография – процесс, основанный на многократном

повторении актов сорбции и десорбции вещества при перемещении его
в потоке подвижной фазы вдоль неподвижного сорбента. Разделение сложных смесей хроматографическим способом основано на различной сорбируемости компонентов смеси. В процессе хроматографирования так называемая подвижная фаза (элюент), содержащая анализируемую пробу, перемещается через неподвижную фазу. Обычно неподвижная фаза представляет собой вещество с развитой поверхностью, а подвижная – поток газа или жидкости, фильтрующейся через слой сорбента. При этом происходит многократное повторение актов сорбции – десорбции, что является характерной особенностью хроматографического процесса и обуславливает эффективность хроматографического разделения.
Качественный хроматографический анализ, т.е. индетификация вещества по его хроматограмме, может быть выполнен сравнением хроматограических характеристик, чаще всего удерживаемого объема (т.е. объема подвижной фазы, пропущенной через колонку от начала ввода смеси до появления данного компонента на выходе из колонки), найденных при определенных условиях для компонентов анализируемой смеси и для эталона.
Количественный хроматографический анализ проводят обычно на хроматографе. Метод основан на измерении различных параметров хроматографического пика, зависящих от концентрации хроматографируемых веществ – высоты, ширины, площади и удерживаемого объема или произведения удерживаемого объема на высоту пика.
Слайд 25
По агрегатному состоянию применяемых фаз. Согласно этой классификации

хроматографию подразделяют на газовую и жидкостную. Газовая включает газо-жидкостную
и газо-адсорбционную хроматографию. Жидкостная хроматография подразделяется на жидкостно – жидкостную, жидкостно – адсорбционную и жидкостно – гелевую. Первое слово в этой классификации характеризует агрегатное состояние подвижной фазы.
По механизмам разделения, т.е. по характеру взаимодействия между сорбентом и сорбатом. По этой классификации хроматографию подразделяют на следующие виды:
1. адсорбционная хроматография – разделение основано на различии в адсорбируемости разделяемых веществ твердым адсорбентом;
2. распределительная хроматография – разделение основано на различии в растворимости разделяемых веществ в неподвижной фазе (газовая хроматография) и на различии в растворимости разделяемых веществ в подвижной и неподвижной жидких фазах;
3. ионообменная хроматография – разделение основано на различии в способности разделяемых веществ к ионному обмену;
4. проникающая хроматография – разделение основано на различии в размерах или формах молекул разделяемых веществ, например, при применении молекулярных сит (цеолитов);
5. осадочная хроматография – разделение основано на образовании различных по растворимости осадков разделяемых веществ с сорбентом;
6. адсорбционно-комплексообразовательная хроматография – разделение основано на образовании координационных соединений различной прочности в фазе или на поверхности адсорбента.
Следует иметь в виду, что очень часто процесс разделения протекает по нескольким механизмам.
Слайд 26
По применяемой технике:
1) колоночная хроматография – разделение веществ проводится
в специальных колонках;
2) плоскостная хроматография: а – бумажная – разделение
веществ проводится на специальной бумаге; б – тонкослойная – разделение веществ проводится в тонком слое сорбента.
В колоночной и тонкослойной хроматографии можно использовать любой из приведенных выше механизмов разделения, в бумажной хроматографии чаще всего применяют распределительный и ионообменный механизмы.
Слайд 27
Тонкослойная хроматография
Метод тонкослойной хроматографии (ТСХ), получивший в

настоящее время широкое распространение, был разработан Н.А. Измайловым и
М.С. Шрайбер в 1938 г.
В методе ТСХ неподвижная твердая фаза тонким слоем наносится на стеклянную, металлическую или пластмассовую пластинку. В 2–3 см от края пластинки на стартовую линию вносят пробу анализируемой жидкости и край пластинки погружают в растворитель, который действует как подвижная фаза жидкостной адсорбционной хроматографии. Под действием капиллярных сил растворитель движется вдоль слоя сорбента и с разной скоростью переносит компоненты смеси, что приводит к их разделению. Диффузия в тонком слое происходит в продольном и поперечном направлениях, поэтому процесс следует рассматривать как двумерный.
Сорбционные свойства системы в ТСХ характеризуются подвижностью, т.е. величиной Rf, которая рассчитывается из экспериментальных данных по уравнению:
Rf = Хi / Xf
где Хi - расстояние от стартовой линии до центра зоны i-го компонента; Xf - расстояние, пройденное за это же время растворителем.
Слайд 29
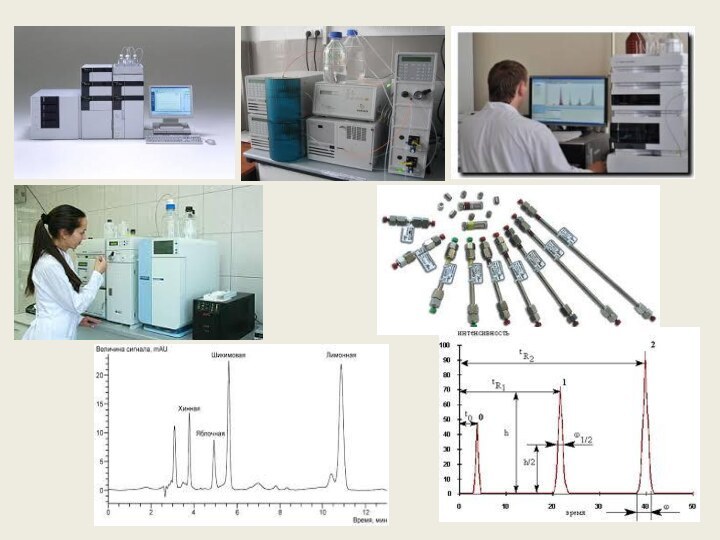
Высокоэффективная жидкостная хроматография – наиболее эффективный метод анализа

органических проб сложного состава. Процесс анализа пробы делится на
2 этапа:
разделение пробы на составляющие компоненты;
детектирование и измерение содержания каждого компонента.
Задача разделения решается при помощи хроматографической колонки, которая представляет собой трубку, заполненную сорбентом. При проведении анализа через хроматографическую колонку подают жидкость (элюент) определенного состава с постоянной скоростью. В этот поток вводят точно отмеренную дозу пробы.
Компоненты пробы, введенной в хроматографическую колонку, из-за их разного сродства к сорбенту колонки двигаются по ней с различными скоростями и достигают детектора последовательно в разные моменты времени.
Таким образом, хроматографическая колонка отвечает за селективность и эффективность разделения компонентов. Подбирая различные типы колонок можно управлять степенью разделения анализируемых веществ. Идентификация соединений осуществляется по их времени удерживания. Количественное определение каждого из компонентов рассчитывают, исходя из величины аналитического сигнала, измеренного с помощью детектора, подключенного к выходу хроматографической колонки.
Метод ВЭЖХ применяется в санитарно-гигиенических исследованиях, экологии, медицине, фармацевтике, нефтехимии, криминалистике, для контроля качества и сертифкации продукции.
Слайд 31
Масс-спектрометрия (масс-спектроскопия, масс-спектрография, масс-спектральный анализ, масс-спектрометрический анализ) — метод
исследования вещества, основанный на определении отношения массы к заряду
ионов, образующихся при ионизации представляющих интерес компонентов пробы. Один из мощнейших способов качественной идентификации веществ, допускающий также и количественное определение. Можно сказать, что масс-спектрометрия — это «взвешивание» молекул, находящихся в пробе.
Особенно широкое применение масс-спектрометрия находит в анализе органических веществ, поскольку обеспечивает уверенную идентификацию как относительно простых, так и сложных молекул. Единственное общее требование — чтобы молекула поддавалась ионизации.
Слайд 34
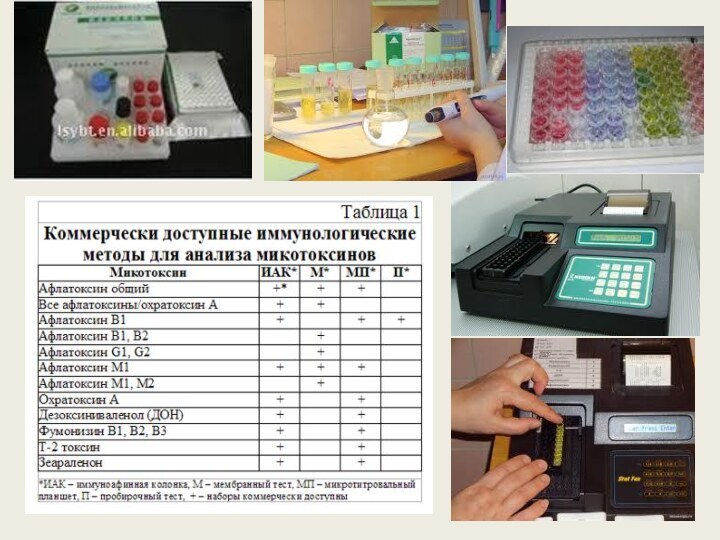
Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) —
лабораторный иммунологический метод качественного или количественного определения различных соединений,
макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.