- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обобщение и систематизация знаний по теме
Содержание
- 2. Обобщение и систематизация знаний по теме
- 3. На этом занятии мы закрепим и обобщим
- 4. Часть 1. Общая характеристика главной
- 5. Среди элементов IV группы наибольшее значение имеют
- 6. Уже у германия проявляются металлические свойства. Германий
- 7. олово и свинец - металлы.
- 8. Задание 1. Зарисуйте схемы электронного строения
- 9. Решение: Подсказка 1Элементы главной подгруппы четвертой группы
- 10. схемы электронного строения атомов углерода и кремния
- 11. Решение: В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Следовательно, в
- 12. Подсказка 3Для того , чтобы дать полный
- 13. В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2,
- 14. Задание 2Среди карбидов и силицидов особое место
- 15. Решение: ПодсказкаВспомните , как меняется электроотрицательность элементов
- 16. Решение: Углерод и кремний - это неметаллы,
- 17. ТестыТЕСТ 2. На внешнем электронном уровне атома
- 18. ОтветыДаНетДаНетДа
- 19. Часть 2. Простые вещества, образованные атомами углерода и кремния. Их химические свойства .
- 20. Аллотропия углерода Алмаз
- 21. У графита атомы углерода расположены
- 22. Карбин и фуллерены – другие аллотропные формы
- 23. Аморфный углерод и его сорта. Графит,
- 24. Аморфный углерод – не является еще одним
- 25. Аллотропия кремнияРазличают две основные аллотропные модификации кремния
- 26. Задание 3. Как доказать, что графит и
- 27. Подсказка 1Вспомните, как отличаются химические свойства веществ, являющихся аллотропными модификациями одного и того же элемента.
- 28. Подсказка 2Запишите уравнение реакции горения алмаза и
- 29. Решение: И алмаз, и графит при сгорании
- 30. Химические свойства простых веществ, образованных атомами углерода
- 31. Графит и кремний — типичные восстановители . Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании —
- 32. Восстановительные свойства графита и кремния в реакциях
- 33. Восстановительные свойства графита и кремния в реакциях
- 34. Восстановительные свойства графита и кремния в реакциях
- 35. Задача 4. Смесь кремния и угля, массой 5,0 г, обработали избытком концентрированного раствора щелочи при нагревании. В результате реакции выделилось 2,8 литров водорода (н.у.). Вычислите массовую долю углерода в этой смеси.
- 36. Подсказка 1.Если по условию задачи известны
- 37. Решение: v(Н2) = 2,8/22,4 = 0,125 моль.
- 38. Задание 5. Объясните окислительно-восстановительные процессы с участием
- 39. Подсказка 1.Расставим степени окисления и определим атомы элементов, участвующие в процессе окисления-восстановления.
- 40. Решение: Кремний растворяется в смеси концентрированных азотной
- 41. Решение: Кремний растворяется в водных растворах щелочейРасставим
- 42. Кремний растворяется в смеси концентрированных азотной и
- 43. Окислительные свойства углерода и кремния. Активные металлы
- 44. Свойства карбидов и силицидов.Большинство карбидов активно реагируют
- 45. Свойства силана.Силан — бесцветный газ, имеющий запах
- 46. Получение метана.Углерод в отличие от кремния непосредственно
- 47. Задание 6. «Встретились два богатыря, равные
- 48. Подсказка .Мокрое место на песке...-предположим, что имеется
- 49. Решение: Уравнение химической реакции можно представить, какХ
- 50. ТестыТЕСТ 1. Алмаз отличается высокой твердостью; он
- 51. ОтветыДаДаНетДаНетДа
- 52. Часть 3.Свойства оксидов углерода и кремния. Сходство и различия.
- 53. Оксид углерода (II) и оксид кремния (II).
- 54. Оксид кремния (IV) и оксид углерода (IV)
- 55. Оксид углерода (IV) (диоксид углерода, углекислый газ)
- 56. Получение углекислого газа1. В промышленности: термическим разложением солей
- 57. Качественная реакция на углекислый газ:
- 58. Задание 7.Ответьте на вопросы: Какие вещества будете использовать
- 59. Подсказка 1 Вспомните , как с помощью
- 60. РешениеДля получения углекислого газа в лаборатории используют
- 61. Подсказка 2Вспомните каков характер гидроксида, образующегося при
- 62. РешениеОксид углерода (IV) растворяется в воде с
- 63. Химические свойства оксида кремния (IV) и оксидов
- 64. Химические свойства оксида углерода (II) При обычных
- 65. Задание 8. С помощью химических превращений разделите
- 66. Подсказка 1Для того, чтобы отделить карбонат кальцияиспользуйте
- 67. Решение1.К смеси прильем раствор соляной кислоты: СаСO3
- 68. Подсказка 2 В смеси на фильтре остались
- 69. РешениеВ смеси на фильтре остались серебро и
- 70. ТестыТЕСТ 1. Соединения углерода и кремния очень
- 71. ОтветыНетДаДаНетДаНет
- 72. Часть 4Угольная и кремниевая кислоты , их соли. каолинит (основная часть глины)Полевой шпатКремниевый топор
- 73. Н2SiO3— твердое вещество, практически нерастворимо в воде,
- 74. Химические свойства кислотУгольная кислота – двухосновная кислота,
- 75. Соли угольной и кремниевой кислот.Угольная кислота образует
- 76. Cuликаты — это соли кремниевой кислоты H2SiO3
- 77. Физические свойства карбонатов и силикатов: Все
- 78. Качественная реакция на карбонаты и растворимые силикаты.
- 79. Химические свойства солей угольной кислоты:1) Вступают в
- 80. Взаимопревращение карбонатов и гидрокарбонатовПри избытке углекислого газа
- 81. Задание 9. Приведите уравнения реакций, описывающие общие и специфические химические свойства угольной и кремниевой кислот.
- 82. Подсказка 1Для того, чтобы записать уравнения общих
- 83. Решение1) Реакции общие с другими кислотами,Как кислоты
- 84. Подсказка 2Специфические свойства этих кислот определяются тем
- 85. РешениеСпецифические свойства. кремниевая кислота не диссоциирует, поэтому
- 86. Задание 10. Какой объем углекислого газа
- 87. Подсказка 1Для успешного решения необходимо вспомнить, что
- 88. гидроксида бария составляет 5% от общей массы раствора. Найдем его массуm(Ва(ОН)2) = 80•0,05 = 4 г
- 89. Подсказка 2Если по условию задачи известны массы
- 90. 3. Рассчитаем объем газа:V(СО2) = 0,0468•22,4 =
- 91. ТестыТЕСТ 1. Все кислоты реагируют с растворимыми
- 92. Ответы.ДаНетНетДаНет
- 93. Скачать презентацию
- 94. Похожие презентации


























































































Слайд 3 На этом занятии мы закрепим и обобщим знания
об элементах – углероде и кремнии. Выполняя предложенные задания,
вы повторите свойства простых веществ, состоящих из атомов этих элементов, химические свойства изученных соединений углерода и кремния, уравнения соответствующих реакций. Дадите характеристику элементам подгруппы углерода, вспомните, как определять карбонат- силикат- ионы и углекислый газ; решать комбинированные задачи.
Слайд 4
Часть 1.
Общая характеристика главной подгруппы четвертой группы.
Главную
подгруппу IV группы периодической системы Д. И. Менделеева образуют пять
элементов - углерод, кремний, германий, олово и свинец.элемент С Si Ge Sn Pb
Радиус атома 2,50 1,74 2,02 1,72 1,55
В подгруппе с ростом порядкового номера элемента увеличивается атомный радиус, неметаллические свойства ослабевают, а металлические усиливаются
Слайд 5 Среди элементов IV группы наибольшее значение имеют углерод,
входящий в состав всех живых организмов, и кремний -
важнейший элемент земной коры.
Алмаз и графит кремний (модификации углерода) – неметаллы
Слайд 6 Уже у германия проявляются металлические свойства. Германий по
внешнему виду похож на металлы, но хрупок. Как и
кремний, германий принадлежит к полупроводникам, т. е. к веществам, занимающим промежуточное положение между изоляторами, к которым относятся многие неметаллы), и проводниками -металлами.
Слайд 8
Задание 1.
Зарисуйте схемы электронного строения атомов углерода
и кремния .
Объясните, почему элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO,
а водородные соединения углерода и кремния имеют формулу RН4. Каков характер этих соединений?
Слайд 9
Решение:
Подсказка 1
Элементы главной подгруппы четвертой группы : р-элементы IV группы периодической системы Д.И. Менделеева.
На внешнем электронном слое атомы этих элементов имеют 4
электрона: 2s- и 2 р- электрона. Такая электронная структура записыватся. как ns2np2. Теперь вспомните , как зарисовать схемы электронного строения атомов углерода и кремния .
Слайд 10
схемы электронного строения атомов углерода и кремния .
Подсказка
2
Проанализируйте составленные схемы и определите возможные валентности и степени
окисления атомов в невозбужденном состоянии, предскажите валентность атомов этих элементов в возбужденном состоянии .
Слайд 11
Решение:
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Следовательно, в нормальном состоянии
элементы этой подгруппы отдают 2 электрона и проявляют степень
окисления +2С° - 2ē → С+2 степень окисления в СО
При переходе в возбуждённое состояние, сопровождающееся переходом одного из s – электронов внешнего слоя в свободную ячейку p – подуровня того же уровня.(показано пунктирными стрелками), все электроны наружного слоя становятся не спаренными и валентность при этом возрастает до 4. Эти неспаренные 4 электрона могут участвовать в образовании 4 связей.
В таких соединениях элементы могут проявлять степени окисления как +4 (с атомами более электроотрицательных элементов), так и -4 (с атомами менее электроотрицательных элементов),.
С° + 4ē → С-4 низшая степень окисления (СН4).
С° - 4ē → С+4 высшая степень окисления (СО2).
Поэтому элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения углерода и кремния имеют формулу RН4.
Слайд 12
Подсказка 3
Для того , чтобы дать полный ответ
, вспомните , что в подгруппе с ростом порядкового
номера элемента увеличивается атомный радиус, неметаллические свойства ослабевают, а металлические усиливаются.Вспомните, каков характер высших оксидов металлов и неметаллов? Характерны ли для металлов отрицательные степени окисления?
Оформите свое решение в виде таблицы.
Слайд 13 В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением
заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. Высшим оксидам
соответствует степень окисления +4 . Высшие оксиды углерода и кремния обладают кислотными свойствами, оксиды остальных элементов подгруппы - амфотерны .
Слайд 14
Задание 2
Среди карбидов и силицидов особое место занимает
карборунд SiC, который можно назвать как карбидом кремния, так
и силицидом углерода. Карборунд имеет высокую температуру плавления, благодаря алмазоподобной структуре; его твердость близка к твердости алмаза. Химически SiC очень стоек.Определите степень окисления каждого из элементов в этом веществе.
Слайд 15
Решение:
Подсказка
Вспомните , как меняется электроотрицательность элементов по подгруппе
с возрастанием порядкого номера. Определите , какой из элементов
будет проявлять отрицательную, а какой положительную степень окисления.
Слайд 16
Решение:
Углерод и кремний - это неметаллы, так как
на внешнем электронном слое 4 электрона. Но так как
кремний имеет больший радиус атома, то для него более характерна способность отдавать электроны, чем для углерода. Поэтому в этом соединении углерод имеет отрицательную степень окисления -4, а кремний положительную +4.
Слайд 17
Тесты
ТЕСТ 2. На внешнем электронном уровне атома углерода
находится 6 электронов.
1.Да
2.Нет
ТЕСТ 3. Кремний – второй по распространенности
элемент на Земле после кислорода. 1. Да
2. Нет
ТЕСТ 4. Кремний относится к металлам..
1.Да
2.Нет
ТЕСТ 1 . В подгруппе с ростом порядкового номера элемента неметаллические свойства усиливаются
1. Да
2. Нет
ТЕСТ 5 . Валентность углерода в высшем оксиде и летучем водородном соединении совпадает.
1. Да
2. Нет
Слайд 19
Часть 2.
Простые вещества, образованные атомами углерода и кремния.
Их химические свойства .
Слайд 20
Аллотропия углерода
Алмаз
Графит
Углерод существует во множестве аллотропных модификаций с
очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Алмаз – прозрачное кристаллическое вещество, самое прочное из всех природных веществ. Он служит эталоном твердости
Графит – темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском, мягкий и непрозрачный, хорошо проводит тепло и электрический ток, очень тугоплавок. Мягкость графита обусловлена слоистой структурой.
Слайд 21 У графита атомы углерода расположены параллельными
слоями. Расстояние между соседними слоями гораздо больше, чем между
соседними атомами в слое. Это обусловливает малую прочность связи между слоями, и поэтому графит легко расщепляется на тонкие чешуйки, которые сами по себе очень прочные.В кристаллической решетке алмаза каждый атом углерода окружен четырьмя другими. Атомы расположены на одинаковых расстояниях друг от друга и очень прочно связаны между собой ковалентны-ми связями. Этим объясняется большая твердость алмаза.
Слайд 22
Карбин и фуллерены – другие аллотропные формы углерода.
Карбин
-чёрный порошок; полупроводник.
Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
При
нагревании переходит в графит.Фуллере́н — молекулярное соединение, представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа атомов углерода.
В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерен. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку.
Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего.
Слайд 23
Аморфный углерод и его сорта.
Графит, алмаз
известны с древности Однако определенно утверждать можно лишь одно:
до алмаза и до графита было открыто вещество, которое еще несколько десятилетий назад считали аморфной формой элементарного углерода - уголь.Бурые угли – твердые горючие ископаемые, образовавшиеся из торфа. Содержат 65-70% углерода, имеют бурый цвет.
Каменный уголь – вид ископаемого топлива, образовавшийся под землёй при глубоком разложении растительных остатков без доступа кислорода.Содержание углерода в каменном угле в зависимости от месторождения составляет от 75% до 95%.
Древе́сный у́голь — микропористый высокоуглеродистый продукт, образующийся при разложении древесины без доступа воздуха.
Слайд 24 Аморфный углерод – не является еще одним аллотропным
видоизменением углерода, а представляет собой мелкокристаллический графит.
Слайд 25
Аллотропия кремния
Различают две основные аллотропные модификации кремния -
аморфную и кристаллическую.
Решётка кристаллической модификации кремния - атомная,
алмазоподобная. , но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза.Кристаллическая структура кремния.
Также выделяют поликристаллический и монокристаллический кремний. Аморфный кремний – порошок бурого цвета на основе сильно разупорядоченной алмазоподобной структуры.
Поликристаллический кремний
Слайд 26
Задание 3.
Как доказать, что графит и алмаз
являются аллотропными видоизменениями одного и того же химического элемента?
Чем объяснить различия их свойств?
Слайд 27
Подсказка 1
Вспомните, как отличаются химические свойства веществ, являющихся
аллотропными модификациями одного и того же элемента.
Слайд 28
Подсказка 2
Запишите уравнение реакции горения алмаза и углерода.
Как доказать, что в обоих случаях получается один и
тот же продукт реакции?
Слайд 29
Решение:
И алмаз, и графит при сгорании в кислороде
образуют оксид углерода (IV) СО2, при пропускании которого через
известковую воду выпадает белый осадок карбонат кальция СаСО3.С + О2 = СО2;
СО2 + Са(ОН)2 = CaCO3 + Н2О.
Кроме того, из графита можно получить алмаз при нагревании под высоким давлением. Следовательно, в состав и графита, и алмаза входит только углерод. Различие в свойствах графита и алмаза объясняется различием в строении кристаллической решетки.
Слайд 30 Химические свойства простых веществ, образованных атомами углерода и
кремния .
При обычных условиях углерод и кремний очень
инертны и практически не взаимодействуют ни с какими простыми и сложными веществами.Графит и кремний — типичные восстановители При нагревании с избытком воздуха графит и кремний образуют диоксиды:
С + О2 = СО2,
Si + О2 = SiO2,
Слайд 31
Графит и кремний — типичные восстановители .
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании — с хлором,
давая СCl4 и SiCl4. При более сильном нагревании углерод и кремний реагируют с серой и азотом:
4С + S8 = 4СS2,
2С + N2
= С2N2,4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Слайд 32 Восстановительные свойства графита и кремния в реакциях со
сложными веществами.
С водой углерод и кремний реагируют лишь при
высоких температурах:С + Н2О = СО + Н2
Si + ЗН2О = Н2SiO3 + 2Н2
Первая из этих реакций имеет большое практическое значение. Она лежит в основе процесса газификации твердого топлива.
Слайд 33 Восстановительные свойства графита и кремния в реакциях со
сложными веществами.
Графит часто используют для восстановления малоактивных металлов из
их оксидов:СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si = Мg2Si + 2SiO2.
Слайд 34 Восстановительные свойства графита и кремния в реакциях со
сложными веществами.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+
2SО2↑ + 2Н2О, 3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3 + Н2↑.
Слайд 35
Задача 4.
Смесь кремния и угля, массой 5,0 г, обработали избытком концентрированного раствора щелочи при нагревании.
В
результате реакции выделилось 2,8 литров водорода (н.у.).
Вычислите массовую долю углерода в этой смеси.
Слайд 36
Подсказка 1.
Если по условию задачи известны массы или
объемы веществ необходимо рассчитать количества этих веществ (моль).
Далее необходимо
записать уравнения протекающих реакций и провести расчет количеств веществ, участвующих в реакции.
Слайд 37
Решение:
v(Н2) = 2,8/22,4 = 0,125 моль.
рассчитаем количество
вещества водорода (моль).
С раствором щелочи реагирует только кремний:
Si + 2NаОН + Н2О = Na2SiO3
+ 2Н2↑.Рассчитаем количество кремния по данному уравнению реакции. Очевидно, что оно в 2 раза меньше, чем количество вещества водорода :
v(Si) = 0,125/2 = 0,0625 моль.
Найдем массу прореагировавшего кремния:
М(Si) =28 г/моль ( молярная масса кремния)
m(Si) = 0,025.28 = 1,75 г.
m(С) = 5,0-1,75 = 3,25 г.
Массовая доля углерода равна: ω(С) = 3,25/5,0 = 0,65, или 65%.
Ответ. 65% С.
Слайд 38
Задание 5.
Объясните окислительно-восстановительные процессы с участием кремния, показав
переходы электронов методом электронного баланса.
Si + НNО3 +
НF = SiF4↑ + NO↑ +Н2О. Si + NaОН + Н2О = Na2SiO3 + Н2↑.
Расставьте коэффициенты .
Слайд 39
Подсказка 1.
Расставим степени окисления и определим атомы элементов,
участвующие в процессе окисления-восстановления.
Слайд 40
Решение:
Кремний растворяется в смеси концентрированных азотной и плавиковой
кислот:
Si 0+ НN+5О3 + НF = Si+4F4↑ + N+2O↑
+Н2О. Применим метод электронного баланса:
Расставим полученные коэффициенты:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Слайд 41
Решение:
Кремний растворяется в водных растворах щелочей
Расставим степени окисления
и опредилим атомы элементов, участвующие в процессе окисления-восстановления:
Si 0+
2NaОН + Н+2О = Na2Si+4O3 + Н02↑. Применим метод электронного баланса:
Расставим полученные коэффициенты:
Si + 2NaОН + Н2О = Na2SiO3 + 2Н2↑.
Слайд 42 Кремний растворяется в смеси концентрированных азотной и плавиковой
кислот и в водных растворах щелочей, поскольку относится к
типичным восстановителям . В обеих реакциях атом кремния отдает 4 электрона, образуя устойчивые соединения со степенью окисления +4 - Si+4F4↑ и Na2Si+4O3.
Слайд 43
Окислительные свойства углерода и кремния.
Активные металлы — более
сильные восстановители, чем углерод или кремний, поэтому последние при
непосредственном взаимодействии с ними выступают в качестве окислителей.Получение:
Са + 2С = СаС2,
2Mg + Si = Мg2Si.
Соединения углерода и кремния с металлами — карбиды и силициды, помимо рассмотренных реакций получают также взаимодействием кремния с гидридами металлов, например:
2СаН2 + Si = Са2Si + 2Н2↑.
Все эти реакции протекают при высоких температурах.
Слайд 44
Свойства карбидов и силицидов.
Большинство карбидов активно реагируют с
водой (тем более с кислотами), выделяя соответствующие углеводороды:
СаС2 +
2Н2О = Са(ОН)2 + С2Н2↑,Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑,
В отличие от карбидов, с водой и кислотами взаимодействуют лишь силициды щелочных или щелочноземельных металлов, выделяя простейшее водородное соединение кремния моносилан, которое чаще всего называют просто силан SiН4:
Са2Si + 4НСl = 2СаСl2 + SiН4↑.
Слайд 45
Свойства силана.
Силан — бесцветный газ, имеющий запах плесени,
самопроизвольно воспламеняющийся на воздухе, сгорая до SiO2 и воды:
SiН4
+ 2О2 = SiO2 + 2Н2О. При нагревании выше 400 °С без доступа воздуха силан распадается на кремний и водород (один из способов получения кремния):
SiН4 = Si + 2Н2↑.
Щелочи очень легко разлагают силан по уравнению:
SiН4 + 2КОН + Н2О = К2SiO3 + 4Н2↑,
Слайд 46
Получение метана.
Углерод в отличие от кремния непосредственно взаимодействует
с водородом:
С + 2Н2 = СН4 — метан
Реакция
осуществляется при нагревании в присутствии катализатора (мелкий раздробленный никель).
Слайд 47
Задание 6.
«Встретились два богатыря, равные по силе,
одинаковые по массе, чуть тяжелее воздуха. Начали они бороться,
и осталось от них мокрое место на песке...». О каких химических «богатырях» идёт речь?
Слайд 48
Подсказка .
Мокрое место на песке...-предположим, что имеется в
виду смесь песка и воды , т.е. продукты химической
реакции SiO2 + Н2О.Попробуйте предположить каковы исходные вещества этой реакции.
Слайд 49
Решение:
Уравнение химической реакции можно представить, как
Х + Y
= SiO2 + Н2О.
Найдем Х и Y ,
очевидно, что эти вещества содержат атомы Si ,Н и О . Предположим, что Y это O2,
М (O2) = 32 г/моль, т.е. М(Х) = 32 г/моль
Х это силан SiН4
Запишем уравнение химической реакции :
SiН4 + 2О2 = SiO2 + 2Н2О.
Ответ: В условии задачи описана реакция горения силана в кислороде. Два богатыря это SiН4 и O2.
Слайд 50
Тесты
ТЕСТ 1. Алмаз отличается высокой твердостью; он самый
твердый из известных веществ.
1.Да.
2.Нет.
ТЕСТ 2. Алмаз отличается от графита
физическими свойствами.1.Да.
2.Нет.
ТЕСТ 3. Углерод в окислительно -восстановительной реакции может только окисляться
1.Да
2.Нет
ТЕСТ 4. Углерод и кремний восстановливают металлы из их оксидов.
1.Да
2.Нет
ТЕСТ 5. Каменный уголь состоит только из атомов углерода .
1. Да
2. Нет
ТЕСТ 6 . При нагревании угля с оксидом железа (III) образуется железо.
1. Да
2. Нет
Слайд 53
Оксид углерода (II) и оксид кремния (II).
При нагревании
на воздухе углерод и кремний сгорают с образованием оксидов.
Однако процессы окисления идут по-разному.Кремний с кислородом во всех случаях образует оксид кремния (IV).
Оксид кремния (II) может быть получен лишь косвенным путем:
Si + SiO2 = 2SiO.
Они оба не реагируют при обычных условиях ни с кислотами, ни со щелочами. В отличие от угарного газа СО, оксид кремния (II) мало доступен и очень редко используется,
2С + О2 = 2СО
который образуется также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО
При недостатке кислорода углерод образует оксид углерода (II), а при избытке — оксид углерода (IV).
Слайд 54
Оксид кремния (IV) и оксид углерода (IV)
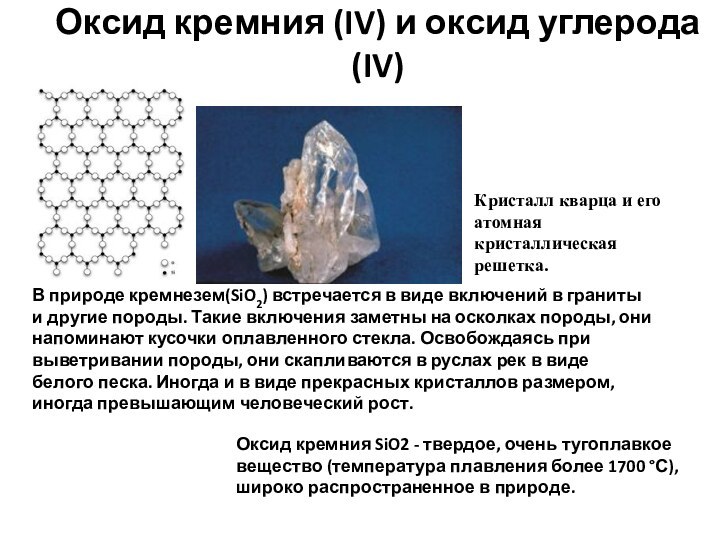
Кристалл кварца и его атомная кристаллическая решетка.
В природе кремнезем(SiO2)
встречается в виде включений в граниты и другие породы. Такие включения заметны на осколках породы, они напоминают кусочки оплавленного стекла. Освобождаясь при выветривании породы, они скапливаются в руслах рек в виде белого песка. Иногда и в виде прекрасных кристаллов размером, иногда превышающим человеческий рост. Оксид кремния SiO2 - твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе.
Слайд 55 Оксид углерода (IV) (диоксид углерода, углекислый газ) -
газ без цвета и запаха, не поддерживающий дыхания и
горения, тяжелее воздуха. Высшие солеобразующие оксиды углерода и кремния довольно сильно отличаются по свойствам. Оксид углерода (IV) - газ, который конденсируется лишь при сильном охлаждении, образуя кристаллическую массу.
Оксид кремния (IV) практически нерастворим в воде.
Оксид углерода (IV) растворяется в воде (1:1 по объему), причем он частично взаимодействует с ней, образуя угольную кислоту:
СO2 + Н2О = H 2СO3
«Сухой лёд» — твёрдый CO2, при обычных условиях (атмосферном давлении и комнатной температуре) переходящий в парообразное состояние, минуя жидкую фазу.
твердый углекислый газ имеет молекулярную решетку: t°пл.= -78,5°
Слайд 56
Получение углекислого газа
1. В промышленности: термическим разложением солей угольной
кислоты (карбонатов).
CaCO3 t=1200˚C→ CaO + CO2
Обжиг известняка
2. В лаборатории:
Действием сильных кислот на карбонаты и гидрокарбонаты –
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
Na2CO3 + 2HCl = 2NaCl + CO2↑ +H2O
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Слайд 57
Качественная реакция на углекислый газ:
Углекислый газ можно обнаружить при
помощи известковой воды. При его пропускании, например так, как
показано на рисунке, происходит помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
Слайд 58
Задание 7.
Ответьте на вопросы:
Какие вещества будете использовать для
осуществления реакции?
С какой целью в воду добавляют раствор
лакмуса? Если раствор нагреть, то окраска лакмуса восстановится. Чем это объясняется?
Напишите уравнения соответствующих реакций.
Прибор для получения углекислого газа.
Слайд 59
Подсказка 1
Вспомните , как с помощью кислоты
можно доказать , что минерал имеет карбонатную (известковую )
природу. Запишите уравнение реакции.
Слайд 60
Решение
Для получения углекислого газа в лаборатории используют нерастворимые
карбонаты ( например, карбонат кальция) и соляную кислоту .
СаСO3 + 2 HCl = СO2 + Н2О + СаCl2
Пробирка для реакции заполняется кусочками мрамора, а через воронку сверху приливается разбавленная соляная кислота
Слайд 61
Подсказка 2
Вспомните каков характер гидроксида, образующегося при взаимодействии
кислотного оксида с водой.
Какие индикаторы могут подтвердить этот
характер.Является ли полученный гидроксид устойчивым?
Запишите уравнение обратимой реакции.
Слайд 62
Решение
Оксид углерода (IV) растворяется в воде с образованием
очень слабой- угольной кислоты, что и обнаруживается с помощью
индикаторов-лакмуса или метилоранжа, меняющих окраску на красную в присутствии кислоты.СO2 + Н2О = H2СO3 – красная окраска лакмуса.
Угольная кислота очень неустойчива и при нагревании вновь выделяется углекислый газ, при этом красная окраска исчезает:
H 2СO3 = СO2 + Н2О
Слайд 63 Химические свойства оксида кремния (IV) и оксидов углерода
(IV)
Оба оксида – типичные кислотные оксиды.
Оксиды взаимодействуют с
основными оксидами, щелочами.Оксид углерода (IV) при пропускании через раствор
СO2 + 2NaOH t˚→ Na2 СO3 + H2O
Оксид кремния (IV) при сплавлении
1) С основными оксидами:
SiO2 + CaO t˚→ CaSiO3
2) Со щелочами:
SiO2 + 2NaOH t˚→ Na2SiO3 + H2O
Слайд 64
Химические свойства оксида углерода (II)
При обычных условиях
CO инертен; при нагревании – восстановитель.
C+2O + CuO t˚C
→ Сu + C+4O2↑ На воздухе он горит голубым пламенем. При этом образуется углекислый газ.
1) Реакция с кислородом
2C+2O + O2 t˚C → 2C+4O2↑
2. Способен восстанавливать металлы из их оксидов. Именно это свойство используется в металлургии при выплавке чугуна.
3. Будучи несолеобраз.ующим оксидом, СО однако реагирует с расплавами щелочей с образованием солеподобного орг соединения- формиата, которое можно считать солью муравьиной кислоты
C+2O + NaOH P → HC+2OONa (формиат натрия)
Слайд 65
Задание 8.
С помощью химических превращений разделите смесь оксида
кремния (IV), карбоната кальция и серебра, последовательно растворяя компоненты
смеси. Опишите последовательность действий.
Слайд 66
Подсказка 1
Для того, чтобы отделить карбонат кальция
используйте подсказку
из предыдущего задания, не забудьте, что углекислый газ после
выделения необходимо снова превратить в карбонат кальция. Для того, чтобы это сделать, вспомните качественную реакцию на углекислый газ . Однако в данном случае легче использовать соль, находящуюся в фильтрате, и реакцией обмена вновь получить из нее карбонат кальция Запишите уравнения реакции.
Слайд 67
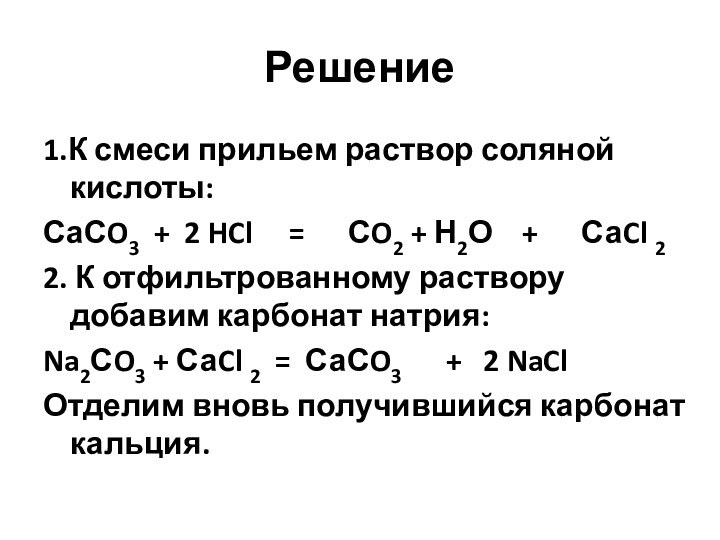
Решение
1.К смеси прильем раствор соляной кислоты:
СаСO3 +
2 HCl = СO2 +
Н2О + СаCl 22. К отфильтрованному раствору добавим карбонат натрия:
Na2СO3 + СаCl 2 = СаСO3 + 2 NaCl
Отделим вновь получившийся карбонат кальция.
Слайд 68
Подсказка 2
В смеси на фильтре остались серебро
и оксид кремния (IV) . Для того, чтобы их
разделить необходимо растворить одно из этих веществ, например серебро, которое легко восстановить из раствора солей.
Слайд 69
Решение
В смеси на фильтре остались серебро и оксид
кремния (IV) . Добавим азотную кислоту. Серебро растворяется с
образованием нитрата серебра. Теперь можно отделить оксид кремния (IV) фильтрованием.4. Оставшийся раствор упарим и прокалим .
2 АgNO3 = 2 Аg+ 2 NO2 + O2
Мы выделили серебро.
Слайд 70
Тесты
ТЕСТ 1. Соединения углерода и кремния очень похожи
по своим физическим свойствам .
1.Да
2.Нет
ТЕСТ3 . Угарный газ легко
вступает в реакции при обычных условиях.1. Нет
2. Да
ТЕСТ 2 . Углекислый газ растворим в воде
1. Нет
2. Да
ТЕСТ 4. Углекислый газ - это типичный кислотный оксид
1. Да
2. Нет
ТЕСТ 5. Углекислый газ тяжелый, поэтому его можно переливать из стакана как жидкость.
1. Да
2. Нет
ТЕСТ 6 . Углекислый газ окисляется кислородом.
1. Да
2. Нет
Слайд 72
Часть 4
Угольная и кремниевая кислоты , их соли.
каолинит
(основная часть глины)
Полевой шпат
Кремниевый топор
Слайд 73 Н2SiO3— твердое вещество, практически нерастворимо в воде, поэтому
катионы водорода в воде практически не отщепляются. В связи
с этим такое общее свойство кислот, как действие на индикаторы, Н2SiO3 не обнаруживает, она еще слабее угольной кислоты. Н2SiO3 — непрочная кислота и при нагревании постепенно разлагается.Н2SiO3 = SiО2 + Н2О.
Н2СО3 — существует только в растворе:
Н2СО3 = Н2О + СО2
Формулы угольной и кремниевой кислот.
Н2СО3 — угольная кислота,
Н2SiO3 — кремниевая кислота.
Слайд 74
Химические свойства кислот
Угольная кислота – двухосновная кислота, диссоциирует
слабо в две ступени:
H2CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔
H+ + CO32- (карбонат-ион)индикатор - лакмус краснеет в водном растворе углекислого газа:
Кремниевая кислота не диссоциирует.
Слайд 75
Соли угольной и кремниевой кислот.
Угольная кислота образует два
ряда солей:
Средние соли - карбонаты Na2СO3, (NH4)2CO3
Кислые соли - бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
В природе встречаются карбонаты кальция CaCO3
в виде:
мел мрамор известняк
Слайд 76
Cuликаты — это соли кремниевой кислоты H2SiO3
Среди
них наиболее распространены алюмосиликаты (понятно, что эти силикаты содержат
алюминий). К алюмосиликатам относятся гранит, различные виды глин, слюды.Слайд 77 Физические свойства карбонатов и силикатов: Все карбонаты и силикаты–
твёрдые кристаллические вещества. Большинство из них в воде не
растворяются. Гидрокарбонаты растворяются в воде. Большинство силикатов в воде нерастворимо.Это вещество часто называют жидким стеклом.
К растворимая солям кремниевой кислоты относятся силикаты щелочных металлов, например, натрия Na2SiO3
Древние бусы из стекла
Стекло – хрупкий, прозрачный материал, способен размягчаться и при застывании принимает любую форму.
Обычное оконное стекло — это силикат состава Na2O•СаО•6SiO2.
Окрашенные стёкла получают введением в шихту (смесь исходных материалов) различных оксидов.
Слайд 78
Качественная реакция на карбонаты и растворимые силикаты.
Действие сильных
кислот на силикаты и карбонаты–
Na2SiO3 + 2HCl →
2NaCl + H2SiO3↓SiO3 -2+ 2H + → H2SiO3↓
Na2СO3 + 2HCl → 2NaCl + H2 О + СO2
СO3 -2+ 2H + → H2 О + СO2
К растворимая солям кремниевой кислоты относятся силикаты щелочных металлов, например, натрия Na2SiO3. Анион соли соединяется с ионами водорода кислоты – получается нерастворимая, слабая кремниевая кислота. Эту реакцию можно считать качественной на анион силиката.
Слайд 79
Химические свойства солей угольной кислоты:
1) Вступают в реакции
обмена с другими растворимыми солями
Na2CO3 + CaCl2 =
CaCO3↓ + 2NaCl2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
Химические свойства солей кремниевой кислоты.
Силикаты реагируют
1) с кислотами
Na2SiO3+2Н2O+2СО2=H2SiO3+2NaHCO3.
2) с солями
Na2SiO3+CaCl2=2NaCl+CaSiO3↓
Слайд 80
Взаимопревращение карбонатов и гидрокарбонатов
При избытке углекислого газа в
присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если
через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция.CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников, , а в природе в результате этой реакции формируются в пещерах свисающие вниз. Другой способ превращения гидрокарбоната в карбонат – добавление основания, при этом кислая соль превращается в среднюю.
Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2 H2O
Слайд 81
Задание 9.
Приведите уравнения реакций, описывающие общие и специфические
химические свойства угольной и кремниевой кислот.
Слайд 82
Подсказка 1
Для того, чтобы записать уравнения общих реакций
для этих веществ, необходимо вспомнить ) общие свойства всех
кислотРеакции с оксидами
Реакцции с основаниями
Реакции с металлами
.
Слайд 83
Решение
1) Реакции общие с другими кислотами,
Как кислоты эти
вещества реагируют одинаково с основаниями.
Н2CO3 + 2NaOH =
Na2CO3 + 2Н2ОН2SiO3 + 2NaOH = Na2CO3 + 2Н2О
Н2CO3 реагирует также с активными металлами и оксидами металлов, а кремниевая поскольку является твердым веществом – только с основаниями:
Н2CO3 + Mg = MgCO3 + Н2
Н2CO3 + СаО = СаСO3 + Н2О
Слайд 84
Подсказка 2
Специфические свойства этих кислот определяются тем фактом,
что обе кислоты очень слабые, при этом кремниевая слабее
угольной.
Слайд 85
Решение
Специфические свойства.
кремниевая кислота не диссоциирует, поэтому в
растворе угольная кислота вытесняет кремниевую из ее солей, а
при прокаливании происходит обратное явление.Na2SiO3+2Н2O+2СО2=H2SiO3+2NaHCO3.
Na2CO3+ SiО2=Na2SiO3 + СО2.
Первый процесс обусловлен тем, что кремниевая кислота более слабая, чем угольная. Силикаты, входящие в состав минералов, в природных условиях разрушаются под действием воды и оксида углерода (IV) - это процесс выветривания горных пород
Второй же процесс объясняется меньшей летучестью оксида кремния (IV).
Слайд 86
Задание 10.
Какой объем углекислого газа необходимо пропустить
(н. у.) через раствор массой 80 г с массовой
долей растворенного вещества гидроксида бария 5% для получения гидрокарбоната бария?
Слайд 87
Подсказка 1
Для успешного решения необходимо вспомнить, что такое
массовая доля растворенного вещества в растворе, и найти массу
вещества участвующего в реакции.Слайд 88 гидроксида бария составляет 5% от общей массы раствора.
Найдем его массу
m(Ва(ОН)2) = 80•0,05 = 4 г
Слайд 89
Подсказка 2
Если по условию задачи известны массы или
объемы веществ необходимо рассчитать количества этих веществ (моль).
Далее необходимо
записать уравнения протекающих реакций и провести расчет количеств веществ, участвующих в реакции.
Слайд 90
3. Рассчитаем объем газа:
V(СО2) = 0,0468•22,4 = 1,05
л.
Ответ. 1,05 л СО2.
Составим уравнение реакции:
2. Рассчитаем количества
веществ исходных соединений, вступивших в реакцию:(Ва(ОН)2) = 4/171 = 0,0234 моль;
По уравнению реакции количество углекислого газа в 2 раза больше:
(СО2) = 2 (Ва(ОН)2) = 2•0,0234 = 0,0468 моль.
Слайд 91
Тесты
ТЕСТ 1. Все кислоты реагируют с растворимыми основаниями
с образованием соли и воды.
Да
Нет
Тест 2 . Кремниевая кислота
реагирует с растворами солей.1. Да
2.Нет
Тест 3. Кремниевая кислота хорошо реагируют с любыми оксидами.
Да
Нет
ТЕСТ 4 . Гидрокарбонаты хорошо растворяются в воде.
1. Да
2. Нет
ТЕСТ 5 . Стекло- твердое вещество молекулярной кристаллической решеткой..
1. Нет
2. Да





























