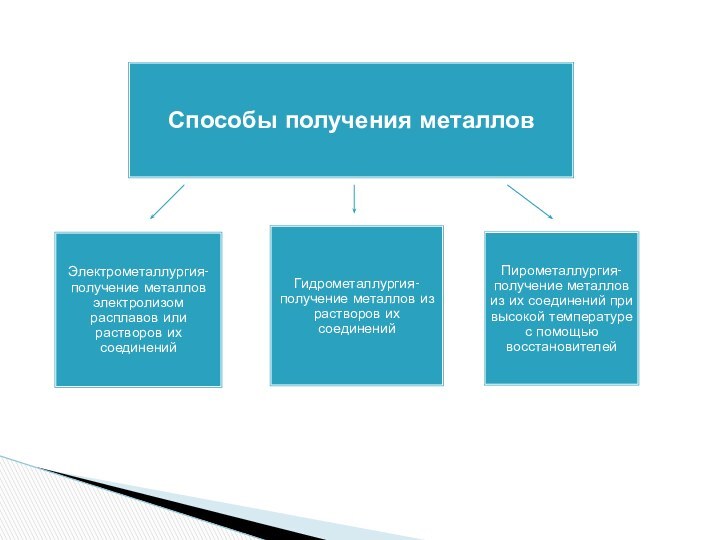
уровне, обладают большими радиусами и низкой электроотрицательностью. Металлы имеют
металлическую кристаллическую решетку(кристаллическая решетка, в узлах которой находятся положительные ионы металлов, окруженные относительно свободными электронами, движущимися по всему объему кристалла).
Имеют металлический блеск
Агрегатное состояние – твердое (кроме ртути)
По цвету разделяют: черные металлы и цветные металлы
У многих большая теплопроводность – т.е. металлы – хорошие проводники электрического тока
Многие из пластичны, ковкие (меняют свою форму)
Имеют разные температуры плавления: разделяют легкоплавкие и тугоплавкие металлы
Металлы по плотности бывают легкие и тяжелые
Металлы могут быть мягкими (например - калий, литий, натрий – они режутся ножом и твердыми (например - хром, которым можно резать стекло)
Физические свойства