Слайд 4
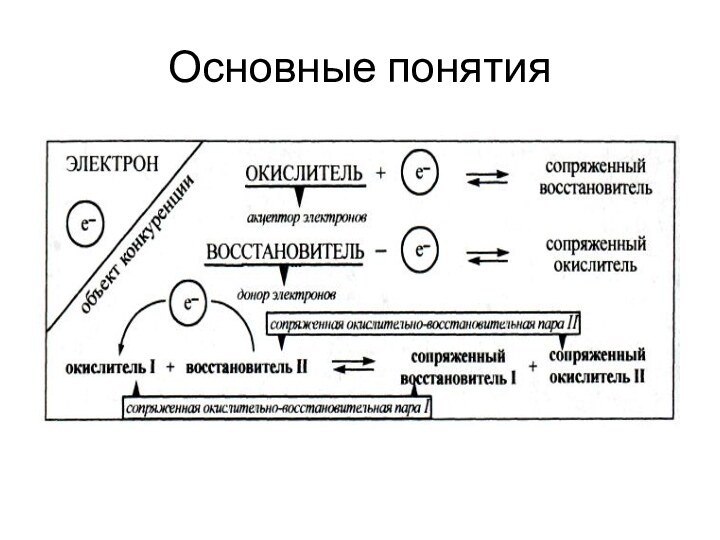
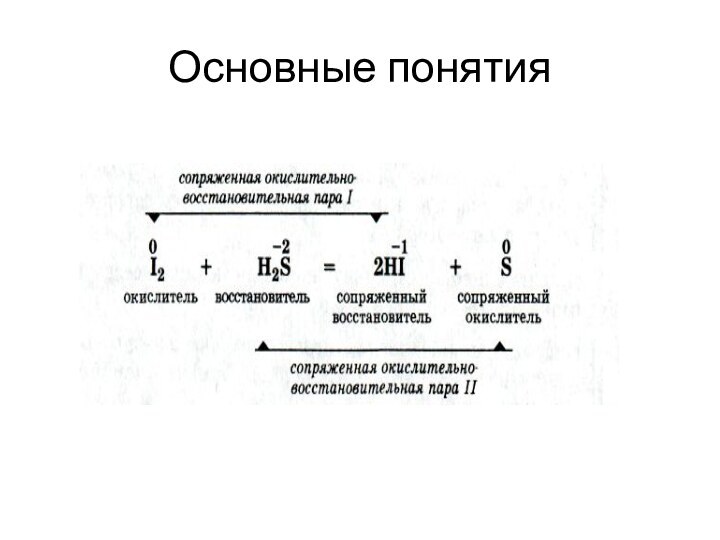
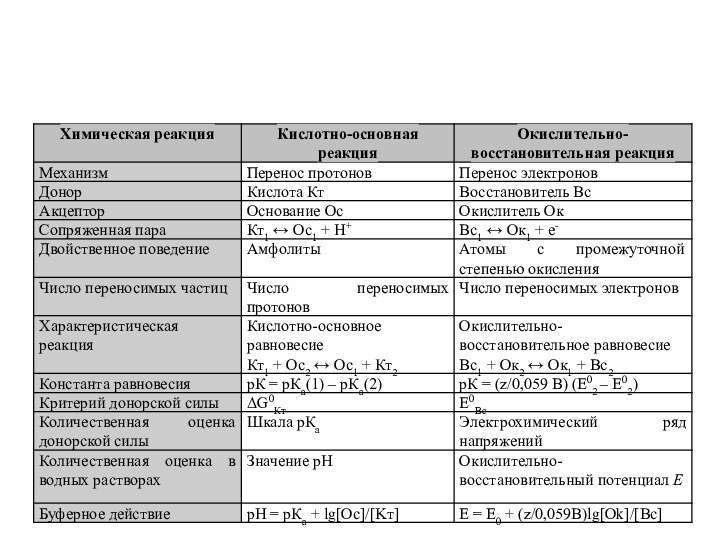
Основные понятия
между окисленной и восстановленной формой осуществляется только
перенос электронов, то редокс систему относят к редокс системам
первого типа
осуществляется перенос как электронов, так и протонов (точнее, ионов гидроксония Н3О+) редокс систему называют редокс системой второго типа
Слайд 5
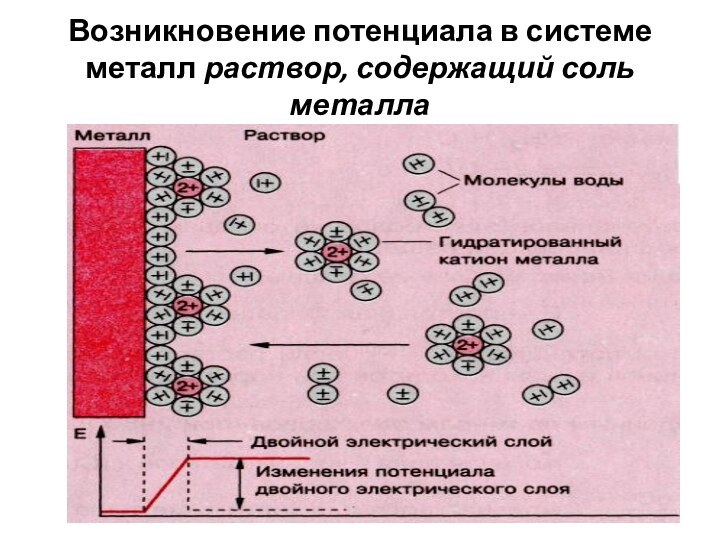
Возникновение потенциала в системе металл раствор, содержащий соль
металла
Слайд 6
Возникновение потенциала в системе раствор, содержащий окислительно-восстановительную пару/платиновый
электрод
Слайд 9
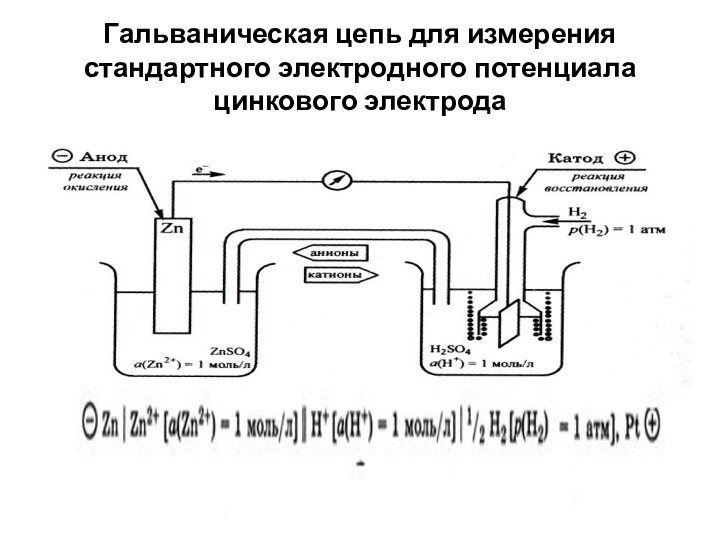
Гальваническая цепь для измерения стандартного электродного потенциала цинкового
электрода
Слайд 13
Направление протекания редокс процессов
–G = nFE где
Е = Еокислителя- Евосстановителя
–G = RTlnK
nFE
= RTlnK
Слайд 14
Направление протекания редокс процессов
Рассмотрим в качестве примера возможность
окисления иода хлоратом калия в стандартных условиях в растворе:
2 ClO3- + I2 ↔ Cl2 + 2IO3-
Cравним стандартные редокс потенциалы двух редокс систем и рассчитаем разность потенциалов:
2ClO3- + 12H+ + 10e- → Cl2 + 6H2O, φ0 = 1,47 B
2IO3- + 12H+ + 10e- → I2 + 6H2O, φ0 = 1,19 B
E0 = φ0ox − φ0red = 1,47−1,19 =0,28 B >0.
Разность потенциалов положительна, следовательно процесс протекает в стандартных условиях в прямом направлении.
Слайд 15
Зависимость редокс потенциала от различных факторов
Температура
Природа системы
рН
Наличие индиферентных
ионов
Конкурирующие процессы
Слайд 16
Влияние рН
Cr2O72– + 14H+ + 6e– = 2Cr3+
+ 7H2O
Слайд 17
Влияние рН
φ´ = 1,232 – 0,138рН
При рН =
7, φ´ = 1,232 – 0,138·7 = 0,266 В
Слайд 19
Особенности редокс - процессов в организме
в живых системах
чаще используют величину формального потенциала (обозначается φr0' ), то
есть потенциала, определяемого при условиях: а(ox) = а(red); рН = 7,36 и температуре 310К.
Жидкая вода устойчива в диапазоне потенциалов от –0,42В до +0,82В
величины формальных редокс–потенциалов редокс - систем, функционирующих в организме, не могут быть ниже –0,42В (сильные восстановители) и выше 0,82В (сильные окислители).
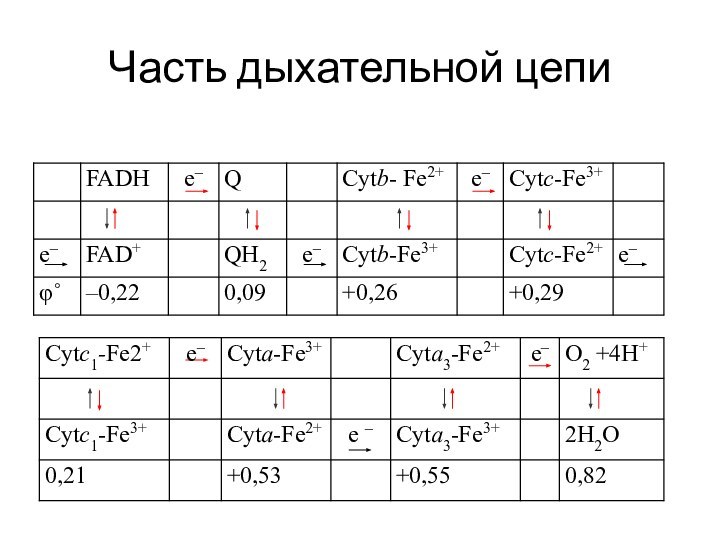
Слайд 20
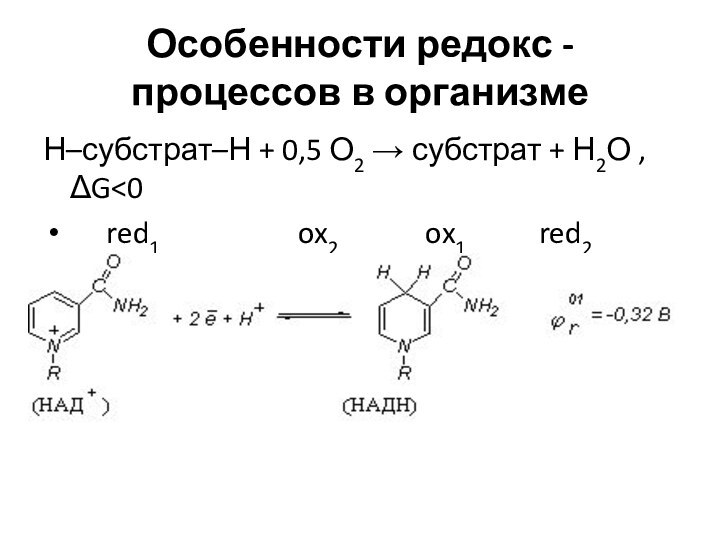
Особенности редокс - процессов в организме
Н–субстрат–Н + 0,5
О2 → субстрат + Н2О , ΔG
red1 ox2 ox1 red2
Слайд 21
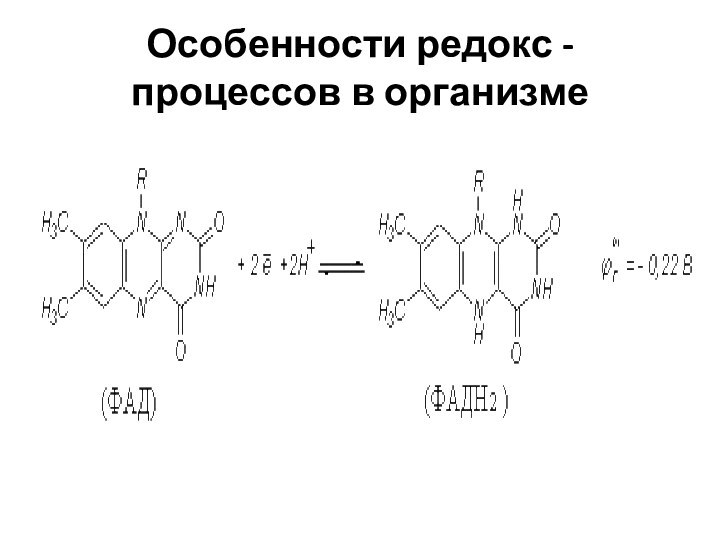
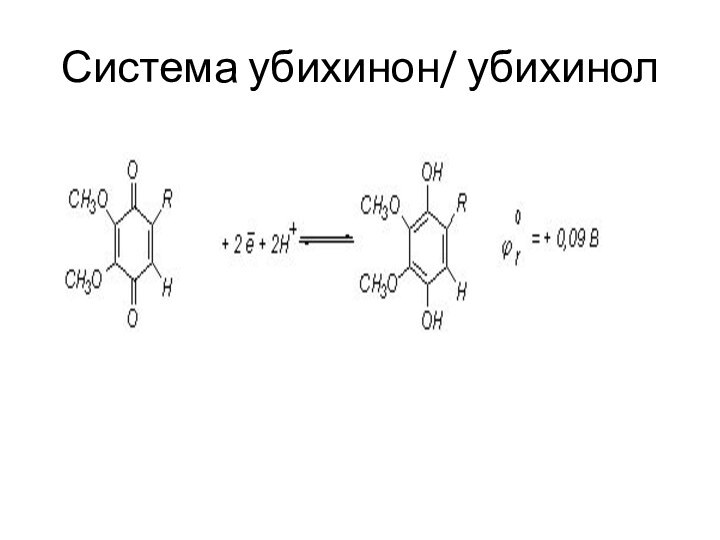
Особенности редокс - процессов в организме