Слайд 2
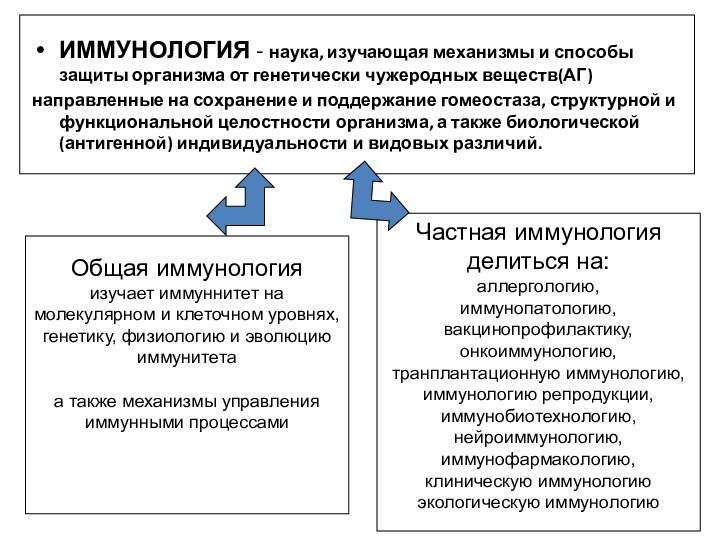
Частная иммунология
делиться на:
аллергологию,
иммунопатологию,
вакцинопрофилактику,
онкоиммунологию,
транплантационную иммунологию,
иммунологию репродукции,
иммунобиотехнологию,
нейроиммунологию,
иммунофармакологию,
клиническую иммунологию
экологическую иммунологию
Общая иммунология
изучает иммуннитет на
молекулярном и клеточном уровнях,
генетику, физиологию и эволюцию
иммунитета
а
также механизмы управления
иммунными процессами
ИММУНОЛОГИЯ - наука, изучающая механизмы и способы защиты организма от генетически чужеродных веществ(АГ)
направленные на сохранение и поддержание гомеостаза, структурной и функциональной целостности организма, а также биологической (антигенной) индивидуальности и видовых различий.
Слайд 3
ИСТОРИЯ РАЗВИТИЯ ИММУНОЛОГИИ
Иммунология как направление исследований возникла из
практической необходимости борьбы с инфекционными заболеваниями
как отдельное научное направление
сформировалась во 2-ой половине ХХ в.
до этого - прикладной раздел инфекционной патологии и микробиологии
Многовековые наблюдения за заразными болезнями заложили фундамент современной иммунологии:
-несмотря на широкое распространение чумы (V век до н.э.), никто не заболевал дважды, по крайней мере смертельно и для захоранения трупов использовали переболевших.
Слайд 4
Древний мир и Средние Века
1000 г. до н.э.
– первые инокуляции содержимого оспенных папул здоровым людям с
целью их защиты от острой формы заболевания проводились в Китае, а затем распространились в Индию, Европу, Малую Азию, на Кавказ.
1546 г. – выходит книга итальянского врача Джироламо Фракасторо "Зараза" в которой он развивает теорию приобретенного иммунитета, выдвинутую еще в XI веке Авиценной.
Авиценна и Фракасторо полагали, что все болезни вызываются мелкими "семенами", переносимыми от человека к человеку. Разные "семена заразы" имеют различное сродство к разным растениям и животным, а внутри организма — к различным органам и жидкостям тела.
Слайд 5
Первые вакцины
С 1701 г. вариоляция (прививание от оспы)
получает распространение в Константинополе, откуда распространяется в Европу.
В 1722
г. принц и принцесса Уэльские привили оспу двум своим дочерям, чем подали пример жителям Англии.
В Лондоне в 1746 г. был открыт специальный госпиталь Святого Панкраса, в котором всем желающим прививали оспу.
1768 г. один из лучших врачей – инокуляторов Томас Димсдейл произвел оспопрививание императрице Екатерине II и ее сыну Павлу.
В 1796 г. после тридцати лет исследований Эдвард Дженнер опробовал метод прививания людей коровьей оспой на 8-летнем мальчике, а затем еще на 23 людях.
В 1798 г. Дженнер опубликовал результаты своих исследований. разработал врачебную технику оспопрививания, которую назвал вакцинацией (от лат. vaccus — корова).
Слайд 6
Иммунологическая революция
В 1880 г.-статья Луи Пастера о защите
кур от холеры путем их иммунизации патогеном со сниженной
вирулентностью.
В 1881 г. он проводит эксперимент по прививке овцам сибиреязвенной вакцины
в 1885 г. успешно испытывает вакцину от бешенства на мальчике, укушенном бешеной собакой. - зарождение инфекционной иммунологии и начало эры вакцинации.
Пастер разработал принципы вакцинации и успешно применял их на практике, но не знал о факторах, включенных в процесс защиты от инфекции.
В 1890 г. Эмиль фон Беринг и С. Китасато показали, что в крови людей, переболевших дифтерией или столбняком, образуются антитоксины, которые обеспечивают иммунитет к этим болезням как самим переболевшим, так и тем, кому такая кровь будет перелита.
На основе этих открытий был разработан метод лечения кровяной сывороткой.
1901 г. Э. Берингу была присуждена первая Нобелевская премия по физиологии и медицине
Слайд 7
В 1883 г. русский биолог – иммунолог Илья

Мечников сделал сообщение по фагоцитарной теории иммунитета- начало познания
вопросов клеточного иммунитета.
показал, что в организме человека присутствуют особые амебоидные подвижные клетки – нейтрофилы и макрофаги, которые поглощают и переваривают патогенные микроорганизмы. Именно им он отдавал первичную роль в защите организма.
В 1891 г. статья немецкого фармаколога Пауля Эрлиха, в которой он термином "антитело" обозначает противомикробные вещества крови.
Параллельно с Мечниковым Эрлих разрабатывал свою теорию иммунной защиты организма:
заметил, что основным свойством АТ является их ярко выраженная специфичность
выдвинул теорию «боковых цепей», в соответствии с которой АТ в виде рецепторов предшествуют на поверхности клеток. Позже эта в целом умозрительная теория подтвердилась с некоторыми изменениями.
Две теории – фагоцитарная (клеточная) и гуморальная – в период своего возникновения стояли на антагонистических позициях.
В 1908 г. Мечников и Эрлих разделили Нобелевскую премию в области медицины, а позже выяснилось, что их теории дополняют друг друга.
Слайд 8
В 1900 г. австрийский врач – иммунолог Карл
Ландштейнер открыл группы крови человека, за что в 1930
г. был удостоен Нобелевской премии.
В 1904 г. известный химик Сванте Аррениус доказал обратимость взаимодействия антиген – антитело и заложил основы иммунохимии.
В 1908 г. в Германии и Франции основаны первые научные журналы, публикующие статьи по иммунологии, — Zeitschrift fur Immunitatsforschung и Annales de I'lnstitut Pasteur,
с 1916 г. в США выходит American Journal of Immunology.
В 1913 г. была организована Американская ассоциация иммунологов (American Association of Immunologists).
К концу 40-х - началу 50-х годов ХХ столетия завершается первый период развития иммунологии.
Был создан целый арсенал вакцин против самого широкого набора инфекционных заболеваний (оспы, бешенства, холеры, чумы, брюшного тифа, желтой лихорадки, дифтерии, столбняка)
Несмотря на успехи инфекционной иммунологии, экспериментальная и теоретическая иммунология оставались в зачаточном состоянии
Слайд 9
Прорыв в теоретической иммунологии
Новый этап развития –австрал. вирусолог

Фрэнк Бернет в 1960 г. получил Нобелевскую премию.
рассматривал иммунитет
как реакцию, направленную на дифференциацию всего «своего» от всего «чужого»
поднял вопрос о значении иммунных механизмов в поддержании генетической целостности организма в период индивидуального (онтогенетического) развития
обратил внимание на ЛФ(«иммуноцит») как основной участник специфического иммунного реагирования
Бернет предсказал, а англичанин Питер Медавар и чех Милан Гашек экспериментально подтвердили состояние, противоположное иммунной реактивности - толерантности.
указал на особую роль тимуса в формировании иммунного ответа
остался в истории иммунологии как создатель клонально-селекционной теории иммунитета: один клон ЛФ реагировать только на одну конкретную, антигенную, специфическую детерминанту.
Изучение иммуноглобулинов началось с работы по электрофорезу белков крови Арне Тиселиуса 1937 года.
в течение 40х -60х гг. были открыты классы и изотипы иммуноглобулинов,
в 1962 г. Р.Портер предложил модель структуры молекул иммуноглобулинов, которая оказалась универсальной и совершенно верной и по сегодняшний день наших знаний.
Слайд 10
60-е — начало 80-х г. — этап выделения

всевозможных факторов - гуморальных медиаторов И.О. из супернатантов клеточных
культур
с середины 80-х г. и по настоящее время в иммунологию вошли методы молекулярного клонирования, трансгенные мыши и мыши с удалением заданных генов (knokout).
В работах Джеймса Гованса 60-х годов XX в. показана роль лимфоцитов в организме
в опытах на крысах показал, что хронический дренаж грудного лимфатического протока, который физически "вынимает" ЛФ из организма, приводит к утрате способности животных к развитию И.О.
В середине XX в. команда во главе с американским генетиком и иммунологом Джорджем Снеллом проводила опыты с мышами, которые привели к открытию главного комплекса гистосовместимости и законов трансплантации, за что Снелл и получил Нобелевскую премию за 1980 г.
В 2011 г. Нобелевскую премию в области физиологии и медицины получил французский иммунолог Жюль Хоффманн за работу «по исследованию активации врожденного иммунитета».
В XXI веке основными задачами иммунологии стали: изучение молекулярных механизмов иммунитета — как врождённого, так и приобретённого, разработка новых вакцин и методов лечения аллергии, иммунодефицитов, рака.
Слайд 12
Иммунитет–физиологическая функция, которая обуславливает невосприимчивость организма к генетически
чужеродным веществам (АГ), эндогенного или экзогенного происхождения с целью
сохранения и поддержания гомеостаза, структурной и функциональной целостности организма, а так же биологической (АГ) индивидуальности и видовых различий.
Термин «иммунитет» имеет латинский корень (от лат. Immunitas), обозначающий освобождение, избавление от чего-либо.
Первоначально под иммунитетом понимали резистентность или невосприимчивость организма к действию микроорганизмов.
реакции организма, направленные на нейтрализацию всего чужеродного, попадающего в его внутреннюю среду
Слайд 13
иммунная система
помимо защиты от микроорганизмов
бдительно отслеживает пути проникновения
в организм чужеродного белка с вдыхаемым воздухом, через кожу
или стенку кишечника, инъекционным путем и стремится нейтрализовать его действие.
отслеживает отклонения в «поведении» собственных клеток организма, оберегая его от размножения тех из них, которые склонны к злокачественному росту.
САМОСТОЯТЕЛЬНАЯ система имеет 3 особенности:
генерализована по всему телу
ее клетки постоянно циркулируют по всему телу через кровоток;
обладает универсальной способностью вырабатывать антитела, различные по своей специфике в отношении каждого антигена.
Слайд 14
Факторы регулирующие постоянство внутренней среды организма
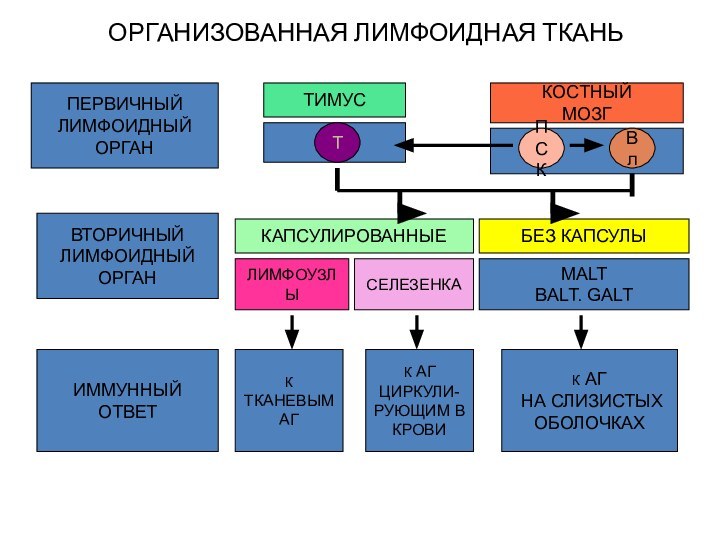
Иммунная система организма
- совокупность лимфоидных органов и тканей, которые определяют контроль
за антигенным постоянством внутренней среды организма.
Органы: красный костный мозг, тимус, селезенка, лимфоузлы и лимфатические образования кишечника и других органов.
Слайд 15
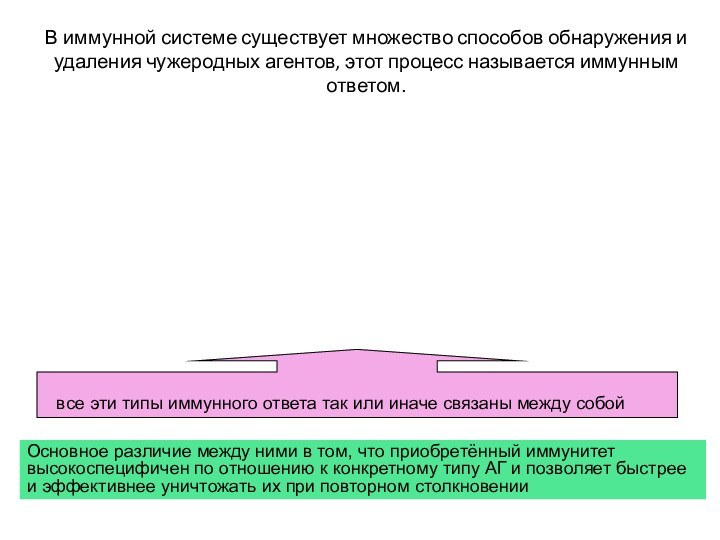
В иммунной системе существует множество способов обнаружения и
удаления чужеродных агентов, этот процесс называется иммунным ответом.
все эти типы иммунного ответа так или иначе связаны между собой
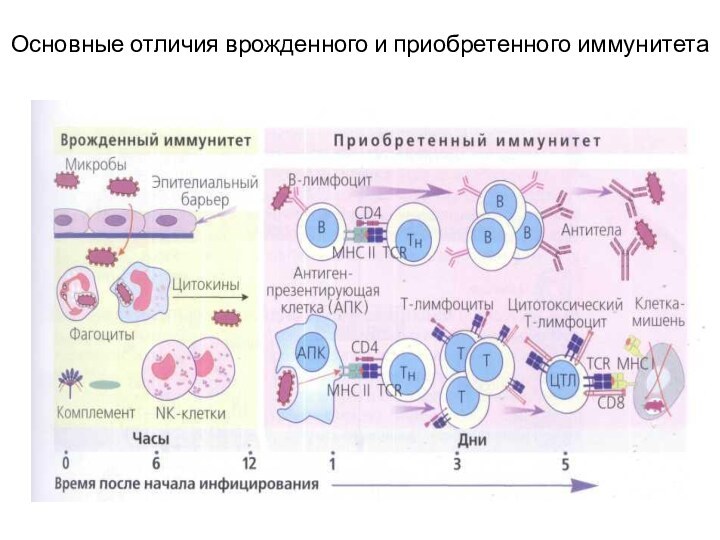
Основное различие между ними в том, что приобретённый иммунитет высокоспецифичен по отношению к конкретному типу АГ и позволяет быстрее и эффективнее уничтожать их при повторном столкновении
Слайд 17
Факторы врожденного и приобретенного иммунитета
Слайд 19
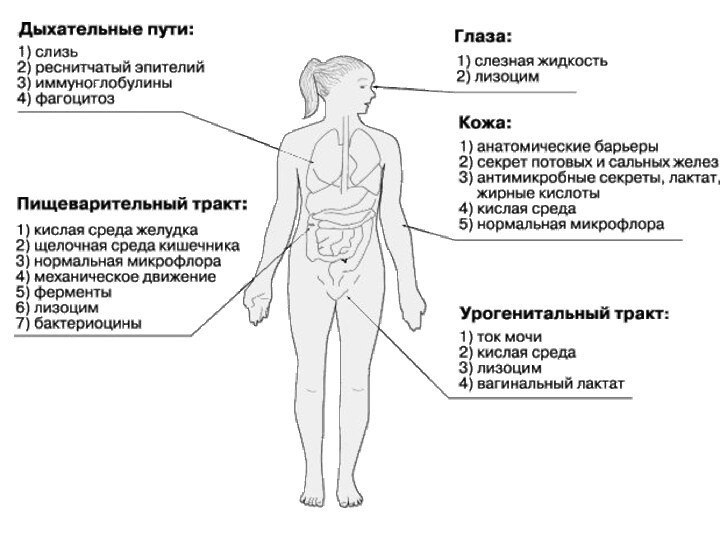
Неспецифическая резистентность определяется целостностью кожных покровов и слизистых,
их функциональной активностью, состоянием фагоцитов.
Врожденный иммунитет определяется
в значительной
степени системой комплемента.
Приобретенный иммунитет определяют Т- и В- лимфоциты.
специфичность и память — это две основных его характеристики.
Механизмы, обеспечивающие естественную резистентность (неспецифическую защиту), не зависят от антигенной специфичности чужеродного агента.
Не распознают попадающие в организм вещества и инфекты, как генетически чужеродный материал, но действуют не менее эффективно, чем факторы приобретенного иммунитета, способствуя их элиминации.
Механизмы естественной резистентности и приобретенного иммунитета тесно переплетаются: их взаимодействие осуществляется на всех этапах проникновения, размножения возбудителя в организме и его элиминации.
Факторы естественной резистентности первыми «встают» на защиту при действии патогенных (чаще всего инфекционных) агентов.
Слайд 20
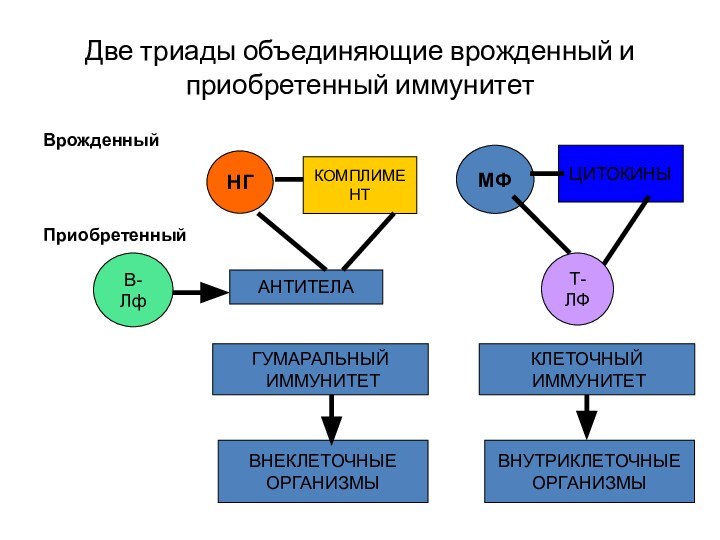
Две триады объединяющие врожденный и приобретенный иммунитет
Врожденный
Приобретенный
НГ
МФ
КОМПЛИМЕНТ
ЦИТОКИНЫ
В-Лф
АНТИТЕЛА
Т-ЛФ
ГУМАРАЛЬНЫЙ
ИММУНИТЕТ
КЛЕТОЧНЫЙ
ИММУНИТЕТ
ВНЕКЛЕТОЧНЫЕ
ОРГАНИЗМЫ
ВНУТРИКЛЕТОЧНЫЕ
ОРГАНИЗМЫ
Слайд 21
Основные отличия врожденного и приобретенного иммунитета
Слайд 22
ВИДЫ ИММУНИТЕТА
Видовой иммунитет (врожденный) - генетически закрепленная невосприимчивость

присущая каждому виду. Например, человек никогда не заболевает чумой
крупного рогатого скота. Крысы резистентны к дифтерийному токсину.
Приобретенный иммунитет формируется в течение жизни индивидуума и не передается по наследству; может быть естественным и искусственным, активным и пассивным.
Естественно приобретенный (активный) развивается после перенесенного инфекционного заболевания, протекавшего в клинически выраженной форме, либо после скрытых контактов с микробными Аг (так называемая бытовая иммунизация). В зависимости от свойств возбудителя и состояния И.С. невосприимчивость м.б. пожизненной (например, после кори), длительной (после брюшного тифа) или кратковременной (после гриппа).
Инфекционный (нестерильный) - особая форма приобретенной невосприимчивости; не является следствием перенесенной инфекции, обусловлен наличием инфекционного агента в организме. Невосприимчивость исчезает сразу после элиминации возбудителя из организма (например, туберкулез; вероятно, малярия).
Естественный пассивный связан с переносом IgG от матери к плоду через плаценту или с грудным молоком (SIgA) новорожденному. Это обеспечивает устойчивость новорожденного ко многим возбудителям в течение некоторого, индивидуально варьирующего срока.
Естественный пассивный иммунитет ребенка создается за счет материнских антител.
Слайд 23
ВИДЫ ИММУНИТЕТА
Искусственно приобретенный иммунитет- развивается в результате вакцинации,

серопрофилактики (введение сыворотки) и других манипуляций.
Активно приобретенный иммунитет развивается
после иммунизации ослабленными или убитыми м/о либо их АГ. Оганизм активно участвует в создании невосприимчивости, отвечая развитием И.О. и формированием клеток памяти.
Пассивно приобретенный иммунитет достигается введением готовых АТ или, реже, сенсибилизированных ЛФ. И.С.реагирует пассивно, не участвуя в развитии соответствующих иммунных реакций.
Иммунитет может формироваться против м/о, их токсинов, вирусов, АГ опухолей- иммунитет называют антимикробным, антитоксическим, антивирусным, противоопухолевым
трансплантационный иммунитет =при трансплантации несовместимых тканей возникает (реакция отторжения трансплантата).
местный иммунитет-
поступление в организм АГ через дыхательные пути, пищеварительный тракт и другие участки слизистых поверхностей и кожи нередко обуславливает развитие выраженной локальной иммунной реакции.
Слайд 24
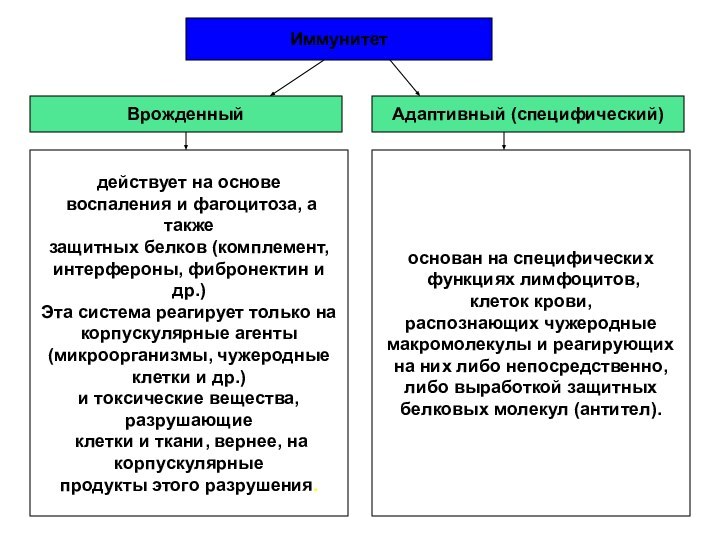
Иммунитет
Врожденный
Адаптивный (специфический)
основан на специфических
функциях лимфоцитов,
клеток крови,
распознающих чужеродные
макромолекулы и реагирующих
на них либо непосредственно,
либо выработкой защитных
белковых молекул (антител).
действует на основе
воспаления и фагоцитоза, а также
защитных белков (комплемент,
интерфероны, фибронектин и др.)
Эта система реагирует только на
корпускулярные агенты
(микроорганизмы, чужеродные
клетки и др.)
и токсические вещества,
разрушающие
клетки и ткани, вернее, на
корпускулярные
продукты этого разрушения.
Слайд 25
Воспаление
— одна из наиболее ранних реакций иммунной системы

на инфекцию.
К симптомам относятся покраснение и отек, что
свидетельствует о усилении притока крови к вовлеченным в процесс тканям.
В развитии воспалительной реакции важную роль играют эйкозаноиды и цитокины, высвобождаемые поврежденными или инфицированными клетками.
К эйкозаноидам относятся простагландины, вызывающие повышение температуры и расширение кровеносных сосудов, и лейкотриены, которые привлекают определённые виды белых кровяных телец (лейкоцитов
К наиболее распространённым цитокинам относятся интерлейкины, отвечающие за взаимодействие между лейкоцитами, хемокины, стимулирующие хемотаксис, и интерфероны, обладающие противовирусными свойствами, в частности способностью угнетать синтез белка в клетках макроорганизма
Кроме того, могут играть роль выделяемые факторы роста и цитотоксические факторы. Эти цитокины и другие биоорганические соединения привлекают клетки иммунной системы к очагу инфекции и способствуют заживлению поврежденных тканей путём уничтожения возбудителей
Слайд 26
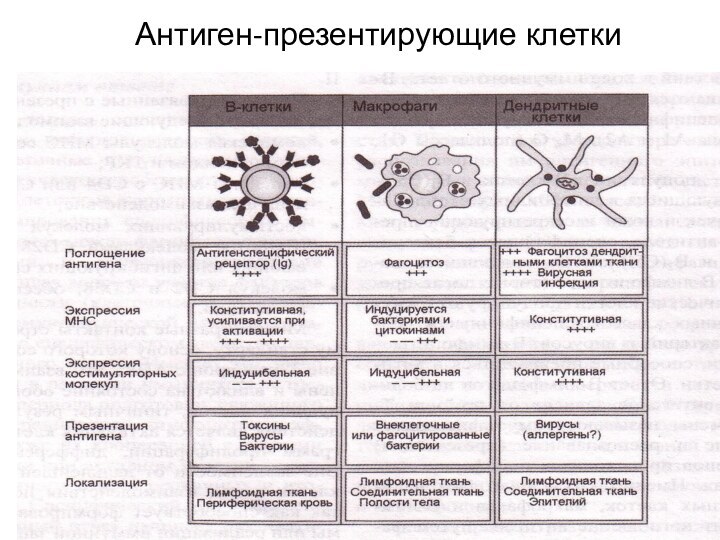
В системе неспецифической резистентности центральное место занимают
Нейтрофильные гранулоциты-первые
встречают АГ
моноциты-макрофаги (МОН/МФ)
в определенных случаях они способны переходить из
одной формы в другую: из БАЗ формируются тучные клетки, МОН превращаются в МФ.
МОН/МФ (помимо фагоцитоза) в специфическом иммунитете — являются антигенпрезентирующими клетками, т.е. подготавливают АГ для узнавания специализированными ЛФ.
натуральные или естественные киллеры (НК), происходят от прелимфоцитов, дифференцировка завершается в селезенке, атакуют и уничтожают опухолевые клетки, или инфицированные вирусами клетки.
Вспомогательные клетки:Тучные клетки, ЭОЗ, БАЗ тромбоциты
Слайд 27
Ключевое место во врожденном иммунитете занимает система комплемента
Термин

«комплемент» применен для описания «дополнительных» субстратов в сыворотке, для
лизиса бактерий под действием специфических АТ.
в системе С >25 белков и их активных фрагментах, из которых 9 — комплементные белки (С1-С9), а остальные — факторы комплемента (B, D, P, H и др.).
Главной функцией системы С: является отличие «своего» от «чужого», что осуществляется за счет регуляторных молекул находящихся на клетках организма и подавляющих активацию комплемента.
При попадании в кровь и ткани активаторов (грамм-(+) или грамм-(-) бактерии, вирусы, м/о, иммунные комплексы) происходит каскадное взаимодействие белков системы комплемента с образованием продуктов, повреждающих мембраны клеток-мишеней.
Центральное место в системе комплемента занимает - С3. В плазме крови постоянно происходит «холостая» активация С3, приводящая к фиксации небольшого числа С3 на поверхности как «своего», так и «чужого». На поверхности собственных клеток регуляторные белки вызывают разрушение связавшихся молекул С3 и подавляют дальнейшую активацию комплемента. На чужеродных структурах, лишенных регуляторных белков, напротив, начинается его активация.
функции системы комплемента: лизис клеток; растворение ИК; участие в фагоцитозе; воспалительной реакции; образование хемотаксинов; модуляция иммунного ответа; нейтрализация веществ.
Слайд 28
АДАПТИВНЫЙ иммунитет -ведущая роль принадлежит ЛФ
-специфически

распознают конкретный возбудитель
внутри или вне клеток, в тканевой
жидкости или в крови.
B- и T-ЛФ имеют рецепторы, которые распознают АГ.
Рецепторы представляют из себя «зеркальный отпечаток»
определённой части чужеродной молекулы, способный присоединяться к ней.
При этом 1 клетка может содержать рецепторы только для 1 вида АГ.
T-лимфоциты
распознают чужеродные («не-свои») мишени, только после того, как АГ будут обработаны и презентированы в сочетании с собственной («своей») биомолекулой главного комплекса гистосовместимости (MHC).
Среди T-л различают ряд подтипов: Т-киллеры, Т-хелперы и регуляторные Т-клетки, гамма-дельта T-клетки (γδ T-клетки).
B-лимфоциты
не нуждаются в презентации АГ. Их рецепторы к АГ представляют - антителоподобные белки.
Каждая прошедшая дифференцировку линия B-Л экспрессирует уникальное только для неё АТ, и никакое другое.
Т.о. полный набор АГ рецепторов всех B-Л организма представляет все АТ, которые организм может вырабатывать.
Функция B-ЛФ заключается в выработке антител — гуморального субстрата специфического иммунитета — действие которых направлено прежде всего против внеклеточно расположенных возбудителей.
Слайд 29
Реакция отторжения трансплантата от тканей хозяина
Следующий этап в

понимании И.С.- открытие закономерностей реакции отторжения трансплантата от тканей
хозяина.
Был открыт комплекс АГ на ЛФ имеющих непосредственное отношение к реакции отторжения трансплантанта — Нuman Leukocyte Antigen (HLA — человеческий антиген лейкоцитов).
До конца 60-х -начала 70-х было известно свойство комплекса — контроль синтеза АГ, вызывающих иммунную реакцию отторжения пересаженной ткани.
Затем, при анализе механизмов взаимодействия генетически отличающихся клеток был выявлен достаточно широкий спектр биологической активности HLA комплекса- последний получил название главного комплекса гистосовместимости (ГКГ).
Антигены ГКГ - белковые комплексы, кодируемые группой тесно сцепленных генов, находящихся на коротком плече 6-й хромосомы.
ГКГ занимает 3500 kb (kb — это тысяча пар оснований) и содержит более 220 генов. Выделено 3 класса генов ГКГ. Поэтому и продукты ГКГ принято подразделять на антигены трех классов.
Практически на всех ядросодержащих клетках (кроме клеток нейроглии ворсинчатого трофобласта человека) имеются АГ- HLA класса I.
Они широко представлены на лимфоидных клетках и в меньшей степени — клетках печени, легких, почек. Еще реже они встречаются на клетках мозга и скелетных мышц.
Слайд 30
Распределение АГ HLA класса II более ограничено:
ассоциированы

с B-ЛФ, антигенпрезентирующими клетками (клетки Купфера, дендритные клетки, клетки
альвеолярного эпителия легких ) и макрофагами.
Структура генов МНС I и II класса исследована : определена аминокислотная последовательность; пространственная структура некоторых из них, например, HLA-A2. Оба класса белков HLA антигенов относятся к иммуноглобулиновому суперсемейству.
МНС принадлежит центральное место в дифференцировке и окончательном созревании Т-лимфоцитов.
В тимусе происходит дифференцировкаТ-клеток на субпопуляции (Т-киллеры, Т-хелперы)
Основная причина гибели более 90% поступающих из КМ ранних предшественников Т-клеток, связана с жесткостью селекционных процессов — положительным отбором только тех клеток, которые способны реагировать со своими собственными АГ- МНС.
Все остальные клетки, не прошедшие контроля на специфичность, погибают.
Т.о. в определении судьбы тимоцитов АГ МНС выступают и как факторы селекции, определяя становление клонов Т-клеток, способных распознавать собственные АГ, и как факторы дифференцировки, от которых зависит формирование функционально самостоятельных субпопуляций.
Часть генов МНС вовлечена в процессы дифференцировки клеток у эмбриона, а возможно, и в плаценте.
Слайд 31
Антигены
Проникшие в организм чужеродные АГ (бактерии, вирусы, трансплантационные
АГ, белки и др.) провоцируют образование строго специфических АТ
и/или формируют соответствующий клон ЛФ.
Под АГ подразумеваются химические вещества, свободные, либо входящие в состав клеток, способные индуцировать иммунный ответ, сводящийся к удалению этого АГ.
Полноценный АГ состоит из двух частей: носителя и эпитопа. Носитель или стабилизирующая часть составляет до 97-99% массы молекулы АГ и представляет собой инертную часть АГ
Эпитоп или детерминантная часть молекулы АГ (олигосахариды или олигопептиды), располагающиеся на поверхности молекулы (эпи-)
- детерминантная группа определяет специфичность АГ
Слайд 32
АНТИТЕЛА
своей природе все существующие АТ представляют собой иммунноглобулины-Ig.
иммуноглобулины
и антиген-связывающие рецепторы имеют между собой определенные различия, разнообразие
антигенной специфичности тех и других формируется сходными механизмами.
известны 5 классов иммуноглобулинов:
IgM,
IgG,
IgA,
IgD
IgE.
Каждый класс обладает своими структурными и биологическими свойствами, однако все они построены по общему плану.
Слайд 34
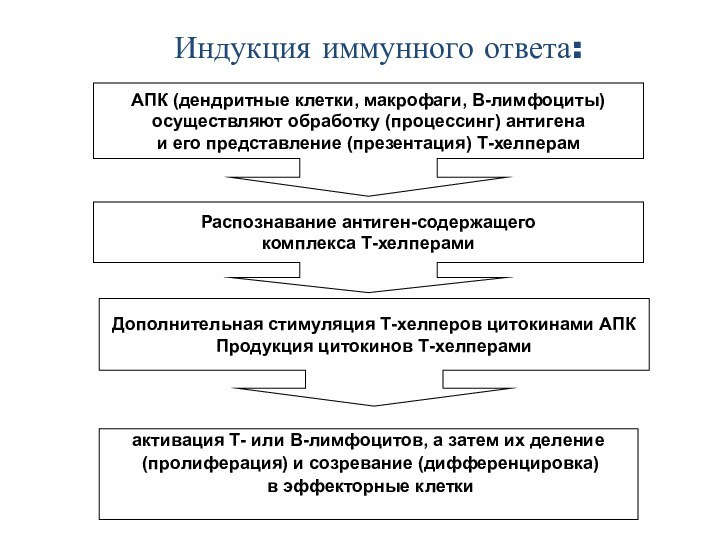
Индукция иммунного ответа:
АПК (дендритные клетки, макрофаги, В-лимфоциты)
осуществляют
обработку (процессинг) антигена
и его представление (презентация) Т-хелперам
Распознавание антиген-содержащего
комплекса Т-хелперами
Дополнительная стимуляция Т-хелперов цитокинами АПК
Продукция цитокинов Т-хелперами
активация Т- или В-лимфоцитов, а затем их деление
(пролиферация) и созревание (дифференцировка)
в эффекторные клетки
Слайд 35
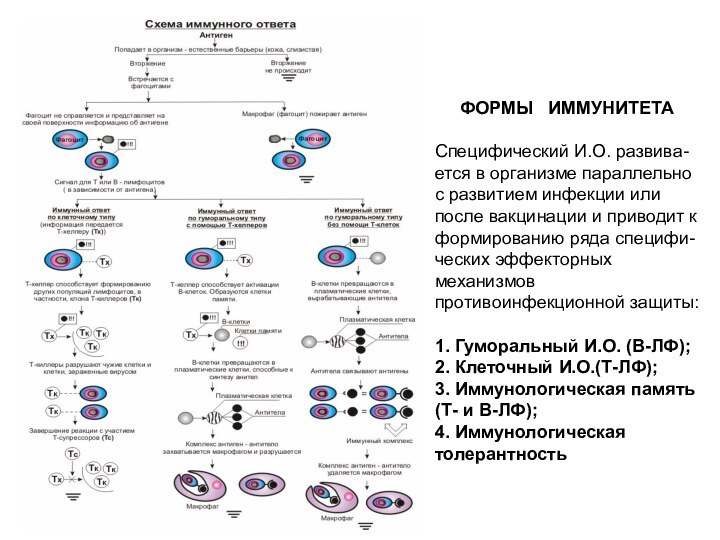
ФОРМЫ ИММУНИТЕТА
Специфический И.О. развива-ется в организме параллельно с
развитием инфекции или после вакцинации и приводит к формированию
ряда специфи-ческих эффекторных механизмов противоинфекционной защиты:
1. Гуморальный И.О. (В-ЛФ);
2. Клеточный И.О.(Т-ЛФ);
3. Иммунологическая память (Т- и В-ЛФ);
4. Иммунологическая толерантность
Слайд 36
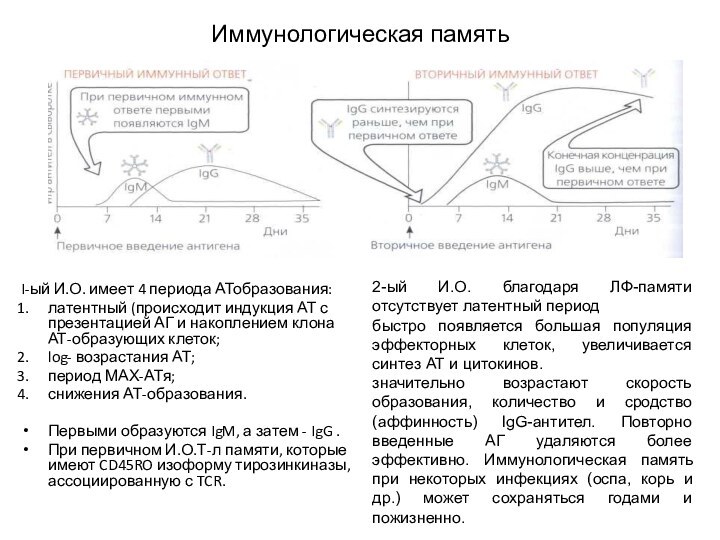
Иммунологическая память
I-ый И.О. имеет 4 периода АТобразования:
латентный
(происходит индукция АТ с презентацией АГ и накоплением клона
АТ-образующих клеток;
log- возрастания АТ;
период МАХ-АТя;
снижения АТ-образования.
Первыми образуются IgM, а затем - IgG .
При первичном И.О.Т-л памяти, которые имеют CD45RO изоформу тирозинкиназы, ассоциированную с TCR.
2-ый И.О. благодаря ЛФ-памяти отсутствует латентный период
быстро появляется большая популяция эффекторных клеток, увеличивается синтез АТ и цитокинов.
значительно возрастают скорость образования, количество и сродство (аффинность) lgG-антител. Повторно введенные АГ удаляются более эффективно. Иммунологическая память при некоторых инфекциях (оспа, корь и др.) может сохраняться годами и пожизненно.
Слайд 37
Иммунологическая толерантность - отсутствие и.о. при наличии в

организме АГ(толерогенов), доступных ЛФ. Наиболее толерогенными являются растворимые АГ,
т. к. не вызывают у АПК экспрессию соответствующих костимулирующих молекул для иммунного ответа
Естественная И.Т. (аутотолерантность) — толерантность к АГ(аутоАГ) собственных тканей и клеток. Она обусловлена (-)-селекцией аутореактивных клонов ЛФ. Толерантность к собственным АГ организма развивается в процессе онтогенеза за счет уничтожения аутореактивных клонов ЛФ*.
Т-л подвергаются (-)-селекции в тимусе, а большинство В-л — в костном мозге.
АГ так называемых «забарьерных органов» в норме не вызывают аутоиммунного ответа, т.к. не контактируют с клетками И.С.; при травме, длительной инфекции эти АГ попадают в кровь и вызывают И.О. против АГ«забарьерного органа». Кроме этого экспрессия Fas-лиганда (FasL) на клетках «забарьерных органов» может вызвать при контакте апоптоз Т-лимфоцитов, имеющих Fas-рецептор (CD95).
Искусственная И.Т. возможна при введении чужеродных АГ плоду или сразу после рождения (т. е. в период «иммунологической незрелости»), при разрушении или подавлении И.С. в результате облучения, введения цитотоксических АГ и др.
Иммунологическая толерантность развивается по следующим направлениям:
делеция клона ЛФ, связавших АГ своими рецепторами и (вместо активации) погибающих в результате сигнала на апоптоз. Делеция аутореактивных клонов ЛФ развивается в тимусе и КМ (центральная толерантность);
анергия клона ЛФ из-за отсутствия активации ЛФ, связавших АГ своими Т- или В-клеточными рецепторами (отсутствие презентации АГ, отсутствие костимулирующих сигналов, цитокинов, ингибирующее действие супрессирующих клеток и факторов). Например, Т-л не отвечает на АГ, если при его презентации у АПК не экспрессируются костимулирующие молекулы В7 (CD80 и CD86).
Слайд 38
Иммунная система представляет комплекс специализированных лимфоидных органов, а
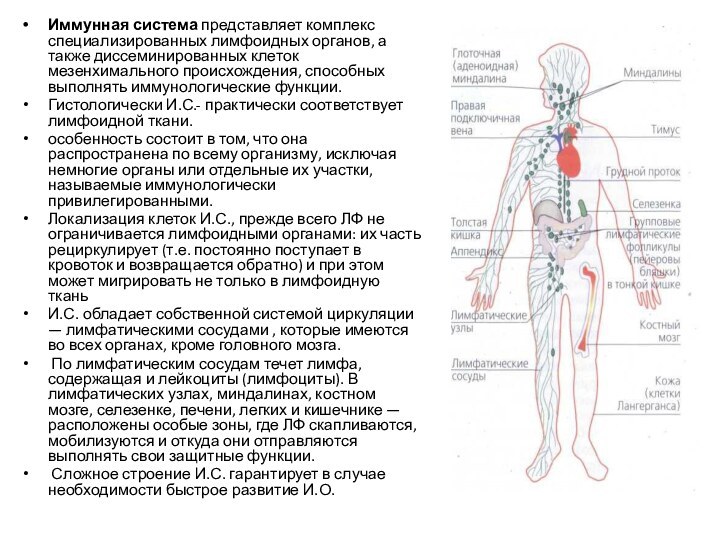
также диссеминированных клеток мезенхимального происхождения, способных выполнять иммунологические функции.
Гистологически
И.С.- практически соответствует лимфоидной ткани.
особенность состоит в том, что она распространена по всему организму, исключая немногие органы или отдельные их участки, называемые иммунологически привилегированными.
Локализация клеток И.С., прежде всего ЛФ не ограничивается лимфоидными органами: их часть рециркулирует (т.е. постоянно поступает в кровоток и возвращается обратно) и при этом может мигрировать не только в лимфоидную ткань
И.С. обладает собственной системой циркуляции — лимфатическими сосудами , которые имеются во всех органах, кроме головного мозга.
По лимфатическим сосудам течет лимфа, содержащая и лейкоциты (лимфоциты). В лимфатических узлах, миндалинах, костном мозге, селезенке, печени, легких и кишечнике — расположены особые зоны, где ЛФ скапливаются, мобилизуются и откуда они отправляются выполнять свои защитные функции.
Сложное строение И.С. гарантирует в случае необходимости быстрое развитие И.О.