Слайд 2
Химические свойства алканов
определяются его строением, т.е. природой
входящих в его состав атомов и характером связей между
ними.
Исходя из справочных данных о связях С–С и С–Н, можно предсказать, какие реакции характерны для алканов
Слайд 3
Химические свойства алканов
1. предельная насыщенность алканов не
допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации
и замещения.
Слайд 4
Химические свойства алканов
2. симметричность неполярных С–С и
слабополярных С–Н ковалентных связей (см. значения дипольных моментов в
табл. 2.5.1) предполагает их гомолитический (симметричный) разрыв на свободные радикалы
Слайд 5
Крекинг алканов
реакции расщепления углеродного скелета крупных молекул при
нагревании и в присутствии катализаторов.
Два вида крекинга:
-
термический (без доступа воздуха)
- каталитический
Слайд 6
Крекинг алканов
Распад связей происходит гомолитически с образованием свободных
радикалов:
Слайд 7
Крекинг алканов
Свободные радикалы очень активны.
Один из них (например,
этил) отщепляет атомарный водород Н· от другого (н-бутила) и
превращается в алкан (этан).
Другой радикал, став двухвалентным, превращается в алкен (бутен-1) за счет образования p–связи при спаривании двух электронов у соседних атомов:
Слайд 8
Крекинг алканов
Разрыв С–С–связи возможен в любом случайном месте
молекулы.
Слайд 9
Крекинг алканов
образуется смесь алканов и алкенов с меньшей,
чем у исходного алкана, молекулярной массой:
Слайд 10
Крекинг алканов
В общем виде этот процесс можно выразить
схемой:
Слайд 11
Крекинг алканов
При более высокой температуре (свыше 1000°С) происходит
разрыв не только связей С–С, но и связей С–Н.
термический крекинг метана используется для получения сажи (чистый углерод) и водорода:
Слайд 12
Галогенопроизводные алканов (галогеналканы)
имеют очень важное значение для синтеза
многих соединений. Замена атомов водорода на галоген делает соединение
химически активным.
Общий вид – СnH2n+2-xHalx.
Слайд 13
Галогенопроизводные алканов (галогеналканы)
Галогенопроизводные алканов широко применяются для синтеза
алканов с заданным строением молекул.
Для этого используется реакция
взаимодействия их с активными металлами (реакция Вюрца-получение чётных алканов):
Слайд 14
Галогенопроизводные алканов (галогеналканы)
Чтобы получить алкан с нечётным количеством
атомов углерода потребуется два различных галогеналкана:
Слайд 15
Нуклеофильное
замещение (SN)
положительно заряженный углеродный атом, связанный с
галогеном, является центром атаки нуклеофильными частицами
(OH-, OR-, CN-,
NH2- и др.) :
Слайд 16
Механизм-1 (SN1) - двухстадийный
Cтадия 1. Алкилгалогенид, отщепляя галоген
(электролитическая диссоциация), превращается в карбокатион:
Стадия 1 является лимитирующей. Поскольку
в ней участвует только одна частица
Слайд 17
Механизм-1 (SN1) - двухстадийный
Cтадия 2. Карбокатион взаимодействует с
нуклеофилом (донором пары электронов) с образованием конечного продукта:
Слайд 18
Механизм-2 (SN2) - одностадийный
заключается в практически одновременном отщеплении
галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона):
Слайд 19
Получение алканов
Алканы выделяют из природных источников:
- природный
и попутный газы,
- нефть,
- каменный уголь.
Используются
также синтетические методы.
Слайд 20
Получение алканов
1. Крекинг нефти (промышленный способ):
При
крекинге алканы получаются вместе с непредельными соединениями (алкенами).
при разрыве
молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан
Слайд 21
Получение алканов
2. Гидpиpование непpедельных углеводоpодов:
Слайд 22
Получение алканов
3. Газификация твердого топлива (при повышенной
температуре и давлении, катализатор Ni):
Слайд 23
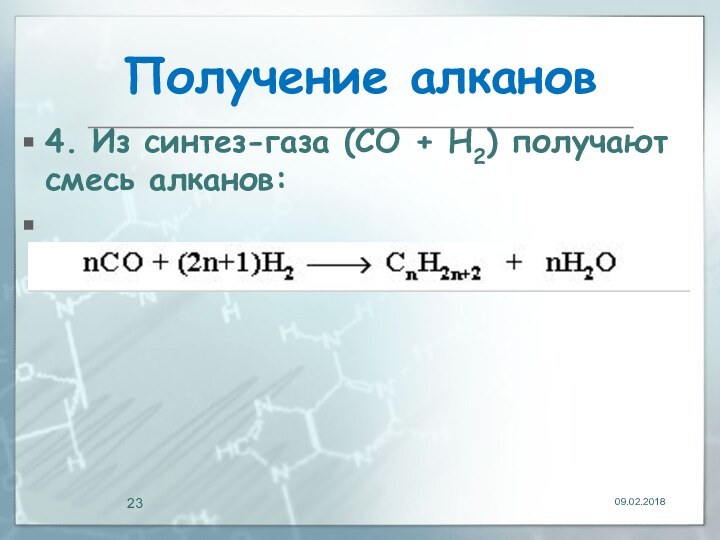
Получение алканов
4. Из синтез-газа (СО + Н2)
получают смесь алканов:
Слайд 24
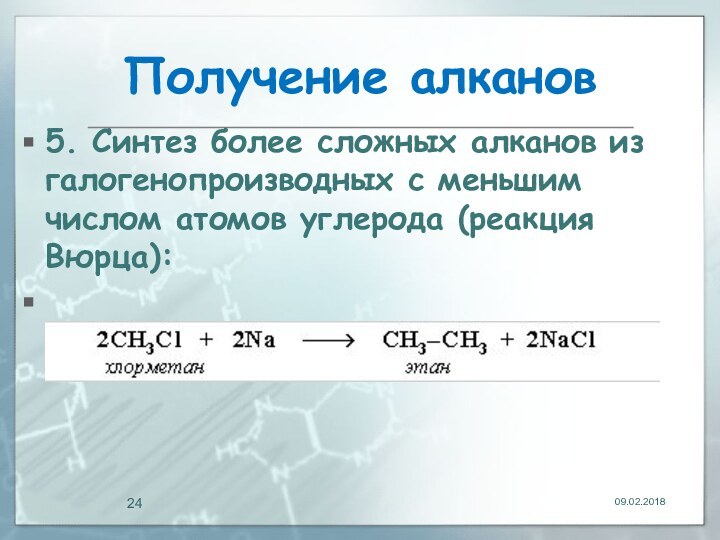
Получение алканов
5. Синтез более сложных алканов из
галогенопpоизводных с меньшим числом атомов углеpода (реакция Вюрца):
Слайд 25
Получение алканов
6. Из солей карбоновых кислот:
а)
сплавление со щелочью (реакция Дюма) :
б) электролиз по
Кольбе:
Слайд 26
Получение алканов
7. Разложение карбидов металлов (метанидов) водой:
Слайд 27
Применение алканов
Алканы – основной источник природного углеводородного
сырья.
Предельные углеводороды находят широкое применение в самых разнообразных сферах
жизни и деятельности человека
Слайд 28
Применение алканов
Газообразные алканы (метан и пpопан-бутановая смесь)
используются в качестве ценного топлива.
Жидкие углеводоpоды составляют значительную
долю в моторных и ракетных топливах и используются в качестве растворителей.
Слайд 29
Применение алканов
Вазелиновое масло (смесь жидких углеводоpодов с
числом атомов углерода до 15) - пpозpачная жидкость без
запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине
Слайд 30
Применение алканов
Паpафин (смесь твеpдых углеводоpодов С19-С35) -
белая твеpдая масса без запаха и вкуса (tпл= 50-70°C)
пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и салонах красоты
Слайд 31
Применение алканов
В современной нефтехимической промышленности предельные улеводороды
являются базой для получения разнообразных органических соединений, важным сырьем
в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ
Слайд 32
Применение алканов
Алканы – основной источник природного углеводородного
сырья.
Предельные углеводороды находят широкое применение в самых разнообразных сферах
жизни и деятельности человека
Слайд 33
1.Контрольная работа
Напишите полные структурные и электронные формулы;
- пропана
- пентана
- октана
Слайд 34
2. Контрольная работа
Дайте названия радикалам следующих алканов:
-
пропан
- декан
- октан
- этан
- пентан
- гексан
Слайд 35
3.Контрольная работа
Напишите процесс расщепления для следующих алканов, используя
общую формулу крекинга
- октан
- декан
- гептан