Слайд 2
План лекции
Общая характеристика лекарственных веществ, производных пиразола.
Химические
свойства и методы анализа.
Частные реакции: антипирина, анальгина, методы количественного
определения.
Фенилбутазон.
Определение подлинности и испытания на чистоту препаратов, производных пиразола.
Слайд 3
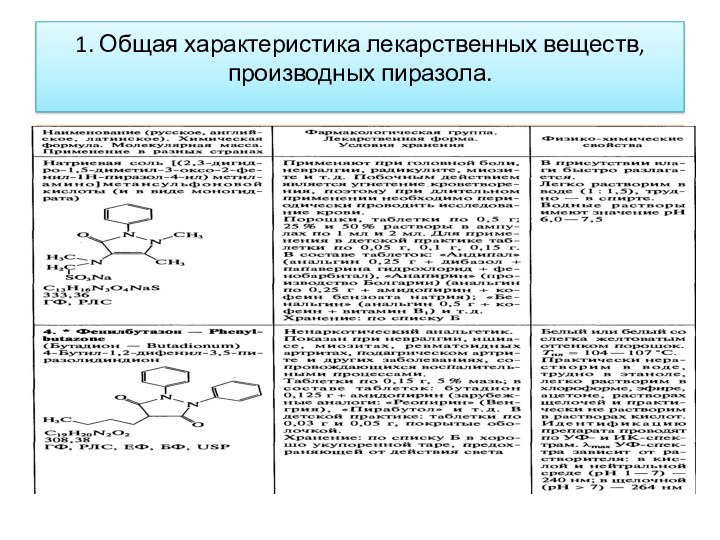
1. Общая характеристика лекарственных веществ, производных пиразола.
Слайд 4
Производные пиразола
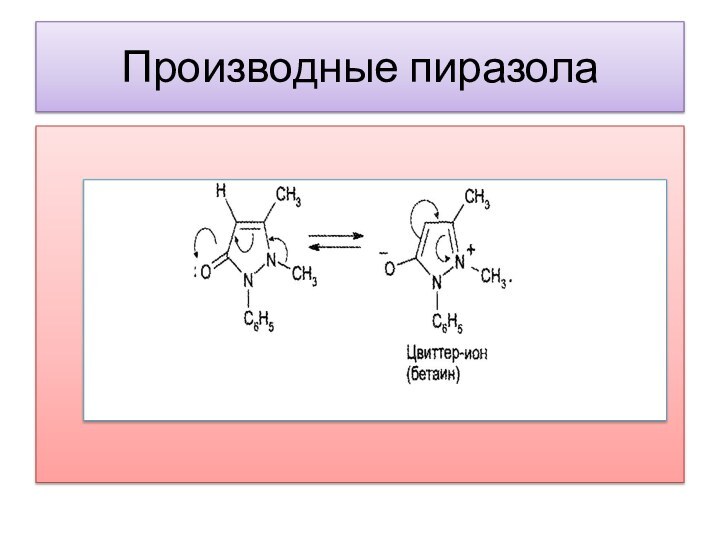
Антипирин и анальгин растворимы в воде, что
связано с особенностями их химического строения. Анальгин является натриевой
солью замещенной серной кислоты. Растворимость антипирина в воде обусловлена его способностью образовывать при растворении в воде внутреннюю соль
(цвиттер-ион) или бетаиновую структуру, которая хорошо сольватируется водой:
Слайд 6
Производные пиразола
Для производных пиразолона* характерно поглощение в ИК-
и УФ-областях спектра. УФ-спектры имеют 2 максимума: в интервалах
243-245 нм и 265-275 нм. Данное свойство используется как для идентификации, так и для количественной оценки препаратов в лекарственных формах.
Слайд 7
Химические свойства и методы анализа
Кислотно-основные свойства
Производные пиразолона
имеют слабо выраженный основный центр — гетероатом азота во
2-м положении. Атом азота в 1-м положении практически не проявляет основных свойств из-за влияния атома кислорода карбонильной группы и фенильного радикала.
Таким образом, антипирин является слабым однокислотным основанием. Водный раствор его нейтрален (рН 6,0—7,5).
Слайд 8
Производные пиразола
Анальгин — натриевая соль довольно сильной замещенной
суль-фокислоты, поэтому его водные растворы имеют нейтральную реакцию среды
(рН 6,0-7,5).
Как азотсодержащие органические основания лекарственные вещества группы пиразодона образуют с обшеалкалоидными реактивами осадки комплексных солей. Следует отметить особенность проведения реакции с реактивом Люголя (раствор йода в калия йодиде). Антипирин с раствором йода сначала образует бесцветный йодопирин, поэтому при добавлении первых капель реактива наблюдается обесцвечивание йода, а затем (при
Слайд 9
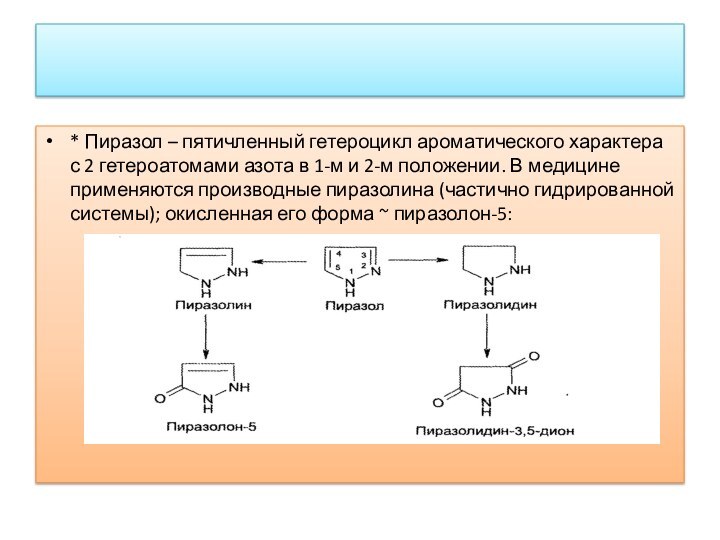
* Пиразол – пятичленный гетероцикл ароматического характера с
2 гетероатомами азота в 1-м и 2-м положении. В
медицине применяются производные пиразолина (частично гидрированной системы); окисленная его форма ~ пиразолон-5:
Слайд 10
избытке реактива) выпадает бурый осадок комплексной соли –
перйодида.
При действии на анальгин первых капель реактива идет окисление
лекарственного вещества с образованием окрашенных продуктов, а при добавлении избытка реактива образуется осадок перйодида (или полийодида) анальгина.
Слайд 11
Частные реакции
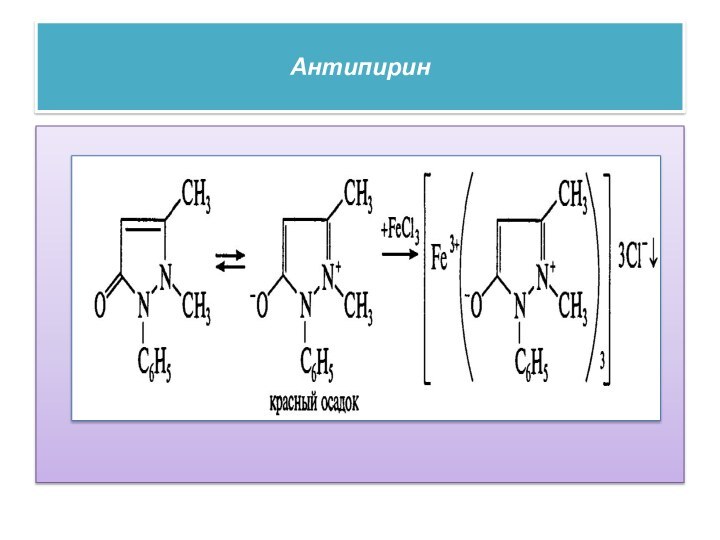
Антипирин
Реакция комплексообразования. За счет способности давать в
водном растворе цвиттер-ион антипирин образует с железа (III) хлоридом
комплексную соль красного цвета, обесцвечивающуюся при добавлении минеральных кислот
Слайд 13
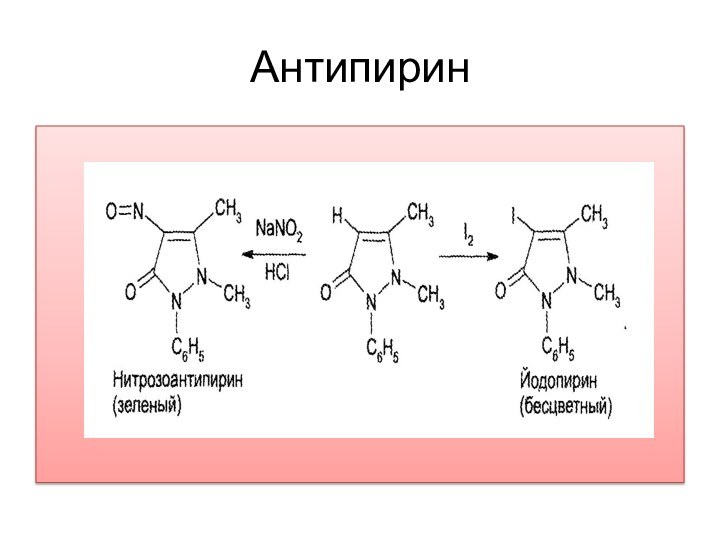
2. Реакции электрофильного замещения.
Вследствие образования бетаиновой структуры и
ее ароматического характера антипирин вступает в Sf-реакции fro 4-му
положению. Электрофилами являются нитрозо- и н игр о про и з вод и ы е, а также галогены. Поэтому в отличие от анальгина антипирин не окисляется растворами йода и натрия нитрита в кислой среде, а образует продукты замещения:
Слайд 15
Антипирин
Реакция образования нитрозоантипирина применяется для идентификации антипирина
и для его количественного определения методом ФЭК. Эта реакция
может быть использована также для открытия нитрит-иона.
Слайд 16
Анальгин
1) Реакции окисления. Анальгин проявляет выраженные восстановительные свойства, которые
обусловлены наличием неустойчивой, частично гидрированной системы ииразолина и гидразин
обой группировки. Кроме того, его реакционная способность усилена радикалом при С4. Способность к окислению определяет реакции идентификации, метод количественного анализа и особенности хранения.
В качестве окислителей для идентификации анальгина используют: железа (III) хлорид, серебра нитрат, натрия нитрит, калия йодат и др.
Анальгин с раствором серебра нитрата сначала дает белый осадок соли серебра, затем окрашенный продукт окисления с выделением осадка металлического серебра.
При взаимодействии анальгина с калия йодатом в кислой среде сначала наблюдается малиновое окрашивание (продукты окисления анальгина), затем, вследствие восстановления йодата калия до йода — образование бурого осадка перйодида.
Слайд 17
Антипирин
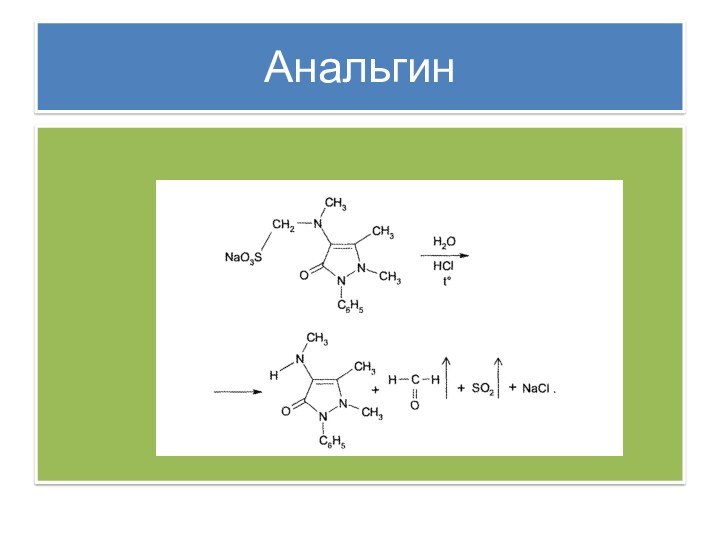
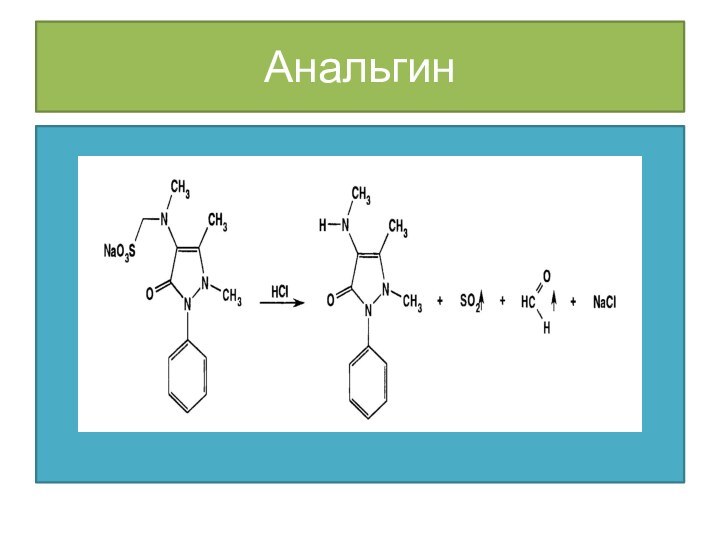
2) Реакции гидролитичекого расщепления. Анальгин подвергается гидролитическому расщеплению
в кислой, нейтральной и щелочной среде, особенно при нагревании.
Реакция кислотного гидролиза используется для идентификации анальгина: серы (IV) оксид и формальдегид обнаруживают по запаху. Кроме того, наличие формальдегида можно подтвердить реакцией образования ауриновою краен-теля с кислотой хромотроповой или кислотой салициловой:
Слайд 19
Анальгин
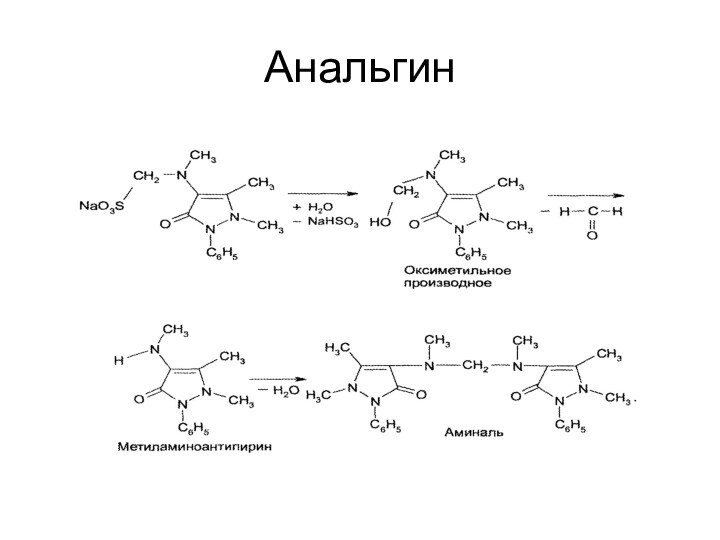
3) Стабильность анальгина связана с его способностью
к гидролитическому разложению и окислению. В водном растворе анальгин
образует равновесную систему, включающую непосредственно лекарственное вещество и продукты его разложения — оксиметильное производное, натрия гидросульфит, формальдегид, метиламиноантипирин и образующийся при взаимодействии 2 последних веществ аминаль:
Слайд 21
Анальгин
Под действием света и кислорода воздуха может
происходить окисление анальгина. Поэтому ГФ нормирует прозрачность, а вследствие
возможного гидролиза - кислотность и щелочность.
При испытании на чистоту определяется также потеря массы при высушивании, так
как анальгин является кристаллогидратом.
Слайд 22
Анальгин
4) Метамизол-натрий, в отличие от других производных
пиразолона-5, дает положительную реакцию на ион натрия, а при
нагревании на водяной бане с минеральными кислотами выделяет диоксид серы и формальдегид, которые обнаруживают по запаху:
Слайд 24
Анальгин
Количественное определение. На способности анальгина к окислению
основало его количественное определение йодометрическим методом. При этом идет
окисление сульфитной серы до сульфатной. Во избежание преждевременного гидролиза лекарственного вещества навеску растворяют в спирте (колба сухая!), прибавляют 0,01 н. раствор кислоты хлороводородной для разложения анальгина и титруют 0,1 н. раствором йода до желтого окрашивания. Кислота необходима для гидролиза остатка натрия метиленсульфоиата и предотвращения окисления выделяющегося формальдегида (альдегиды окисляются в щелочной среде),
Слайд 25
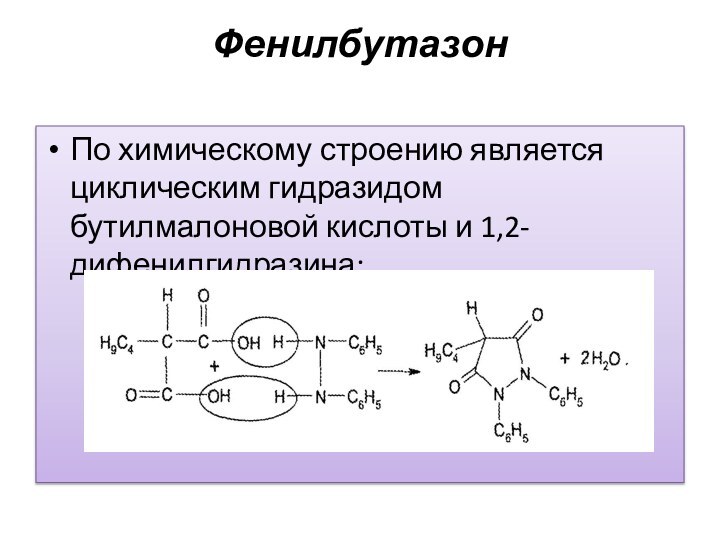
Фенилбутазон
По химическому строению является циклическим гидразидом бутилмалоновой кислоты
и 1,2-дифенилгидразина:
Слайд 26
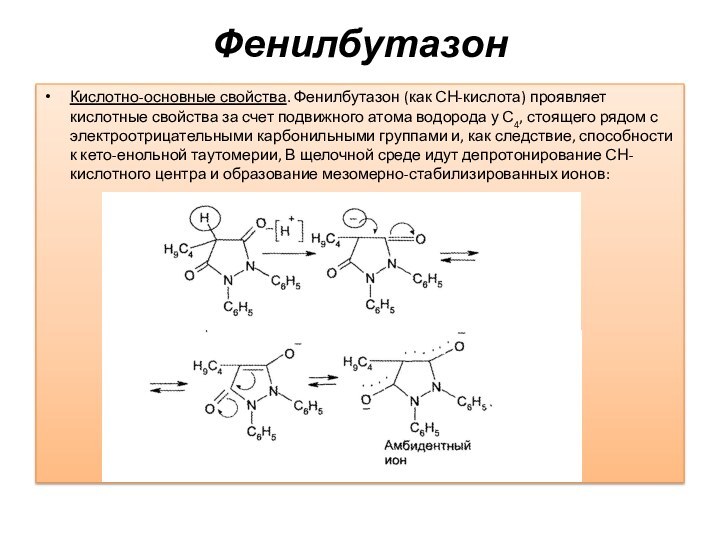
Фенилбутазон
Кислотно-основные свойства. Фенилбутазон (как СН-кислота) проявляет кислотные свойства
за счет подвижного атома водорода у С4, стоящего рядом
с электроотрицательными карбонильными группами и, как следствие, способности к кето-енольной таутомерии, В щелочной среде идут депротонирование СН-кислотного центра и образование мезомерно-стабилизированных ионов:
Слайд 27
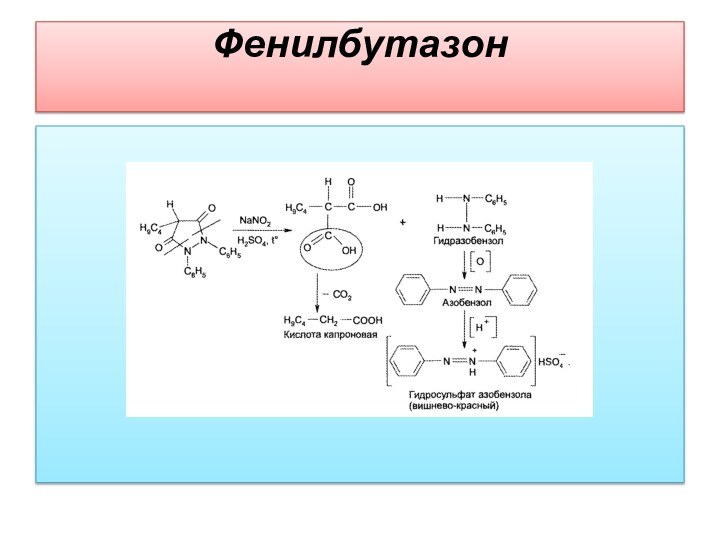
Фенилбутазон
Реакции окисления. Фенилбутазон как производное полностью гидрированной системы
довольно устойчив к окислению. Поэтому он окисляется только в
жестких условиях, например при действии кристаллического натрия нитрита в присутствии концентрированной H2S04 при нагревании. В данной реакции фенилбутазон как циклический гидразид подвергается гидролитическому расщеплению с образованием кислоты бутилмалоновой и гидразобензола. Кислота бутилмалоновая декарбоксилируется (наблюдается выделение пузырьков С02), а гидразобензол окисляется до азобензола с вишнево-красным окрашиванием:
Слайд 29
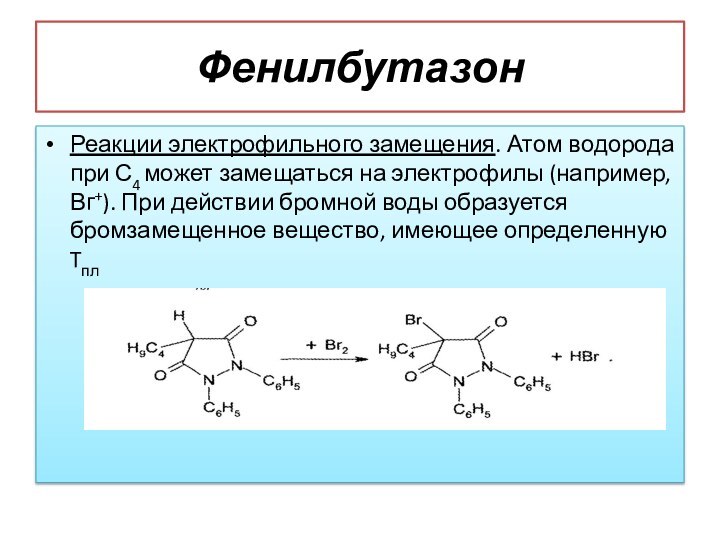
Фенилбутазон
Реакции электрофильного замещения. Атом водорода при С4 может
замещаться на электрофилы (например, Вг+). При действии бромной воды
образуется бромзамещенное вещество, имеющее определенную Tпл
Слайд 30
Фенилбутазон
Количественное определение
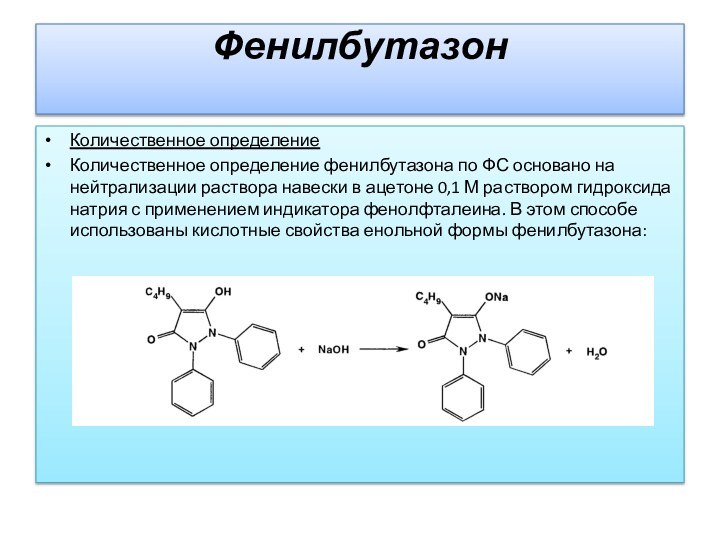
Количественное определение фенилбутазона по ФС основано на
нейтрализации раствора навески в ацетоне 0,1 М раствором гидроксида
натрия с применением индикатора фенолфталеина. В этом способе использованы кислотные свойства енольной формы фенилбутазона:
Слайд 31
Фенилбутазон
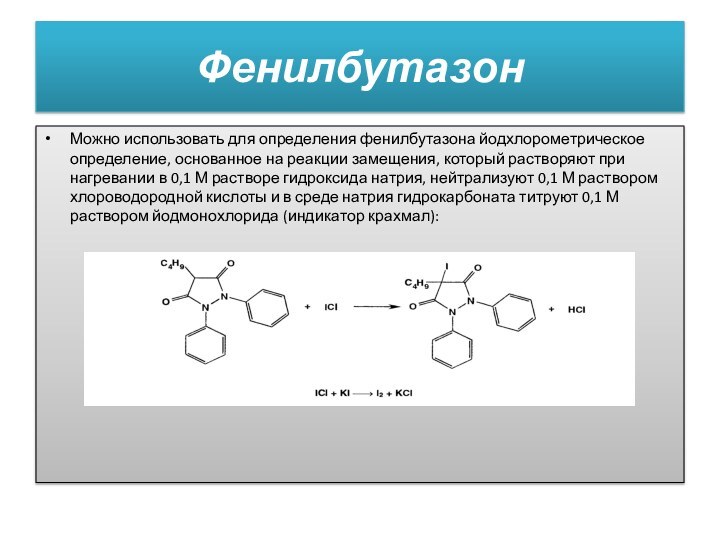
Можно использовать для определения фенилбутазона йодхлорометрическое определение, основанное
на реакции замещения, который растворяют при нагревании в 0,1
М растворе гидроксида натрия, нейтрализуют 0,1 М раствором хлороводородной кислоты и в среде натрия гидрокарбоната титруют 0,1 М раствором йодмонохлорида (индикатор крахмал):
Слайд 32
Определение подлинности и испытание на чистоту препаратов производных
пиразола
Определение подлинности. Сравнивают ИК-спектр со спектром стандартного образца. Растворяют
50 г ЛВ в 1 мл концентрированного раствора Н202; появляется голубое окрашивание, постепенно исчезающее и переходящее в интенсивно красное в течение нескольких минут. Поместить 0,1 г ЛВ в пробирку и добавить 1,5 мл воды, 1,5 мл разбавленной НС1. Над горлышком пробирки расположить фильтровальную бумагу пропитанную раствором КI03 (20 мг в 2 мл раствора крахмала), осторожно нагреть пробирку и наблюдать посинение индикаторной бумаги вследствие выделяющегося 12 при взаимодействии паров S02 (см. реакцию выше) с КIO3. После нагревания раствора в течение 1 мин 1 каплю раствора хромотроновой кислоты H2S04 внести в пробирку. В течение 10 мин появится сине-фиолетовое окрашивание.
Раствор дает реакции на натрий.
Слайд 33
Испытание на чистоту
Определение рН раствора (2,0 г ЛВ
в 40 мл Н20) по фенолталеину: 0,1 мл индикатора
не изменяют окраску раствора. Розовый цвет должен появиться при добавлении не более 0,1 мл 0,02М раствора NaOH.
Родственные примеси определяют ЖХ.
Содержание сульфатов не более 0,1 %, тяжелых металлов (< 20 мкг/г); потеря массы при высушивании 4,9 — 5,3 %.