Слайд 2
План
3-Материалы
4 – Использование серной кислоты
5 – 8 –получение
серной кислоты из пирита
9 – иллюстрация оборудования
10 – расположение
завода
11 – добыча материалов
12 – Сотрудничество
13 – Транспортировка
14 – Проблемы производства
15 – Решение проблем
16 – смета
17 – использованная литература
Слайд 3
Материалы(из чего производится)
Пирит
Сульфиды металлов
Сера
Слайд 4
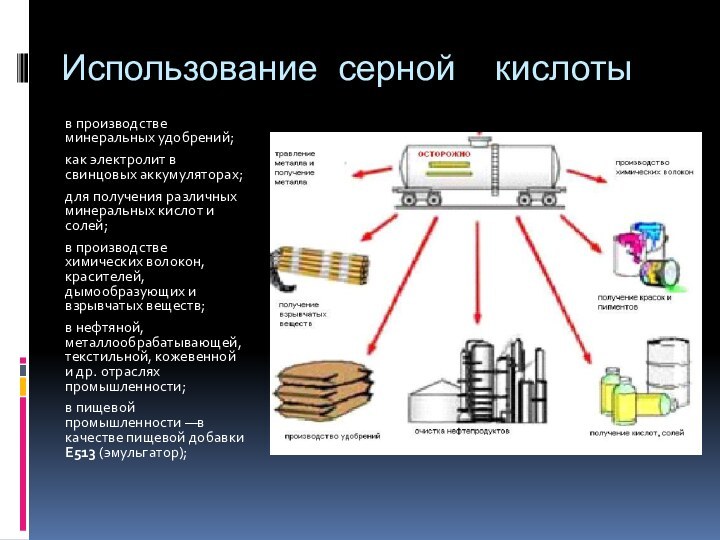
Использование серной кислоты
в производстве минеральных удобрений;
как электролит в
свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве
химических волокон, красителей, дымообразующих и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности —в качестве пищевой добавки E513 (эмульгатор);
Слайд 5
Хим. Реакции(Используется Пирит)
1.Обжиг пирита, Получение оксида серы (II).
(4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q)
2.
Окисление SO2 в SO3 кислородом(2SO2 + O2 = 2SO3 + Q)
3. Получение H2SO4 (SO3 + H2O H2SO4 )
Слайд 6
1.Обжиг пирита, Получение оксида серы (II).
Измельчённый очищенный
влажный (после флотации) пирит сверху засыпают в печь для
обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 8000С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
Слайд 7
2. Окисление SO2 в SO3 кислородом
Сложность второй стадии
заключается в том, что процесс окисления одного оксида в
другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
а) температура:
(400-5000С)
б) давление:
Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.)
Слайд 8
3. Получение H2SO4
если для поглощения оксида серы использовать
воду, образуется серная кислота в виде тумана, состоящего из
мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным.
Слайд 9
Полная иллюстрация получения серной кислоты
Слайд 10
Расположение и причины расположения завода
Завод находится в районе
Екатеринбурга что помогает уменьшить затраты на транспортировку материала
Слайд 11
Добыча материала
Пирит добывается в
Берёзовском
руднике в виде
руды и каменных вкраплений
(Которые в будущем будут очищены и
раздроблены на мелкие куски для лучшей плавкости)
Слайд 13
Транспортировка
Руда транспортируется с помощью до Челябинска в Грузовиках
с кислостойкими цистернами а потом направляется по Среднесибирской магистрали
в Москву на склад где будет ожидать дальнейшей транспортировки
Слайд 14
Проблемы производства
При производстве серной кислоты в атмосферу выбрасывается
много оксида серы(IV),оксида серы(VI) серной кислоты что отражается на
здоровье людей, губительно действует на растения и разрушает постройки
Слайд 15
Решение проблем
1)Непрерывность процесса
2)Циркуляционные процессы(Непрореагировавшие вещества возвращаются в сферу
реакций)
3)Комплексное использование сырья,
Безотходная технология
4)Выбор оптимального сырья и режима его
переработки
Слайд 16
Общая смета
Доходы:
1)Продажа серной кислоты - 2500р./Т
2)Объём продаж -
Слайд 17
Использованная литература
http://www.alhimikov.net/elektronbuch/kislota.html