- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Система мембран растительной клетки
Содержание
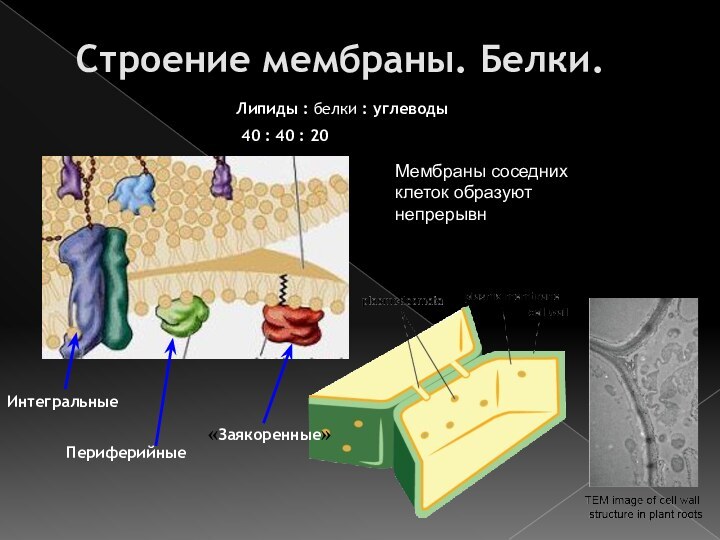
- 2. Строение мембраны. Белки.ИнтегральныеПериферийные«Заякоренные»Липиды : белки : углеводы 40 : 40 : 20Мембраны соседних клеток образуют непрерывн
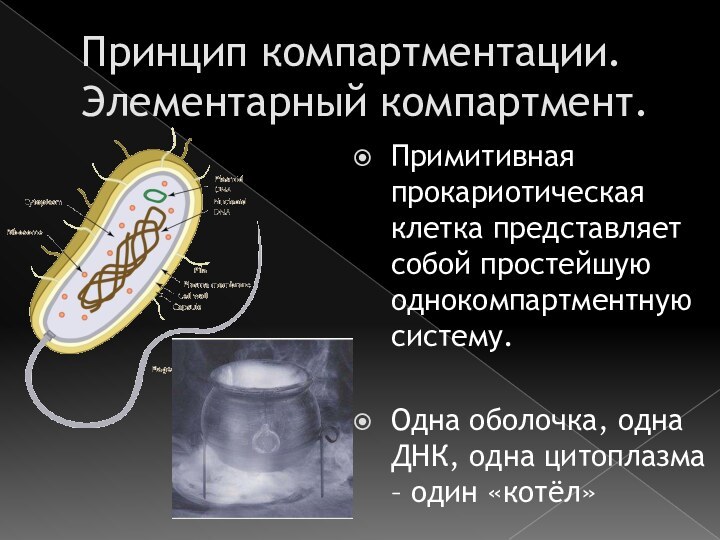
- 3. Принцип компартментации. Элементарный компартмент.Примитивная прокариотическая клетка представляет
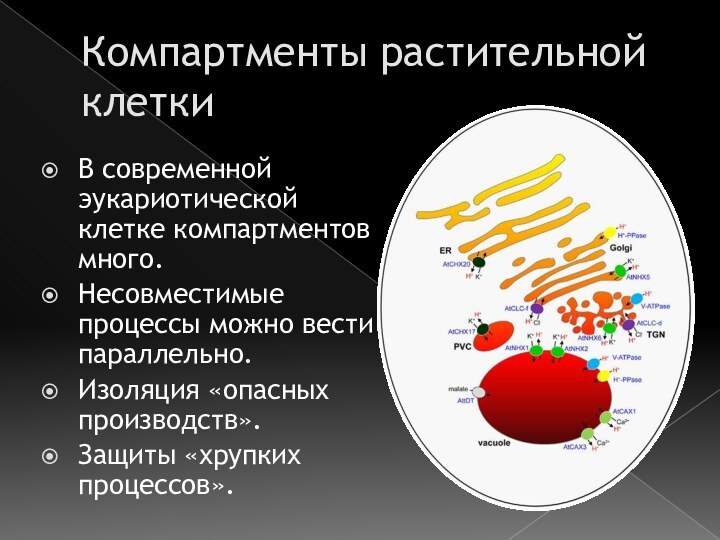
- 4. Компартменты растительной клеткиВ современной эукариотической клетке компартментов
- 5. Как сейчас представляют ЭМСThe Endoplasmic Reticulum in Plants Dr. Jurgen Denecke, University of Leeds, UK
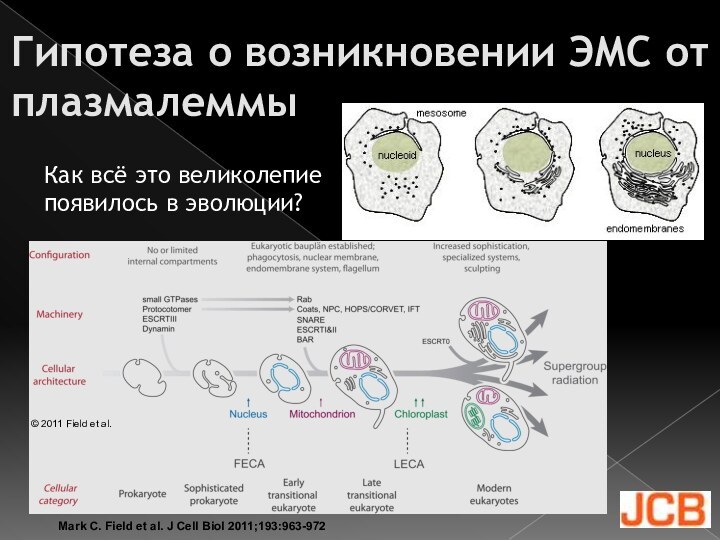
- 6. Гипотеза о возникновении ЭМС от плазмалеммыMark C.
- 7. Radhey S. Gupta Microbiol. Mol. Biol. Rev.
- 8. Онтогенетическая непрерывность ЭМСПлазмалемма Вакуоль (тонопласт)Эндоплазматический ретикулумАппарат ГольджиГлиоксисомыЯдерная мембранаПлазмодесмы
- 9. Эндоплазматическая сеть
- 10. КонтактыЭПР наиболее тесно взаимосвязан с двумя структурами:
- 11. Два пути для белка: цитоплазматический и секреторныйУ
- 12. Шероховатый ЭПР – добро пожаловать на секреторный
- 13. Alessandro Vitale, and Jürgen Denecke Plant Cell
- 14. Откуда рибосома узнает?SRP связывается с сигнальным пептидом
- 15. А если белок мембранный?Для мембранных белков схема
- 16. Сворачивание белковФолдинг белков происходит не самопроизвольно, а
- 17. Шапероны и фолдиныBiP (binding protein), GRP94 (эндоплазмин),
- 18. Как Вы себя чувствуете в ЭПР?В люмене
- 19. Гликозилирование белков в ЭПРМногие секреторные белки N-гликозилированы
- 20. Jian-Xiang Liu, and Stephen H. Howell Plant
- 21. Функции ЭПР в процессинге белков Модификация определенных
- 22. Alessandro Vitale, and Jürgen Denecke Plant Cell
- 23. Alessandro Vitale, and Jürgen Denecke Plant Cell
- 24. Куда могут идти везикулы?The Endoplasmic Reticulum in
- 25. Возврат ЭПР-резидентовБыл обнаружен рецептор, который опознает ЭПР-резидентные
- 26. Запасные белки: где их хранят?Запасные белки могут
- 27. Eliot M. Herman, and Brian A. Larkins
- 28. ПроламиныПроламины – запасные белки у злаков.Они гидрофобны.Богаты
- 29. Пример: эндосперм кукурузыPBs формируются в люмене ЭПР
- 30. Eliot M. Herman, and Brian A. Larkins
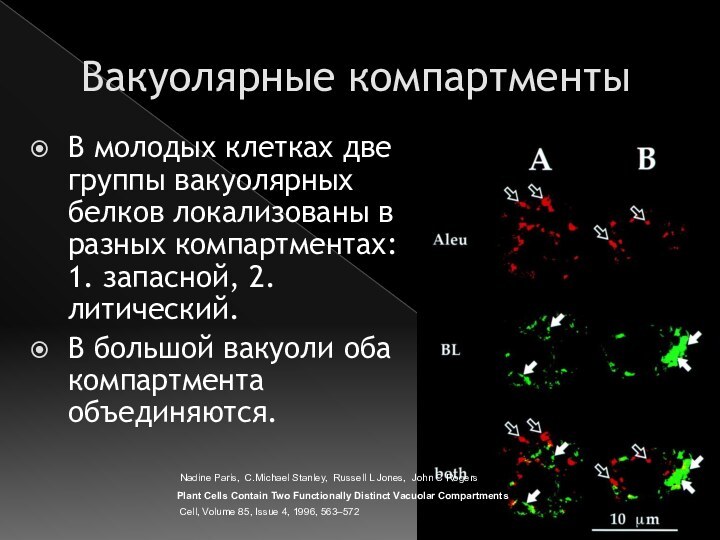
- 31. Вакуолярные компартментыВ молодых клетках две группы вакуолярных
- 33. Биохимическая модификация белка. «Дозревание» белков, предназначенных для
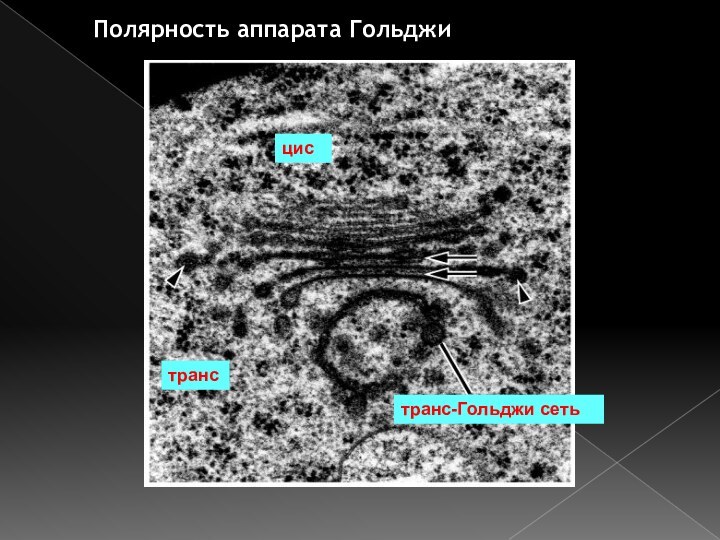
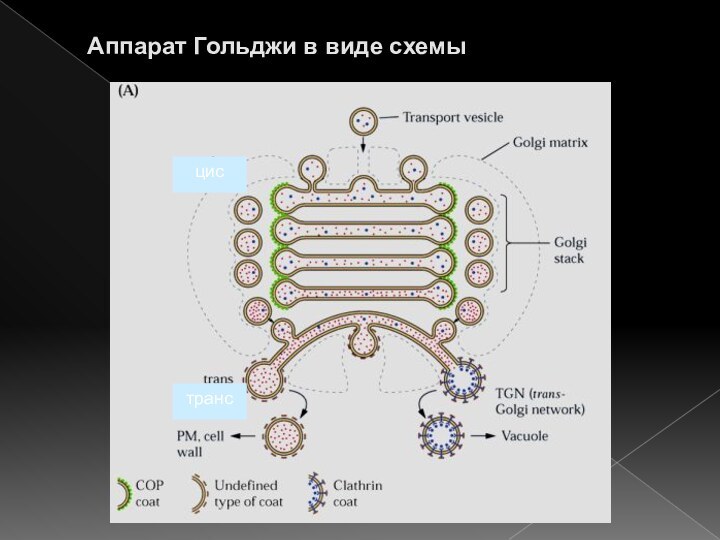
- 34. транс-Гольджи сетьтрансцисПолярность аппарата Гольджи
- 36. Аппарат Гольджи в виде схемыцистранс
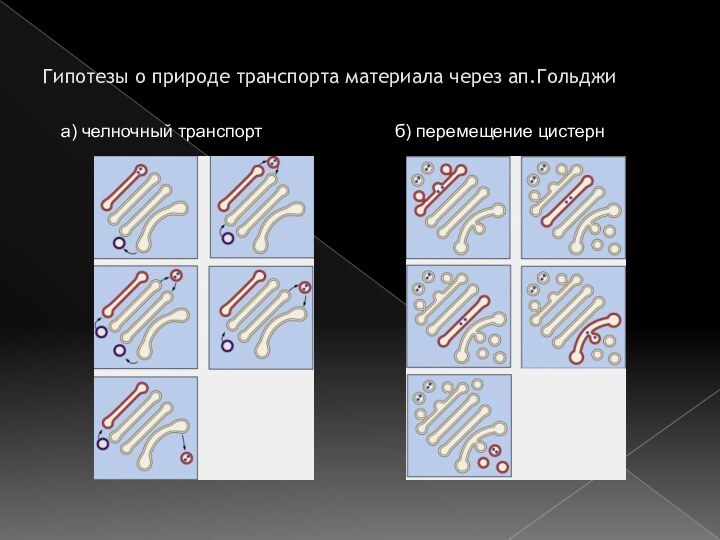
- 37. Гипотезы о природе транспорта материала через ап.Гольджиа) челночный транспортб) перемещение цистерн
- 38. Функции аппарата Гольджи в процессинге белковСложные модификации
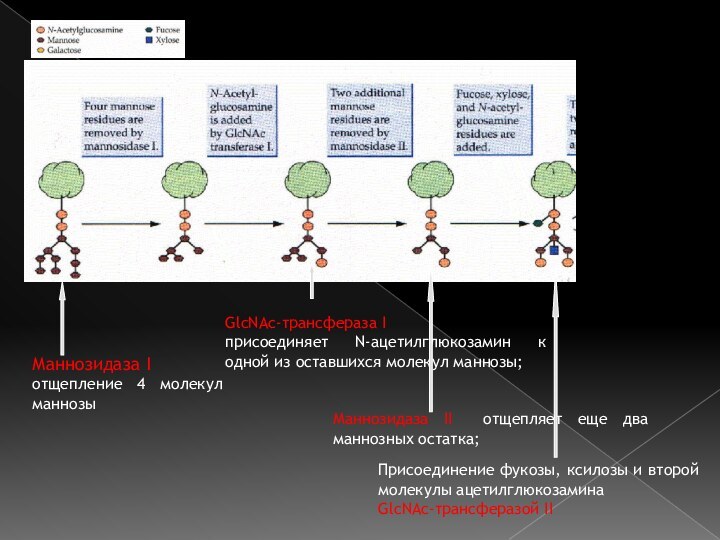
- 39. Маннозидаза I отщепление 4 молекул маннозыGlcNAc-трансфераза I
- 40. Фракция 3 (наименее плотная): содержит ферменты присоединения двух молекул фукозы и двух молекул галактозы;два N-ацетилгюкозамина удаляются
- 41. Сравнение биохимической модификация углеводной части белков у растений и животных
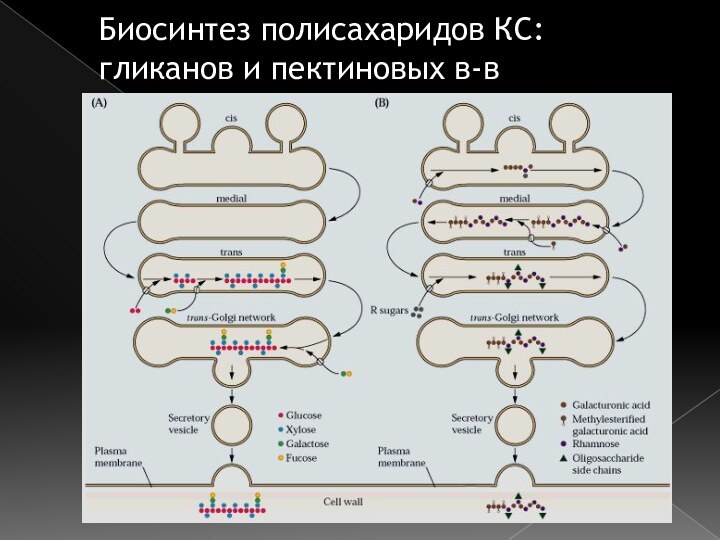
- 42. Биосинтез полисахаридов КС: гликанов и пектиновых в-в
- 43. Актиномиозиновая система клетки обеспечивает движение стопок Гольджи
- 44. Семь основных путей используются при формировании вакуолей.1:
- 45. Вакуоль – конечный пункт секреторного путиТранспорт оптически
- 46. Функции вакуолиподдержание тургорагомеостатирование цитоплазмызапасание продуктов метаболизмаизолирование ксенобиотиковразложение компонентов цитоплазмызащита от патогенов и травоядных пигментация
- 47. Функции вакуоли во многом определяются транспортными свойствами тонопластаПирофосфатазаАквапориныН-АТФ-аза V-типаАВС-транспортерыКаналыТранспортерыТранспортеры
- 48. Скачать презентацию
- 49. Похожие презентации






















Слайд 2
Строение мембраны. Белки.
Интегральные
Периферийные
«Заякоренные»
Липиды : белки : углеводы
40 : 40 : 20
Слайд 3
Принцип компартментации. Элементарный компартмент.
Примитивная прокариотическая клетка представляет собой
простейшую однокомпартментную систему.
Одна оболочка, одна ДНК, одна цитоплазма –
один «котёл»
Слайд 4
Компартменты растительной клетки
В современной эукариотической клетке компартментов много.
Несовместимые процессы можно вести параллельно.
Изоляция «опасных производств».
Защиты «хрупких
процессов».
Слайд 5
Как сейчас представляют ЭМС
The Endoplasmic Reticulum in Plants
Dr. Jurgen Denecke, University of Leeds, UK
Слайд 6
Гипотеза о возникновении ЭМС от плазмалеммы
Mark C. Field
et al. J Cell Biol 2011;193:963-972
© 2011 Field et
al.Как всё это великолепие появилось в эволюции?
Слайд 7
Radhey S. Gupta Microbiol. Mol. Biol. Rev. 1998;62:1435-1491
Есть
и другие версии…
Based on phylogenetic information from indels in
different protein sequences, it is hypothesized that all eukaryotes received major gene contributions from both an archaebacterium and a gram-negative eubacterium. In this model, the ancestral eukaryotic cell is a chimera that resulted from a unique fusion event between the two separate groups of prokaryotes followed by integration of their genomes.
Слайд 8
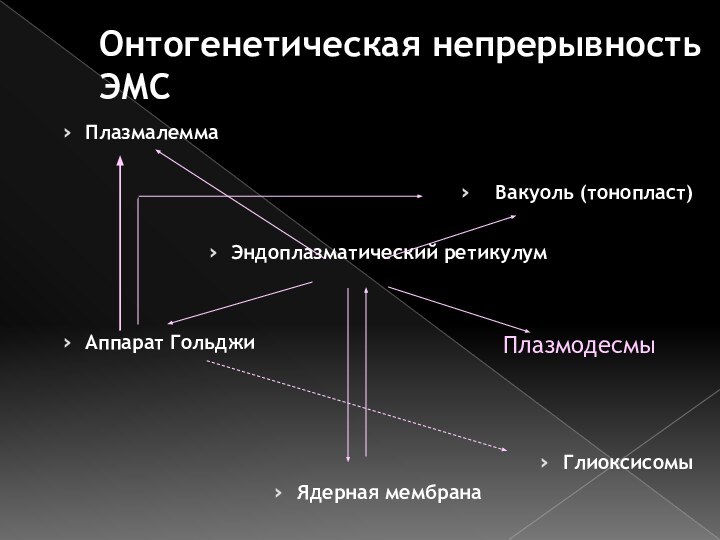
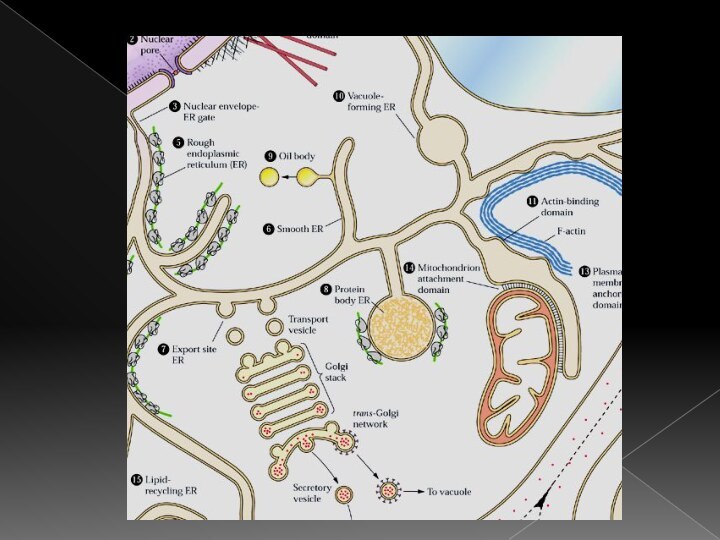
Онтогенетическая непрерывность ЭМС
Плазмалемма
Вакуоль (тонопласт)
Эндоплазматический ретикулум
Аппарат Гольджи
Глиоксисомы
Ядерная мембрана
Плазмодесмы
Слайд 10
Контакты
ЭПР наиболее тесно взаимосвязан с двумя структурами: ядерной
оболочкой и аппаратом Гольджи.
Между ЯО и ЭПР замечены
многочисленные зоны контакта. Однако недавно такие же зоны контакта были замечены между ЭПР и Гольджи (ранее считалось, что транспорт веществ между ними возможен только путём упаковки в везикулы).
Слайд 11
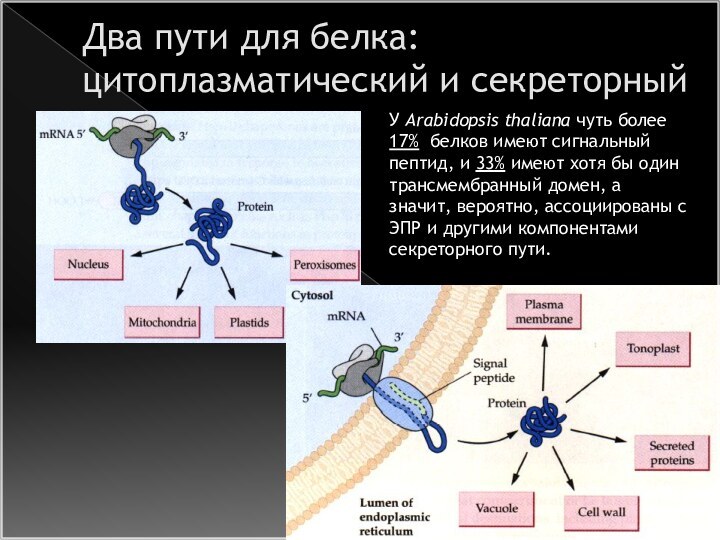
Два пути для белка: цитоплазматический и секреторный
У Arabidopsis
thaliana чуть более 17% белков имеют сигнальный пептид, и
33% имеют хотя бы один трансмембранный домен, а значит, вероятно, ассоциированы с ЭПР и другими компонентами секреторного пути.
Слайд 12
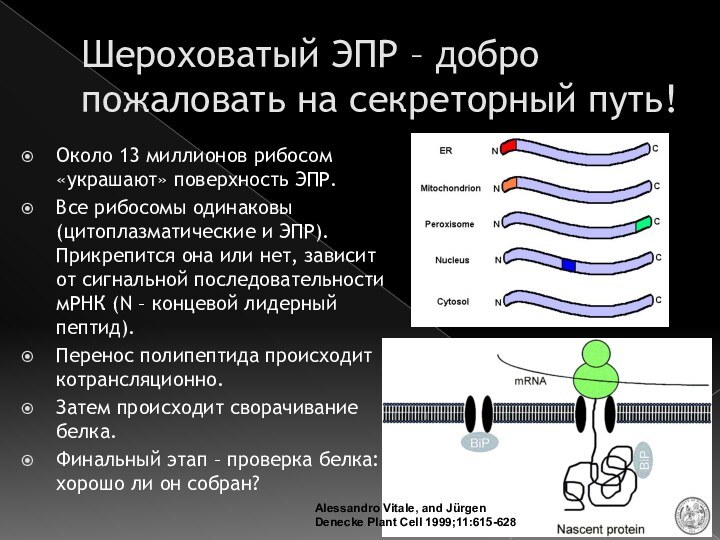
Шероховатый ЭПР – добро пожаловать на секреторный путь!
Около
13 миллионов рибосом «украшают» поверхность ЭПР.
Все рибосомы одинаковы (цитоплазматические
и ЭПР). Прикрепится она или нет, зависит от сигнальной последовательности мРНК (N – концевой лидерный пептид).Перенос полипептида происходит котрансляционно.
Затем происходит сворачивание белка.
Финальный этап – проверка белка: хорошо ли он собран?
Alessandro Vitale, and Jürgen Denecke Plant Cell 1999;11:615-628
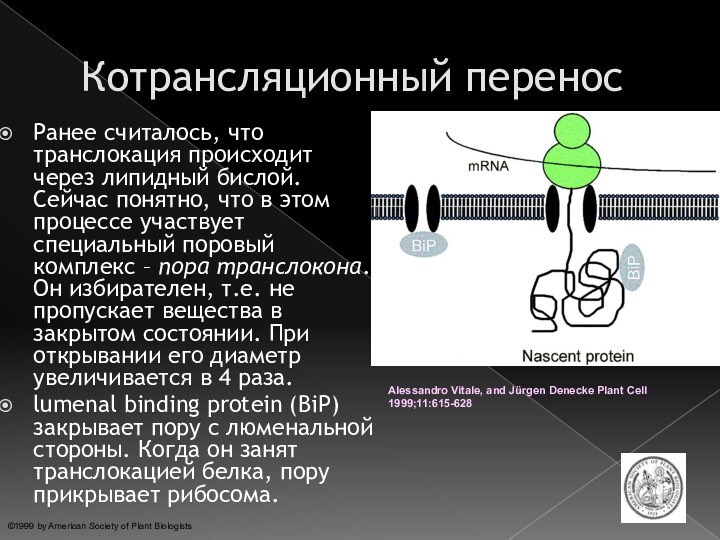
Слайд 13
Alessandro Vitale, and Jürgen Denecke Plant Cell 1999;11:615-628
©1999
by American Society of Plant Biologists
Котрансляционный перенос
Ранее считалось, что
транслокация происходит через липидный бислой. Сейчас понятно, что в этом процессе участвует специальный поровый комплекс – пора транслокона. Он избирателен, т.е. не пропускает вещества в закрытом состоянии. При открывании его диаметр увеличивается в 4 раза. lumenal binding protein (BiP) закрывает пору с люменальной стороны. Когда он занят транслокацией белка, пору прикрывает рибосома.
Слайд 14
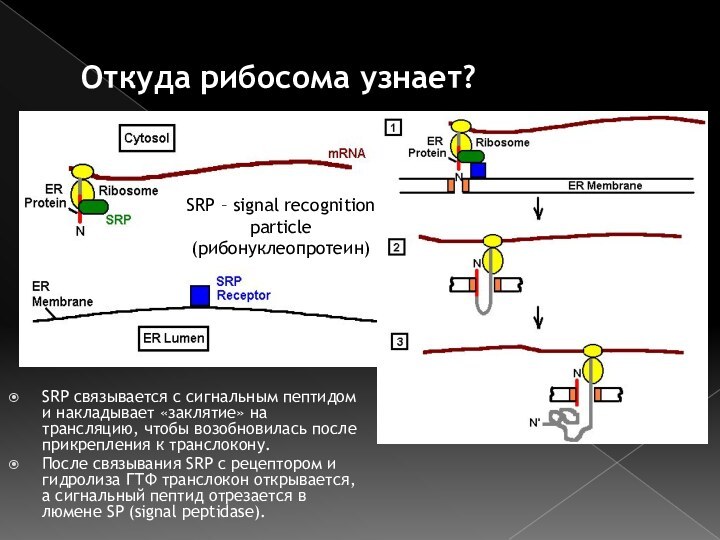
Откуда рибосома узнает?
SRP связывается с сигнальным пептидом и
накладывает «заклятие» на трансляцию, чтобы возобновилась после прикрепления к
транслокону.После связывания SRP с рецептором и гидролиза ГТФ транслокон открывается, а сигнальный пептид отрезается в люмене SP (signal peptidase).
SRP – signal recognition particle (рибонуклеопротеин)
Слайд 15
А если белок мембранный?
Для мембранных белков схема чуть
сложнее. Они также встраиваются в мембрану котрансляционно благодаря специальным
последовательностям.
Слайд 16
Сворачивание белков
Фолдинг белков происходит не самопроизвольно, а с
участием шаперонов. Шапероны ЭПР – ретикулоплазмины.
Правильный фолдинг имеет большое
значение, потому что неправильно свернутые белки формируют агрегаты, слипаясь гидрофобными частями, и могут повредить компартмент.Шапероны не ускоряют фолдинг, а лишь стабилизируют правильную конформацию. Возможна корректировка неправильной конформации.
Слайд 17
Шапероны и фолдины
BiP (binding protein), GRP94 (эндоплазмин), GRP78
(glucose-regulated protein 78), калнексин, калретикулин и PDI (protein disulfide
isomerase).Первые два имеют гомологи в цитозоле, остальные уникальны для ЭПР.
Некоторые шапероны работают в ЭПР конститутивно, а другие индуцируются тепловым шоком. При этом все семейства называются очень похоже: Нeat shock protein (HSP)70,90, и т.п.
Plant Signal Behav. 2011 Feb; 6(2): 232–236
Слайд 18
Как Вы себя чувствуете в ЭПР?
В люмене ЭПР
рН близок к нейтральному, в этом смысле он похож
на цитозоль.Однако, в люмене царит окисление: отношение окисленного глутатиона к восстановленному там высоко, что способствует формированию дисульфидных связей.
Правильно их выстраивать помогает PDI (protein disulfide isomerase).
Также в люмене много АТФ: сворачивание требует энергии. BiP является АТФазой.
Слайд 19
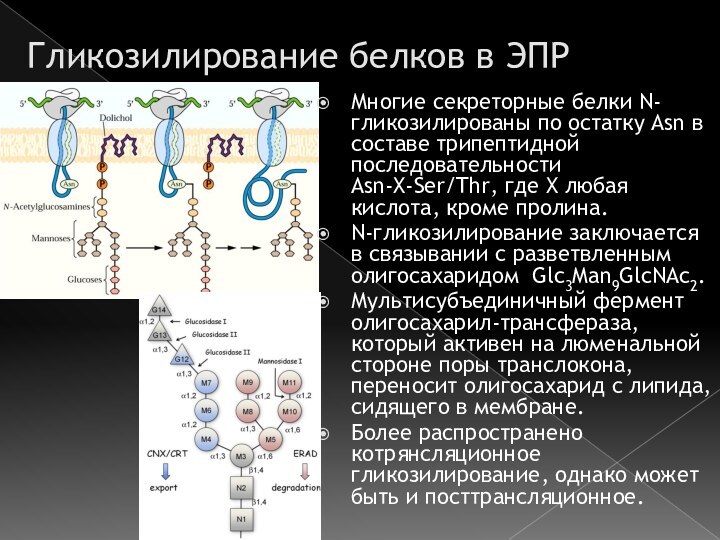
Гликозилирование белков в ЭПР
Многие секреторные белки N-гликозилированы по
остатку Asn в составе трипептидной последовательности Asn-X-Ser/Thr, где X
любая кислота, кроме пролина.N-гликозилирование заключается в связывании с разветвленным олигосахаридом Glc3Man9GlcNAc2.
Мультисубъединичный фермент олигосахарил-трансфераза, который активен на люменальной стороне поры транслокона, переносит олигосахарид с липида, сидящего в мембране.
Более распространено котрянсляционное гликозилирование, однако может быть и посттрансляционное.
Слайд 20 Jian-Xiang Liu, and Stephen H. Howell Plant Cell
2010;22:2930-2942
©2010 by American Society of Plant Biologists
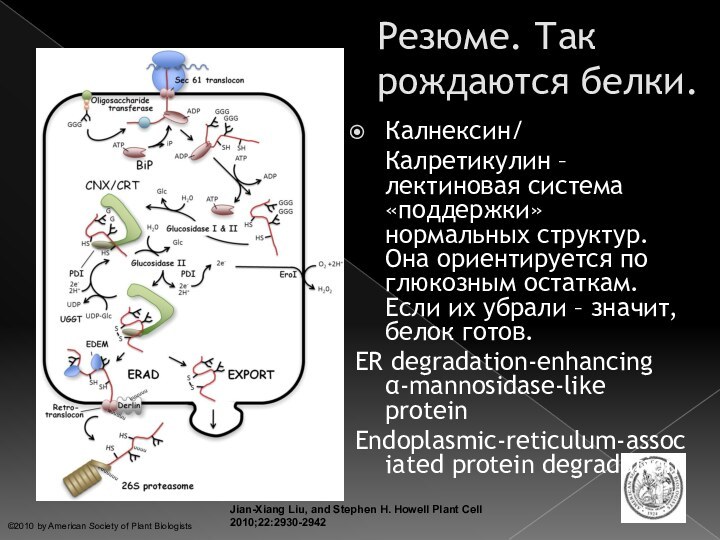
Резюме. Так рождаются
белки.Калнексин/
Калретикулин – лектиновая система «поддержки» нормальных структур. Она ориентируется по глюкозным остаткам. Если их убрали – значит, белок готов.
ER degradation-enhancing α-mannosidase-like protein
Endoplasmic-reticulum-associated protein degradation
Слайд 21
Функции ЭПР в процессинге белков
Модификация определенных аминокислот,
например, превращение пролина в гидроксипролин.
N-гликозилирование и отщепление глюкозы
у N-связанных гликанов. Образование правильных S-S связей (глутатион и дисульфидизомераза).
Правильное сворачивание белковой молекулы (шапероны, например, пептидилпролилизомераза и BiP).
Сборка олигомерных комплексов.
Деградация неправильных белков или их транспорт для разрушения в цитозоль.
Слайд 22
Alessandro Vitale, and Jürgen Denecke Plant Cell 1999;11:615-628
©1999
by American Society of Plant Biologists
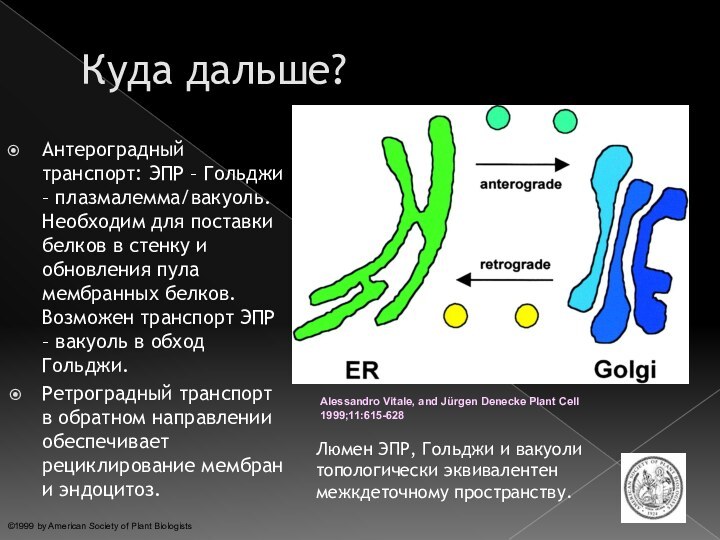
Куда дальше?
Антероградный транспорт: ЭПР
– Гольджи – плазмалемма/вакуоль. Необходим для поставки белков в стенку и обновления пула мембранных белков. Возможен транспорт ЭПР – вакуоль в обход Гольджи. Ретроградный транспорт в обратном направлении обеспечивает рециклирование мембран и эндоцитоз.
Люмен ЭПР, Гольджи и вакуоли топологически эквивалентен межкдеточному пространству.
Слайд 23
Alessandro Vitale, and Jürgen Denecke Plant Cell 1999;11:615-628
©1999
by American Society of Plant Biologists
Экспорт
Рассматривается две модели: активный
отбор и случайное попадание.Активные отбор подразумевает, что есть сигнал экспорта и рецептор, а белки ЭПР не попадают в Гольджи.
Случайное попадание подразумевает, что белки пакуются в везикулы по умолчанию, а ЭПР-резиденты затем возвращаются ретроградно.
Слайд 24
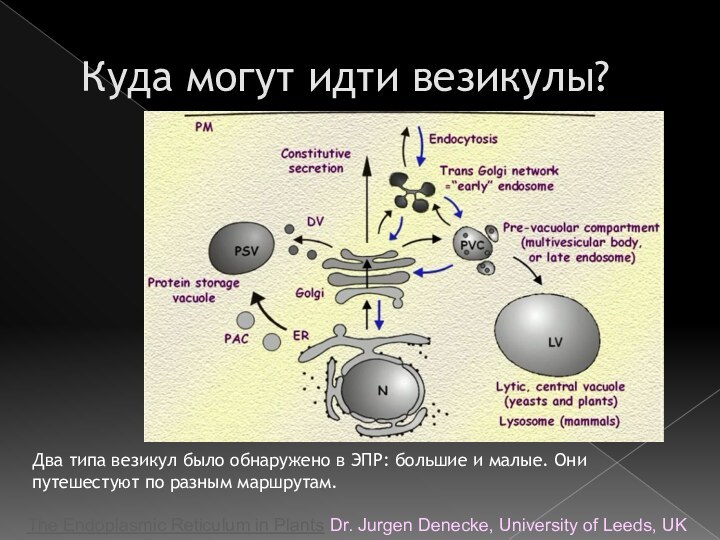
Куда могут идти везикулы?
The Endoplasmic Reticulum in Plants
Dr. Jurgen Denecke, University of Leeds, UK
Два типа
везикул было обнаружено в ЭПР: большие и малые. Они путешестуют по разным маршрутам.
Слайд 25
Возврат ЭПР-резидентов
Был обнаружен рецептор, который опознает ЭПР-резидентные белки
на входе в Гольджи - ERD2 (ER-retention defective).
Он помогает
возвращать такие белки, как BiP, попавшие в везикулы, обратно в ЭПР, узнавая их сигнальную последовательность. Вместе с BiP в ЭПР возвращаются и дефектные белки, которые неправильно свернулись.
Однако, пока неизвестно, каким образом он сам возвращается в Гольджи.
Слайд 26
Запасные белки: где их хранят?
Запасные белки могут храниться
в двух компартментах: белковых вакуолях (PSVs) в терминально дифференцированных
клетках зародыша или эндосперма и в белковых тельцах (PBs), которые собираются непосредственно в ЭПР.Запасные белки формируют димеры, тримеры и тетрамеры сразу после трансляции в люмене ЭПР.
Запасные белки бобовых – глобулины – растворимые белки, в т.ч. в олигомерной форме. Они отправляются в PSVs
Запасные белки злаков – проламины – формируют большие агрегаты. У кукурузы и риса они так и остаются в ЭПР, у пшеницы и отпочковываются, упакованные в мембрану ЭПР, формируя PBs.
Слайд 27 Eliot M. Herman, and Brian A. Larkins Plant
Cell 1999;11:601-613
©1999 by American Society of Plant Biologists
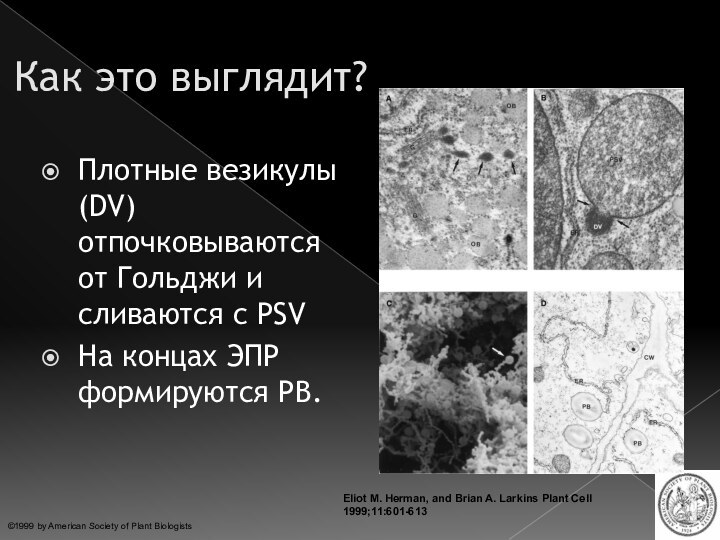
Как это
выглядит?Плотные везикулы (DV) отпочковываются от Гольджи и сливаются с PSV
На концах ЭПР формируются PB.
Слайд 28
Проламины
Проламины – запасные белки у злаков.
Они гидрофобны.
Богаты пролином
и глутамином (30-70%): повторяющиеся гидрофобные последовательности из 20 аминокислот
Однако,
агрегация обусловлена не только неспецифическими гидрофобными взаимодействиями (модель «ЭПР-сосиска»), а специфическими взаимодействиями между серо-богатыми и серо-бедными проламинами.
Слайд 29
Пример: эндосперм кукурузы
PBs формируются в люмене ЭПР и
содержат 4 различных проламина: α-, β-, γ-, и ∂-зеины.
PBs наименьшего диаметра содержат β- и γ-зеины, богатые цистеином и сшитые дисульфидными мостиками.
α- и ∂-зеины, внедряясь в их компанию, расширяют PB до больших сферических структур, которые достигают от 1 до 2 μm в диаметре.
Слайд 30 Eliot M. Herman, and Brian A. Larkins Plant
Cell 1999;11:601-613
©1999 by American Society of Plant Biologists
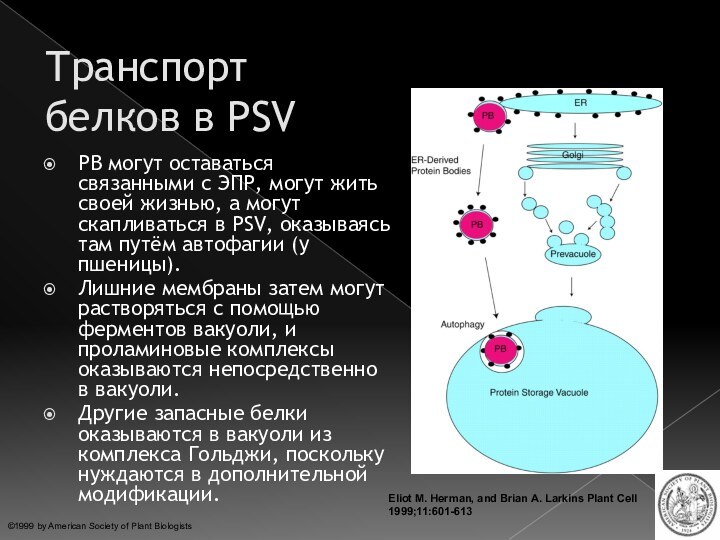
Транспорт
белков
в PSVPB могут оставаться связанными с ЭПР, могут жить своей жизнью, а могут скапливаться в PSV, оказываясь там путём автофагии (у пшеницы).
Лишние мембраны затем могут растворяться с помощью ферментов вакуоли, и проламиновые комплексы оказываются непосредственно в вакуоли.
Другие запасные белки оказываются в вакуоли из комплекса Гольджи, поскольку нуждаются в дополнительной модификации.
Слайд 31
Вакуолярные компартменты
В молодых клетках две группы вакуолярных белков
локализованы в разных компартментах: 1. запасной, 2. литический.
В
большой вакуоли оба компартмента объединяются.Nadine Paris, C.Michael Stanley, Russell L Jones, John C Rogers
Plant Cells Contain Two Functionally Distinct Vacuolar Compartments
Сell, Volume 85, Issue 4, 1996, 563–572
Слайд 33 Биохимическая модификация белка. «Дозревание» белков, предназначенных для секреторного
пути
Биосинтез полисахаридов матрикса клеточной стенки
Секреторный путь транспорта. Везикулярный транспорт.
Рециклирование клеточных мембран. Функции аппарата Гольджи?
Слайд 37
Гипотезы о природе транспорта материала через ап.Гольджи
а) челночный
транспорт
б) перемещение цистерн
Слайд 38
Функции аппарата Гольджи в процессинге белков
Сложные модификации N-связанных
гликанов.
О-гликозилирование серина, треонина и гидроксипролина в составе белковой молекулы.
Слайд 39
Маннозидаза I
отщепление 4 молекул маннозы
GlcNAc-трансфераза I
присоединяет
N-ацетилглюкозамин к одной из оставшихся молекул маннозы;
Маннозидаза II
отщепляет еще два маннозных остатка;Присоединение фукозы, ксилозы и второй молекулы ацетилглюкозамина
GlcNAc-трансферазой II
Слайд 40 Фракция 3 (наименее плотная): содержит ферменты присоединения двух
молекул фукозы и двух молекул галактозы;
два N-ацетилгюкозамина удаляются
Слайд 43 Актиномиозиновая система клетки обеспечивает движение стопок Гольджи в
клетке по принципу «остановились – пошли».
Перемещение стопок Гольджи связано
с функционированием секреторного пути транспорта везикул.
Слайд 44
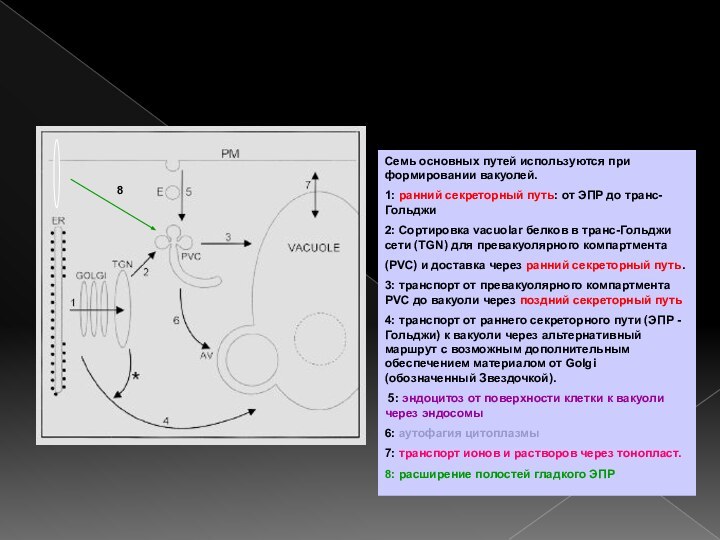
Семь основных путей используются при формировании вакуолей.
1: ранний
секреторный путь: от ЭПР до транс-Гольджи
2: Сортировка vacuolar белков
в транс-Гольджи сети (TGN) для превакуолярного компартмента(PVC) и доставка через ранний секреторный путь.
3: транспорт от превакуолярного компартмента PVC до вакуоли через поздний секреторный путь
4: транспорт от раннего секреторного пути (ЭПР - Гольджи) к вакуоли через альтернативный маршрут с возможным дополнительным обеспечением материалом от Golgi (обозначенный Звездочкой).
5: эндоцитоз от поверхности клетки к вакуоли через эндосомы
6: аутофагия цитоплазмы
7: транспорт ионов и растворов через тонопласт.
8: расширение полостей гладкого ЭПР
Образование вакуолей
8
Слайд 45
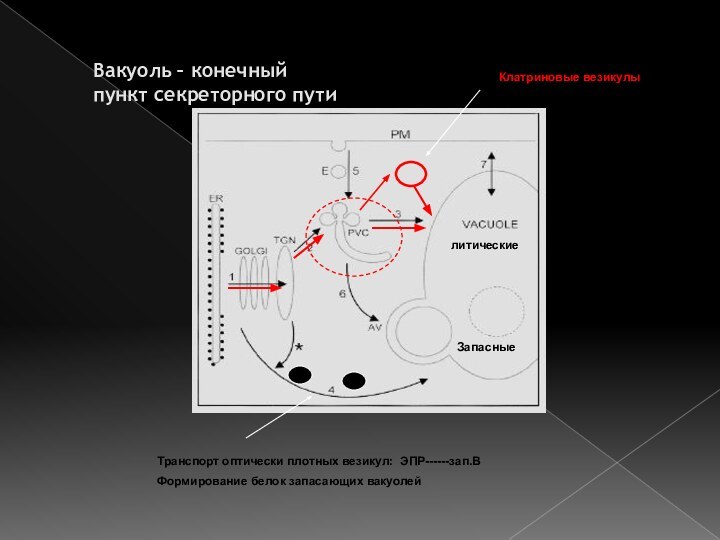
Вакуоль – конечный пункт секреторного пути
Транспорт оптически плотных
везикул: ЭПР------зап.В
Формирование белок запасающих вакуолей
Клатриновые везикулы : -----
литические вакуолилитические
Запасные





























