Слайд 2
1. Строение и механизм действия рецепторов-каналов.
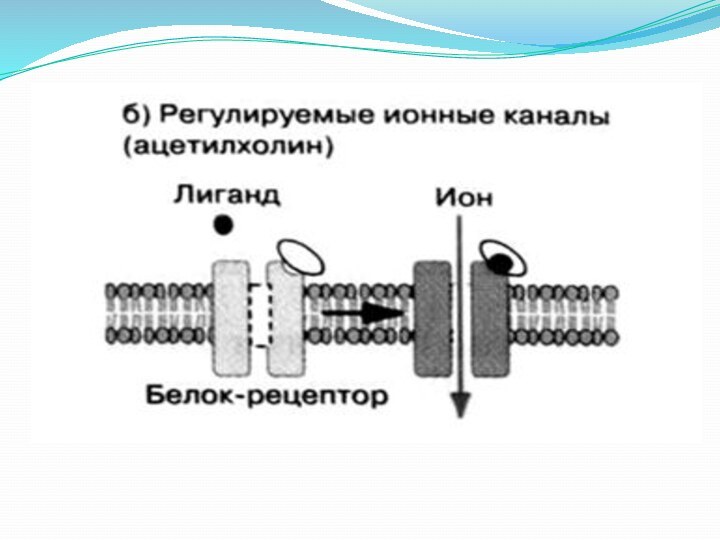
Рецепторы-каналы - никотиновые
ацетилхолиновые рецепторы, находящиеся на постсинаптической мембране нервно-мышечного соединения. Никотиновый
ацетилхолиновый рецептор представляет собой гликопротеин, состоящий из 5 субъединиц (2, , , ), которые кодируются 4 разными генами. Он имеет 2 участка для связывания ацетилхолина. Связывание 2 молекул ацетилхолина с рецептором вызывает его конформационные изменения, что приводит к открыванию канала.
Время открытого состояния канала составляет примерно 1 мсек.
Слайд 4
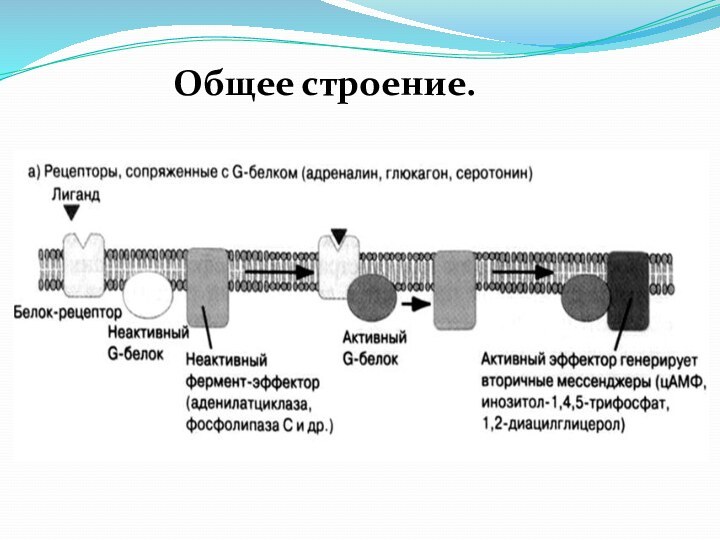
2. Рецепторы связанные с G-белком
Функционирование рецепторов, сопряженных с
G-белками, связано с продуцированием вторичных посредников.
Общее строение.
Эти рецепторы имеют
7 трансмембранных доменов, каждый из которых содержит 20–25 аминокислотных остатков, образующих -спираль.
Кроме того, имеется 8 гидрофильных доменов, которые представляют собой чередующиеся внеклеточные и цитоплазматические петли.
Слайд 6
ГТФ-связующие белки (G-белки)
ГТФ–связывающие белки или G-белки являются гетеротримерными,
состоящие из , и -субъединиц, взаимодействуют и с
рецептором и сэффектором. -субъединицы участвуют в формировании домена для связывания гуаниновых нуклеотидов и обладают ГТФ-азной активностью.
Слайд 9
3. Рецептор, проявляющий ферментативную активность
Рецепторные тирозинкиназы. Главная функция
- каскадная передача сигналов, регулирующих пролиферацию (разрастание ткани организма путём размножения
клеток) и дифференцировку клеток, а также процессы клеточного метаболизма.
Особое значение рецепторных тирозинкиназ – участие в опухолевом процессе. Факторы роста продуцируются опухолевой клеткой и действуют на ее же рецепторы (аутокринная регуляция) или соседние клетки (паракринная регуляция).
Слайд 10
Рецепторная тирозинкиназа имеет 3 основных домена:
внеклеточный N-концевой участок,
который гликолизирован и является агонист-связывающим участком, обеспечивающи специфичность восприятия
сигнала;
собственно трансмембранный участок, состоящий из гидрофобных аминокислот;
внутриклеточный тирозиновый домен, аналогичный для всех рецепторных тирозинкиназ.
Слайд 11
Механизм активации димерных рецепторов,
связанных с тирозинкиназой
Слайд 14
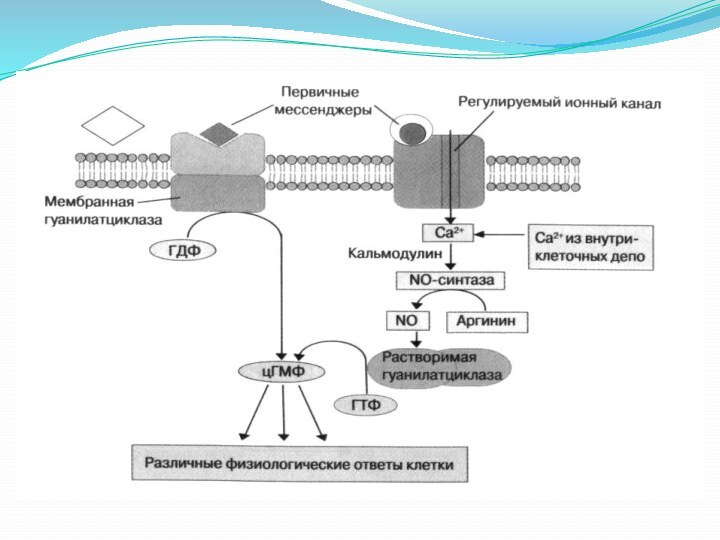
4. Мембраносвязанная гуанилатциклаза.
Фермент состоит из внеклеточного рецепторного домена,
одиночного -спирального трансмембранного сегмента и внутриклеточного каталитического домена.
В
качестве агонистов этого фермента выступают некоторые биогенные пептиды:
натрийуретический пептид, регулирующий гомеостаз жидкости в организме и кардиососудистую функцию; пептиды, секретируемые яичниками и стимулирующие подвижность сперматозоидов; термостабильные энтеротоксины из E. сoli.
Связывание этих агонистов с внеклеточным рецепторным доменом приводит к димеризации рецепторов и активации каталитического домена.
Субстратом мембранносвязанной гуанилатциклазы является ГТФ, который превращается ферментом в 3’,5’-циклический гуанозинмонофосфат (цГМФ).
Слайд 18
Система вторичных посредников
цАМФ (3,5,-циклический аденозинмонофосфат);
цГМФ;
NO (оксид азота);
Ионы Са2+;
Слайд 19
Эффекты цАМФ:
Изменение проницаемости мембран
Синтез стероидных гормонов корой
надпочечников
Секреторные реакции экзо- и эндокринных желез
Транскрипция генов
Перемещение внутриклеточных структур
Подвижность
и агрегация у одноклеточных организмов
Слайд 20
Критерии цАМФ как регулятора (распространяются и на другие
сигнальные внутриклеточные молекулы)
Химический агент должен стимулировать активность аденилатциклазы в
препаратах чувствительной ткани.
В ответ на действие химического агента должна возрастать концентрация цАМФ в ткани.
Косвенное доказательство участия цАМФ в реакции – потенцирование гормонального эффекта ингибиторами фосфодиэстеразы.
Воспроизведение гормонального эффекта с помощью цАМФ или его производного (например, дибутирил-цАМФ).
Слайд 22
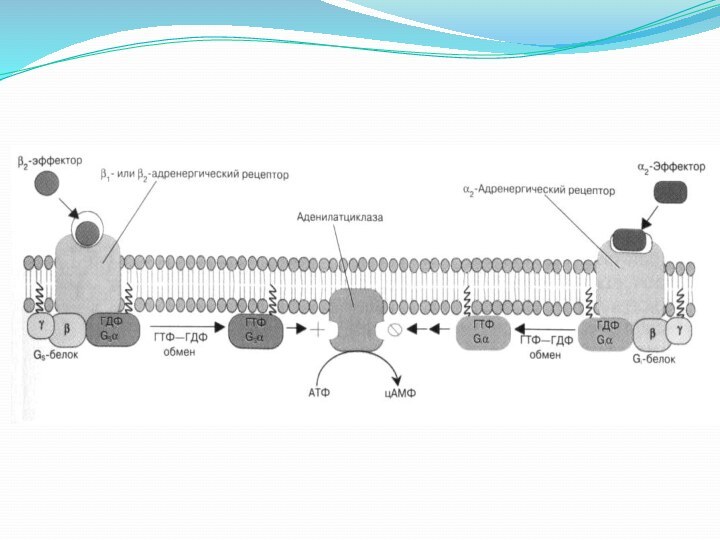
Описание к рисунку с предыдущего слайда
Активация фермента (аденилатциклаз)
происходит в результате взаимодействия стимулирующего (Gs) ГТФ-связывающего с -субъединицей
белка. Примером рецепторов, активирующих аденилатциклазу через стимулирующий ГТФ-связывающий белок, являются -адренергические рецепторы.
α2-Адренергические рецепторы же связаны с ингибирующим (Gi ) ГТФ-связывающим белком.
Аденилатциклаза представляет собой интегральный белок, полипептидная цепь которого образует 12 гидрофобных доменов, встроенных в цитоплазматическую мембрану.
Слайд 23
Распад цАМФ зависит от активности фосфодиэстеразы, которая, в
свою очередь, контролируется ионами Са2+ и кальмодулином.
Увеличение цАМФ в
клетке приводит к активации цАМФ-зависимой протеинкиназы (протеинкиназа А). В неактивной форме этот фермент представляет собой тетрамерный белок, состоящий из двух регуляторных (R) и двух каталитических (С) субъединиц. Каталитические субъединицы приобретают активность только после диссоциации комплекса, которая происходит вследствие присоединения 4 молекул цАМФ к 2 регуляторным субъединицам. (рисунок ниже)
Слайд 25
Субстратами для протеинкиназы А могут быть белки ионных
каналов, ионообменников, транспортных АТФ-аз, цитоскелета, ферменты, белки рибосом, ядерные
белки и др. Все эти субстраты будут фосфорилироваться протеникиназой А по остаткам серина и треонина. Фосфорилирование белков будет изменять их активность как в сторону увеличения, так и уменьшения. На функциональное состояние цАМФ-зависимой сигнальной системы способны оказывать влияние вещества различной природы.
Слайд 26
Дитерпен растительного происхождения форсколин непосредственно активирует АЦ. Ингибиторы
фосфодиэстеразы потенциируют эффекты цАМФ, замедляя процесс его распада. Получены
синтетические соединения, способные модулировать активность ПК-А. Все названные вещества находят применение в изучении физиологии цАМФ-зависимой сигнальной системы, некоторые используются как лекарственные вещества (спазмолитики группы теофилина, папаверин).