Слайд 2
В растворах угол поворота φ пропорционален пройденному пути
и концентрации активного вещества n:
φ = [α] ∙ n
∙ ℓ ,
где [α] – так называемая, удельная постоянная вращения.
В зависимости от направления вращения плоскости поляризации, оптически активные вещества подразделяют на право- и левовращающие, т.е. по или против часовой стрелки по отношению к наблюдателю, к которому свет приближается.
Слайд 3
Энантиомерия (оптическая изомерия)
Пространственная изомерия (стереоизомерия) возникает в результате
различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение.
Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращения плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с др. оптически активными веществами и физических свойств в хиральной среде).
Слайд 4
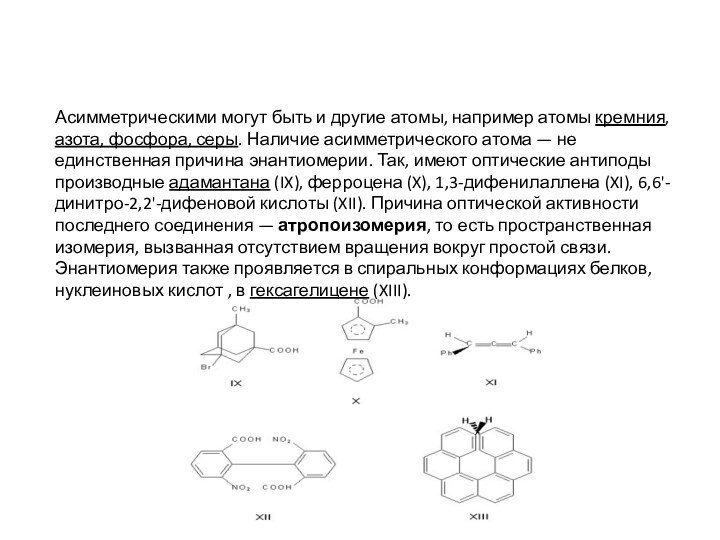
Асимметрическими могут быть и другие атомы, например атомы
кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная
причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6'-динитро-2,2'-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот , в гексагелицене (XIII).
Слайд 5
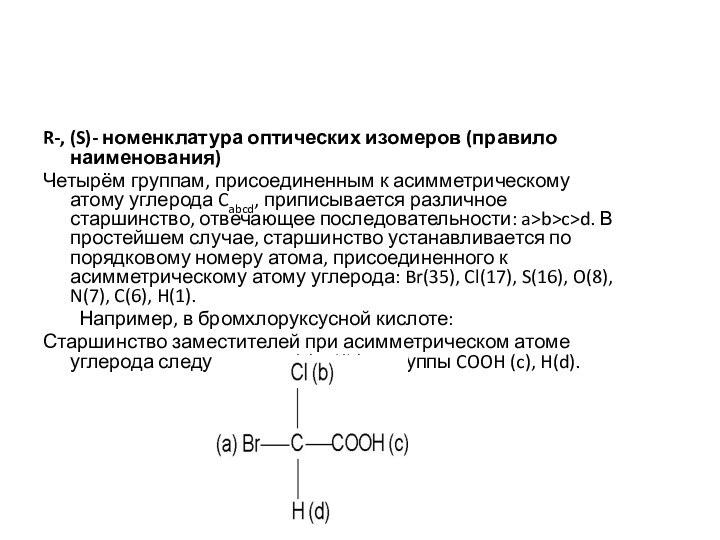
R-, (S)- номенклатура оптических изомеров (правило наименования)
Четырём группам,
присоединенным к асимметрическому атому углерода Cabcd, приписывается различное старшинство,
отвечающее последовательности: a>b>c>d. В простейшем случае, старшинство устанавливается по порядковому номеру атома, присоединенного к асимметрическому атому углерода: Br(35), Cl(17), S(16), O(8), N(7), C(6), H(1).
Например, в бромхлоруксусной кислоте:
Старшинство заместителей при асимметрическом атоме углерода следующее: Br(a), Cl(b), C группы COOH (c), H(d).
Слайд 6
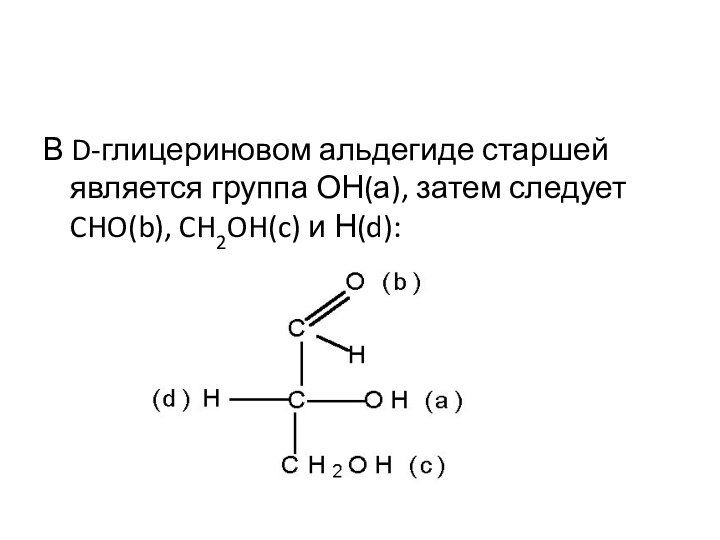
В D-глицериновом альдегиде старшей является группа ОН(а), затем
следует CHO(b), CH2OH(c) и Н(d):
Слайд 7
R)-глицериновый альдегид
В отличие от D-, L- номенклатуры, (R)-
и (S)- в обозначении изомеров заключают в скобки.
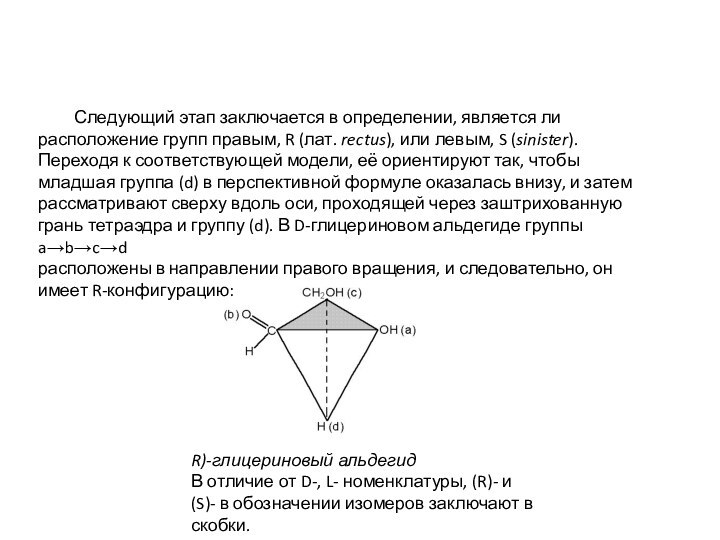
Следующий этап
заключается в определении, является ли расположение групп правым, R (лат. rectus), или левым, S (sinister). Переходя к соответствующей модели, её ориентируют так, чтобы младшая группа (d) в перспективной формуле оказалась внизу, и затем рассматривают сверху вдоль оси, проходящей через заштрихованную грань тетраэдра и группу (d). В D-глицериновом альдегиде группы
a→b→c→d
расположены в направлении правого вращения, и следовательно, он имеет R-конфигурацию:
Слайд 8
Диастереомерия
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие
пару оптических антиподов. Различают σ и π-диастереомеры. σ-диастереомеры отличаются
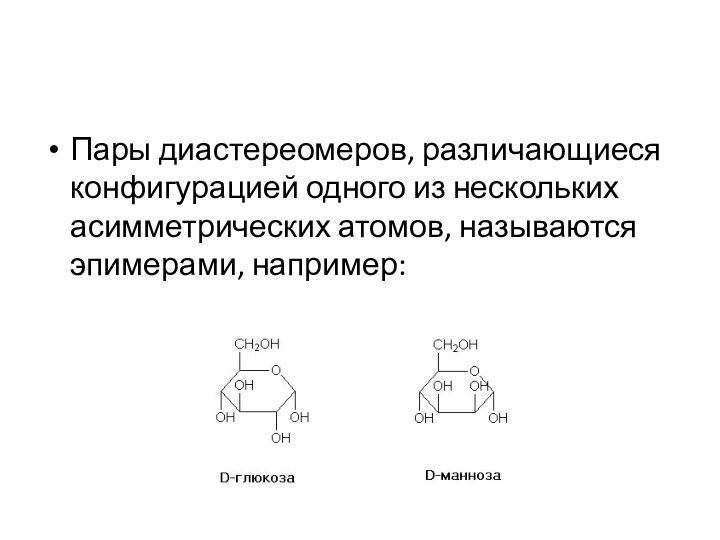
друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
Слайд 9
Пары диастереомеров, различающиеся конфигурацией одного из нескольких асимметрических
атомов, называются эпимерами, например:
Слайд 10
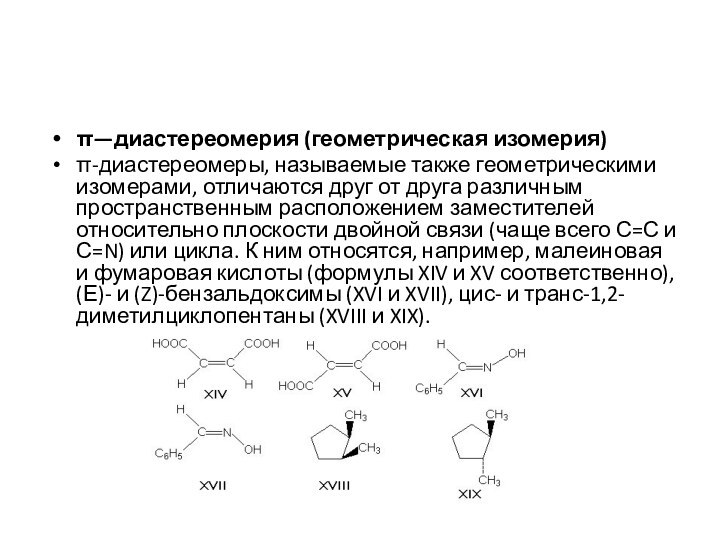
π—диастереомерия (геометрическая изомерия)
π-диастереомеры, называемые также геометрическими изомерами, отличаются
друг от друга различным пространственным расположением заместителей относительно плоскости
двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Слайд 11
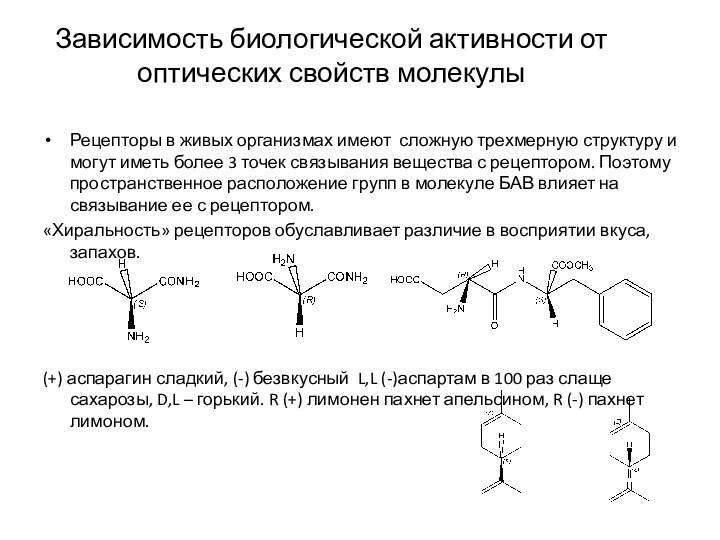
Зависимость биологической активности от оптических свойств молекулы
Рецепторы в
живых организмах имеют сложную трехмерную структуру и могут иметь
более 3 точек связывания вещества с рецептором. Поэтому пространственное расположение групп в молекуле БАВ влияет на связывание ее с рецептором.
«Хиральность» рецепторов обуславливает различие в восприятии вкуса, запахов.
(+) аспарагин сладкий, (-) безвкусный L,L (-)аспартам в 100 раз слаще сахарозы, D,L – горький. R (+) лимонен пахнет апельсином, R (-) пахнет лимоном.
Слайд 12
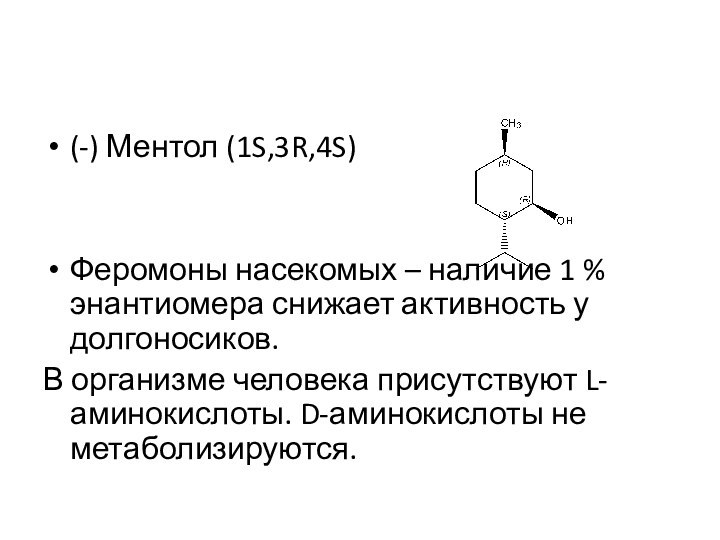
(-) Ментол (1S,3R,4S)
Феромоны насекомых – наличие 1 %
энантиомера снижает активность у долгоносиков.
В организме человека присутствуют L-аминокислоты.
D-аминокислоты не метаболизируются.
Слайд 13
С 1988г FDA (food and Drug Administration) требует
информации об энантиомерной чистоте.
(-) морфин обезболивает, (+) морфин -
нет.
(-) никотин более токсичен, чем его (+) энанатиомер.
Эутомер –более физиологически активный энанатиомер
Дистомер - менее физиологически активный энанатиомер.
Эудимическое соотношение = эутомер/дистомер
Слайд 14
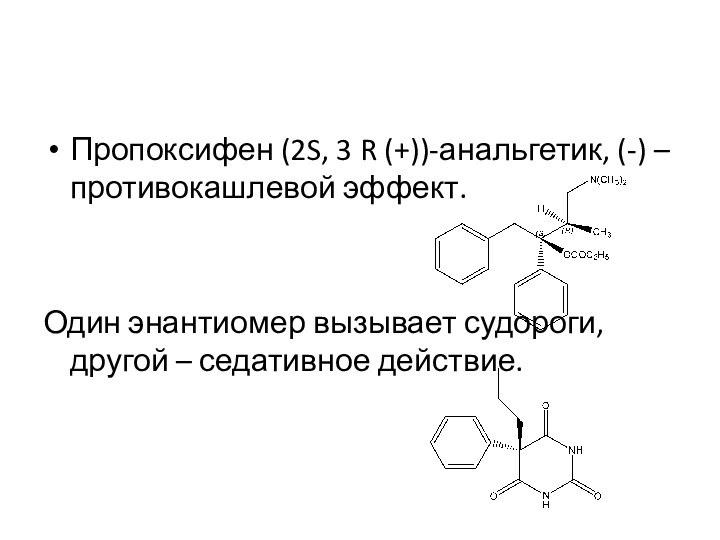
Пропоксифен (2S, 3 R (+))-анальгетик, (-) – противокашлевой
эффект.
Один энантиомер вызывает судороги, другой – седативное действие.
Слайд 15
Варианты изменения биологической активности от соотношения энантиомеров
Первый Э.
активен, второй недеятельный.
2. Одинаковая активность Э (D, L -
камфара).
3. Активность совпадает, но различается количественно.
4. Активность не совпадает, различается качественно (энантиомеры - антагонисты друг относительно друга).
Слайд 16
«Трехточечное взаимодействие» - наличие в активном центре фермента
или рецептора 3 пространственно-ориентированных мест связывания.
S-(-) гиосциамин активнее своего
R – энантиомера в 200 раз, но быстро рацемизуется в оптически неактивный атропин, поэтому и используется в виде рацемата.
Ибупрофен (противовоспалительный препарат) используется в виде рацемата, т.к. R(-) дистомер в организме превращается в эутомер S(+) .