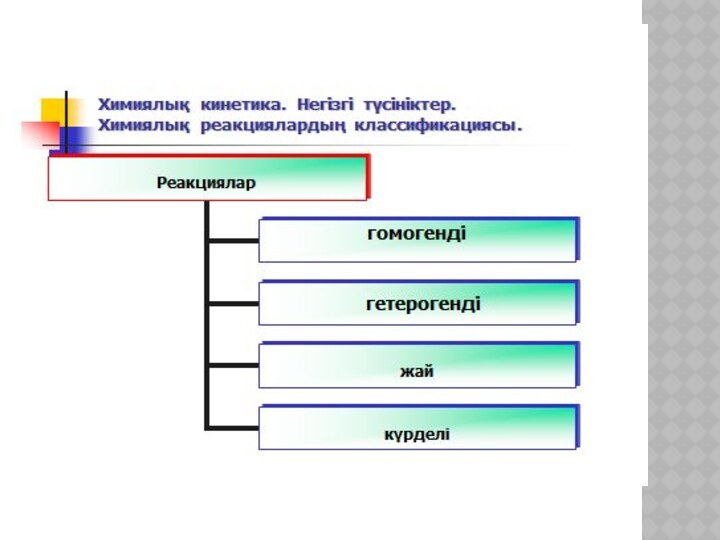
жүйе ретіндегі ерекшеліктері. Пригожин принципі.
Химиялық термодинамиканың негізгі түсініктерінің
биохимияда қолданылуы.Тірі ағзадағы катализ. Ферменттер биохимиялық процестердің катализаторлары ретінде. Фермента-тивті реакциялар кинетикасының ерекшеліктері.
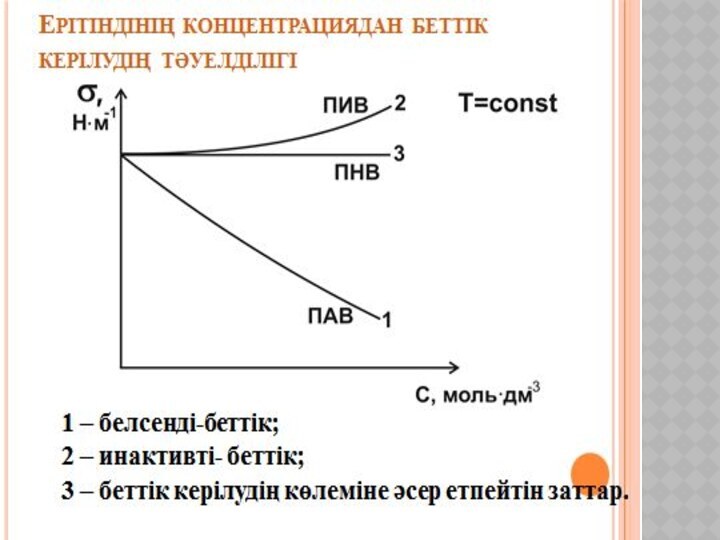
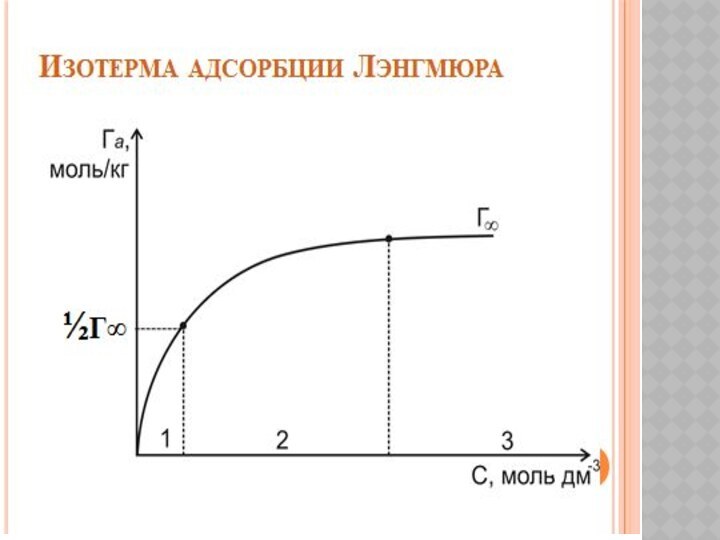
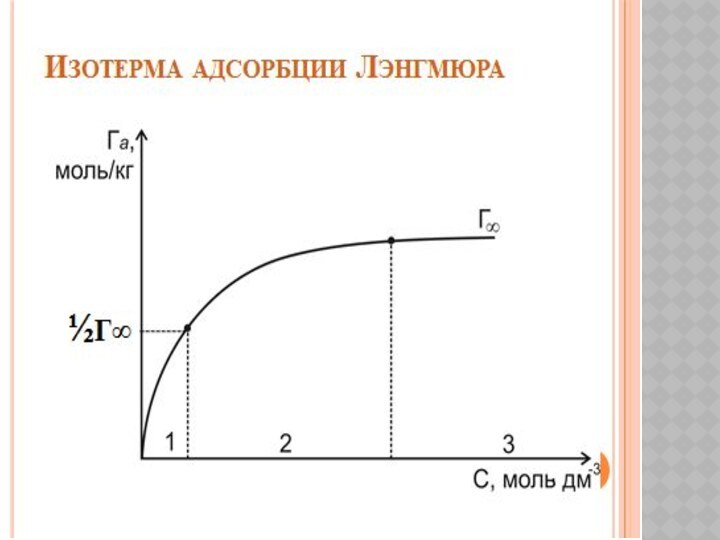
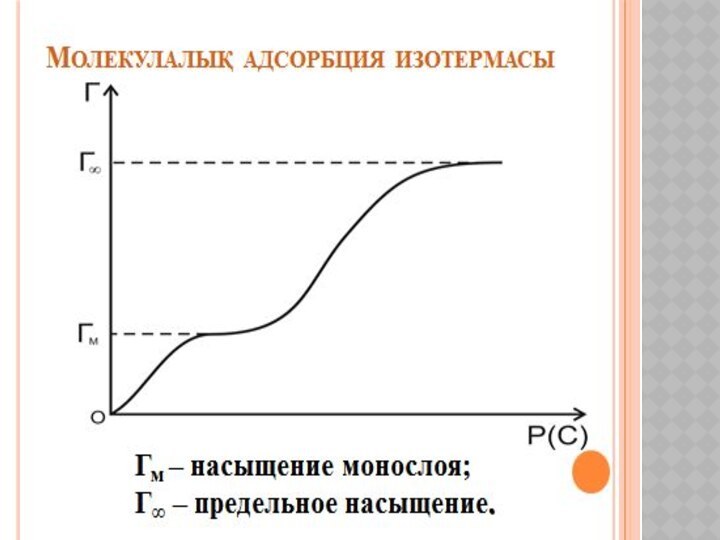
Беттік құбылыстар. Хроматография негіздері және оның медициналық-биологиялық зерттеулерде қолданылуы.