- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Тема: Общая характеристика металлов. Металлическая связь.
Содержание
- 2. Физические свойства различных металлов делает их полезными для различных целейНапример, Алюминий ……………………………………………………………………………………………………………….Золото ……………………………………………………………………………………………………………………..Медь………………………………………………………………………………………………………………………..Вольфрам………………………………………………………………………………………………………………… Железо……………………………………………………………………………………………………………………..Хром………………………………………………………………………………………………………………………….
- 3. Металлам присущи свойства, которых нет у неметаллов! К А К И Е ?
- 4. Ме блеск, ковкость, пластичность, теплопроводность, электропроводность, а также высокие температуры плавления и кипения, твердость, плотность.
- 5. Metallic bonding металлическая связь Частицы в
- 6. Мetal crystal lattice Металлическая кристаллическая решеткаМеталлы
- 7. Виды металлических кристаллических решетока – объемно-центрированная кубическая;
- 8. Общие химические свойства металловВзаимодействие с простыми веществами1)
- 10. Металлы, стоящие в ряду активности до водорода восстанавливают кислоты-неокислители до водорода!Взаимодействие металлов с кислотами
- 11. Взаимодействие металлов с кислотами-неокислителями
- 12. Взаимодействие металлов с кислотами окислителямиПри взаимодействии азотной
- 13. Электрохимический ряд напряжений металловПомни: холодная конц.серная и
- 14. Вытеснение более активными металлами менее активных металлов из растворов их солей.Приведите два примера уравнений реакций.
- 15. Скачать презентацию
- 16. Похожие презентации











Слайд 4 Ме блеск, ковкость, пластичность, теплопроводность, электропроводность, а также
высокие температуры плавления и кипения, твердость, плотность.
Слайд 5
Metallic bonding
металлическая связь
Частицы в металле удерживаются вместе с
помощью сильных металлических связей.
Чтобы отделить частицы требуется много
энергии. Именно поэтому металлы имеют высокие значения температур плавления и кипения.
Твердые металлы – это кристаллические частицы расположенные близко друг к другу в определенной последовательности.
Слайд 6
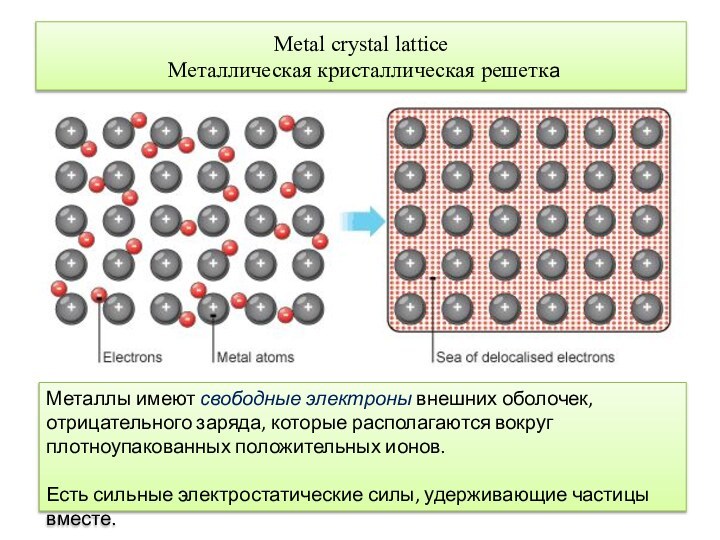
Мetal crystal lattice
Металлическая кристаллическая решетка
Металлы имеют свободные
электроны внешних оболочек, отрицательного заряда, которые располагаются вокруг плотноупакованных
положительных ионов.Есть сильные электростатические силы, удерживающие частицы вместе.
Слайд 7
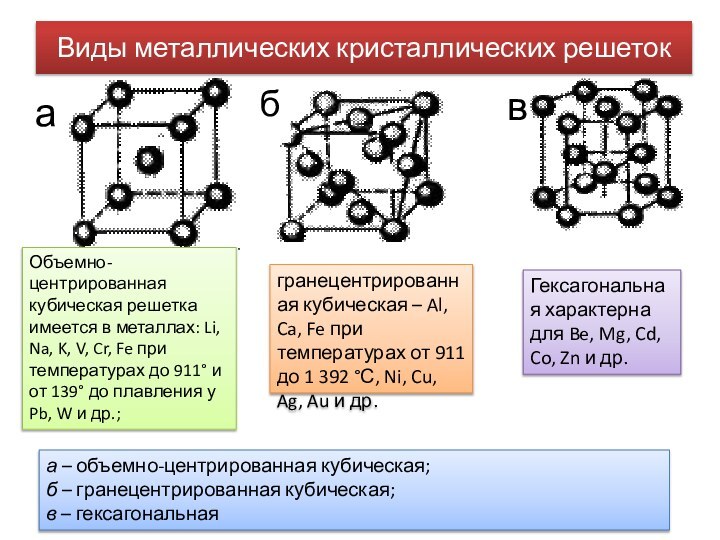
Виды металлических кристаллических решеток
а – объемно-центрированная кубическая;
б
– гранецентрированная кубическая;
в – гексагональная
а
б
в
Объемно-центрированная кубическая решетка имеется
в металлах: Li, Na, K, V, Cr, Fe при температурах до 911° и от 139° до плавления у Pb, W и др.;гранецентрированная кубическая – Al, Ca, Fe при температурах от 911 до 1 392 °С, Ni, Cu, Ag, Au и др.
Гексагональная характерна для Be, Mg, Cd, Co, Zn и др.
Слайд 8
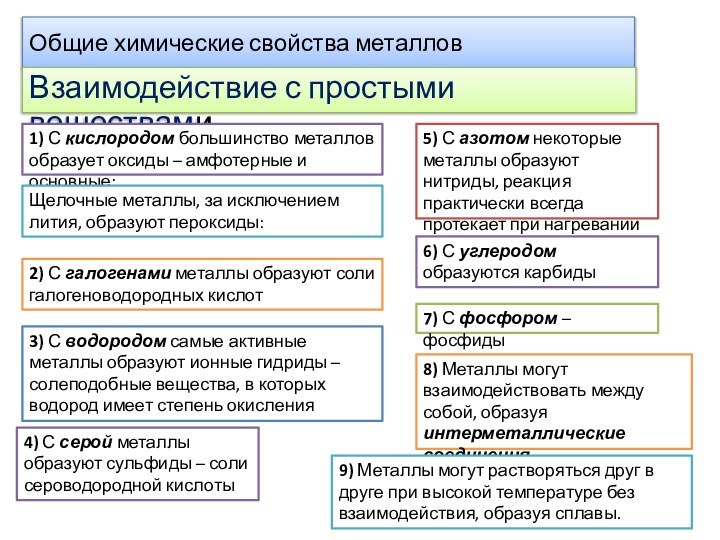
Общие химические свойства металлов
Взаимодействие с простыми веществами
1) С
кислородом большинство металлов образует оксиды – амфотерные и основные:
Щелочные
металлы, за исключением лития, образуют пероксиды:2) С галогенами металлы образуют соли галогеноводородных кислот
3) С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления
4) С серой металлы образуют сульфиды – соли сероводородной кислоты
5) С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании
6) С углеродом образуются карбиды
7) С фосфором – фосфиды
8) Металлы могут взаимодействовать между собой, образуя интерметаллические соединения
9) Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
Слайд 10 Металлы, стоящие в ряду активности до водорода восстанавливают
кислоты-неокислители до водорода!
Взаимодействие металлов с кислотами
Слайд 12
Взаимодействие металлов с кислотами окислителями
При взаимодействии азотной кислоты
любой концентрации и концентрированной серной с металлами водород никогда
не выделяется!
Слайд 13
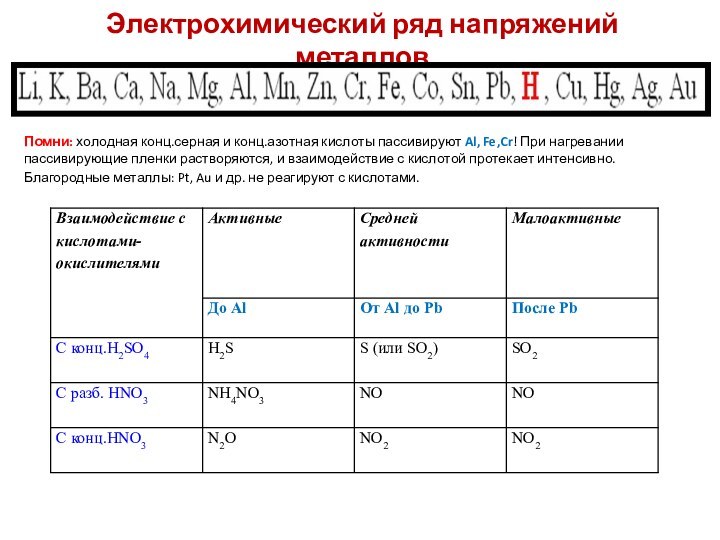
Электрохимический ряд напряжений металлов
Помни: холодная конц.серная и конц.азотная
кислоты пассивируют Al, Fe,Cr! При нагревании пассивирующие пленки растворяются,
и взаимодействие с кислотой протекает интенсивно.Благородные металлы: Pt, Au и др. не реагируют с кислотами.





























