Слайд 2
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ЭКСТРАКЦИЯ (жидкостная экстракция)
Экстракция (extraction,
liquid-liquid extraction, solvent extraction) – операция переноса растворенного вещества
из одной жидкой фазы в другую (обычно из водной фазы в органическую).
За экстракцией обычно следует обратный процесс реэкстракции.
Реэкстракция (stripping) - операция переноса вещества из экстракта в водный раствор или осадок.
Слайд 3
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОСНОВНЫЕ определения (1)
Экстрагент (solvent)
— органическое соединение или его раствор в органическом растворителе,
способное к переносу какого-либо вещества из водной фазы в органическую, S.
Экстракционный реагент (extractant) — активное органическое вещество, способное образовывать определенные соединения с извлекаемыми веществами и переводить их в органическую фазу. В случае применения в неразбавленном виде является синонимом термина «экстрагент».
Разбавитель (растворитель) (diluent) — жидкое органическое вещество или смесь веществ для разбавления или растворения экстракционного реагента, например, керосин для трибутилфосфата (ТБФ) или бензол для теноилтрифторацетона (ТТА). Чаще всего инертен, в некоторых случаях может принимать участие в экстракции.
Слайд 4
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОСНОВНЫЕ определения (2)
Экстракт (extract)
— равновесная органическая фаза, содержащая вещество, извлеченное из водного
раствора, Е.
Рафинат (rafinate) — раствор вещества, оставшегося в равновесной водной фазе после проведения операции экстракции. Это может быть чистый продукт, отделенный от примесей, или примеси, отделенные от основного продукта, перешедшего в органическую фазу, R.
Реэкстракт (strip product solution) - раствор вещества, извлеченного из экстракта.
Слайд 5
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ЗАКОН Бертло-Нернста
Закон Бертло
— Нернста (установлен экспериментально и выполняется для микроконцентраций распределяющегося
вещества)
при распределении вещества между двумя несмешивающимися жидкими фазами при постоянных давлении и температуре отношение равновесных концентраций распределяющегося вещества в этих фазах есть величина постоянная, независящая от абсолютного количества вещества и объемов фаз.
КN = m iорг / m iводн = const где КN – концентрационная константа распределения (константа Нернста);
m iорг и m iводн - концентрации распределяющегося вещества в органической и водной фазах.
Слайд 6
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
КОЭФФИЦИЕНТ
распределения, α (2)
Коэффициент распределения (distribution ratio, distribution coefficient), α - отношение
полной аналитической концентрации вещества в органической фазе к полной аналитической концентрации этого же вещества в водной фазе:
α = m iорг / m iводн
Определяют коэффициент распределения обычно при равновесии, но он может быть определен и в неравновесных условиях и фиксированных условиях измерения). При больших разбавлениях коэффициент распределения равен концентрационной константе распределения константе распределения (константе Нернста).
Необходимость в реэкстракции накладывает ограничения на практически приемлемые α. При подборе экстрагента обычно ищут компромиссные α, удовлетворяющие как экстракции, так и реэкстракции (1< α <10).
Слайд 7
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОСНОВНЫЕ определения (3)
Изотерма экстракции,
изотерма распределения (distribution isotherm) - графическое или цифровое изображение
зависимости концентрации распределяющегося вещества в органической фазе от его концентрации в водной фазе, определенной в равновесных условиях при заданной температуре.
Коэффициент экстракции, экстракционный фактор (extraction factor, mass distribution ratio), ε - отношение количества вещества в органической фазе к количеству этого вещества в водной фазе. Коэффициент экстракции равен произведению коэффициента распределения на отношение объемов фаз: ε = α Vорг / Vводн
Степень извлечения вещества, извлекаемая доля (fraction extracted) — количество вещества, перешедшее в органическую фазу; измеряется в долях или процентах по отношению к исходному количеству вещества, η
η = ε / (1 + ε).
1 - η = φ - остаток извлекаемого вещества в водной фазе (неизвлекаемая доля).
φ + η = 1
φ = 1 / (1 + ε).
Слайд 8
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
КОЛИЧЕСТВЕННЫЕ параметры разделения (очистки)
Коэффициент
разделения (separation factor) - отношение двух коэффициентов распределения β
2,1.
Как правило, индекс 2 относят к лучше экстрагирующемуся компоненту
β 2,1= α2 / α1 (по соглашению >1)
Для практической реализации достаточны коэффициенты разделения в пределах 1,8 -2,0, причем при одинаковых коэффициентах разделения предпочтительны, системы, в которых α2 ≈ 1 / α1.
Коэффициент обогащения (enrichment factor)- отношение относительного содержания лучше экстрагируемого компонента в экстракте к его относительному содержанию в исходной смеси (q2) и/или отношение относительного содержания хуже экстрагируемого компонента в рафинате к его относительному содержанию в исходной смеси (q1):
q2 = η2 /η1, q1 = φ1/ φ2
Коэффициент очистки (decontamination factor) — отношение относительного содержания примеси (contaminant, impurity) в исходной смеси к ее относительному содержанию в конечном чистом продукте, q.
Слайд 9
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ТРЕБОВАНИЯ, предъявляемые к экстрагентам
(1)
1. Органический растворитель должен хорошо извлекать исследуемое вещество из
водной фазы, но не настолько, чтобы затруднялась реэкстракция.
2. Желательно, чтобы применяемый растворитель был избирательным (селективным). Он должен извлекать из растворов только одно вещество или группу родственных соединений.
3. Растворитель должен иметь незначительную растворимость в воде, а вода не должна заметно растворяться в этом растворителе.
Слайд 10
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ТРЕБОВАНИЯ, предъявляемые к экстрагентам
(2)
4. Органический растворитель по возможности не должен быть низкокипящим.
Температура кипения растворителя должна быть выше 50°С. Низкокипящие органические растворители даже при комнатной температуре быстро улетучиваются. Однако, низкая температура кипения органических растворителей является положительным фактором с точки зрения регенерации их после экстракции.
5. Плотность органических растворителей по возможности должна отличаться от плотности воды и водных растворов. При большой разности плотностей указанных жидкостей разделение фаз происходит быстро.
6. Растворители не должны быть пожар- взрыво- опасными или ядовитыми.
Слайд 11
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ТИПЫ экстрагентов
Выделяют две основных
типа экстрагентов: (i) нейтральные, молекулы которых обладают электронодонорными свойствами
и не имеют в составе катионов или анионов, способных к обмену,
(ii) жидкие ионообменники, представляющие собой органические кислоты, основания или их соли, и подразделяющиеся в зависимости от вида обмениваемого иона на анионо- и катионо- обменные.
В некоторых случаях как отдельную группу рассматривают хелатообразующие реагенты, содержащие наряду с функциональными группами, способными обменивать протон на катион металла, группы, образующие с металлом донорно-акцепторную связь.
.
Слайд 12
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
НЕЙТРАЛЬНЫЕ экстрагенты
Молекулы нейтральных экстрагентов
обладают электронодонорными свойствами и не имеют в составе катионов
или анионов, способных к обмену:
- нейтральные фосфорорганические экстрагенты (НФОС). Наиболее важный экстрагент из группы НФОС - три-н-бутилфосфат (ТБФ)
простые макроциклические полиэфиры (краун-эфиры), например, дибензо-18-краун-6
ДБ-18-К-6
высокомолекулярные спирты, кетоны (метилизобутилкетон - гексон), и др.
Слайд 13
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
КАТИОНООБМЕННЫЕ экстрагенты
Катионообменные экстрагенты
- жидкие катионообменники - представляют собой органические кислоты или
их соли:
- фосфорорганические кислоты (ФОК), важнейшая из которых - ди-(2-этилгексил) фосфорная кислота (Д2ЭГФК);
карбоновые и нафтеновые кислоты;
фенолы, например, БАМБФ: 4-вторбутил-2(α-метилбензил)-фенол
соединения других классов, например, карбораны: дикарболлид кобальта, хлорированный дикарболлид кобальта (ХДК) (разработки СПб Радиевого института им. В.Г.Хлопина).
Слайд 14
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
АНИОНООБМЕННЫЕ экстрагенты
Анионообменные экстрагенты -
жидкие анионообменники - представляют собой органические основание или их
соли, содержащие анионы, способные к обмену. Практическое применение находят:
четвертичные аммониевые основания (ЧАО) и их соли (ЧАС):
например, триалкилбензиламмоний хлорид – ТАБАХ
триалкилметиламмоний нитрат – ТАМАН.
высокомолекулярные первичные, вторичные и третичные амины. В молекулах этих соединений нет «готовых» к обмену анионов. Поэтому их первоначально переводят в соли. Например, экстракция анионов три-н-октиламином (ТОА) (С8Н17)3N возможна только в кислых средах, где ТОА находится в виде соли (С8Н17)3N·НNO3.
Слайд 15
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ХЕЛАТООБРАЗУЮЩИЕ экстрагенты
Хелатообразующие экстрагенты –
органические соединения, образующие с катионами металлов циклические комплексные соединения
с участием не менее двух функциональных групп реагента. Они представляют собой слабые органические кислоты.
Наиболее важные хелатообразующие экстрагенты: гидроксиоксимы, производные 8-оксихинолина, β-дикетоны, теноилтрифторацетон (ТТА).
Слайд 16
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ВЛИЯНИЕ различных факторов на
экстракционные процессы
Водная фаза:
высаливатели – влияют на распределение - высаливание
- повышение коэффициентов распределения, благодаря введению посторонних (инертных) электролитов, как правило, имеющих тот же анион, что целевой компонент;
комплексообразователи (влияют на селективность).
Органическая фаза:
подбор разбавителя,
изменение концентрации экстракционного реагента;
добавки других экстрагентов (синергизм, антагонизм);
модификаторы (солюбилизирующие реагенты) - для предотвращения образования «третьей» фазы
Слайд 17
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОСНОВЫ экспериментальных методов исследования
экстракции
При определении коэффициента распределения радиометрическим методом измеряются объемные активности
исходного раствора и равновесных водной и органической фаз (АVводн и А Vорг ). Расчет α производится по формуле
α = А Vорг / АVводн = IVорг / IVводн
где Iv—регистрируемые скорости счета при условии, что плотности органической и водной фаз одинаковы.
В случае существенного различия плотностей фаз коэффициент распределения может быть рассчитан по формуле
α = (IVисх - IVводн) / IVводн
где IVисх — скорость счета исходного раствора при условии, что состав водной фазы в процессе экстракции не меняется. В противном случае необходимо количественно выделять распределяющееся вещество из органической и водной фаз.
Слайд 18
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ПРАКТИЧЕСКОЕ использование процессов экстракции
Разделение, выделение и концентрирование радиоактивных элементов и радиоактивных нуклидов:
выделение
индивидуальных радиоактивных нуклидов из облученных мишеней и облученного ядерного топлива (ОЯТ) (возможно получение препаратов высокой массовой активности)
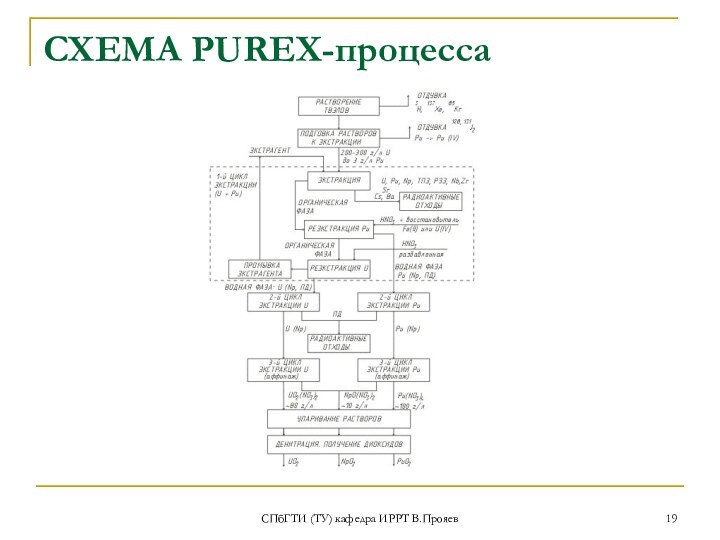
переработка ОЯТ - селективное извлечения урана и плутония - PUREX-процесс (с использованием 30% раствора ТБФ в органических растворителях)
извлечение урана и тория из руд;
переработка жидких высокоактивных отходов (в том числе – с использованием ХДК - разработки СПб РИ им. В.Г.Хлопина)