- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Биохимия соединительной ткани
Содержание
- 2. Структурные разновидности соединительной тканиЖировая клетчаткахрящиКлапаны сердцасухожилиякостифасциинейроглиязубыдесныперегородки Стенки сосудов
- 3. Строение рыхлой соедини-тельной тканиКлетки (фибробласты, мезенхи- мальные клетки,
- 5. КоллагенСамый распространенный белок организма (25-30% всех белков
- 6. Первичная структура коллагена На сегодняшний день известно
- 7. Пространственная структура коллагена Коллаген – мультимерный белокСубъединицей
- 8. Пространственная структура коллагена Тройная спираль тропоколлагена
- 9. Четвертичная структура коллагенаКовалентные Поперечные связиИонные связи по типу «конец вКонец»
- 10. Полипептидные цепиТропоколлагеновые молекулы(тройная спираль)Коллагеновые фибриллыКоллагеновое волокно
- 11. Синтез и процессинг коллагена в фибробластах соединительной ткани
- 12. Сиинтез препроколлагеновой полипептидной цепи. Гидролитическое удаление сигнального
- 13. Эластин
- 14. Эластин – основной белок эластиновых волокон соединительной
- 15. Различия между коллагеном и эластином
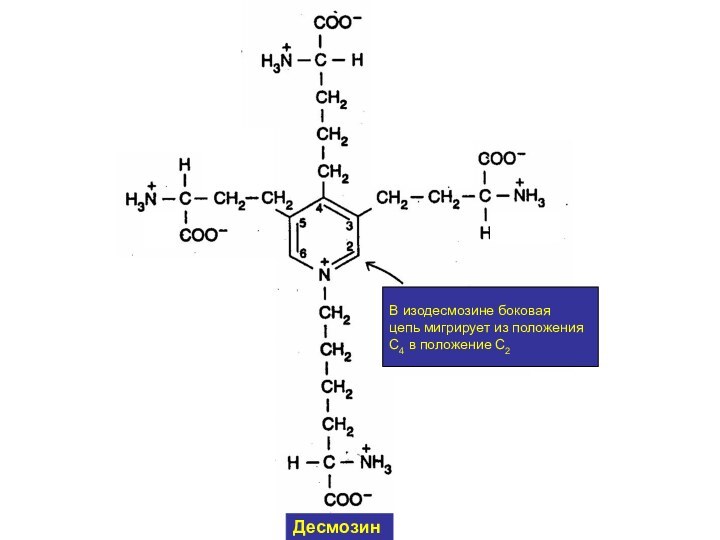
- 16. В изодесмозине боковая цепь мигрирует из положения С4 в положение С2Десмозин
- 17. Основные гликопротеины соединительной ткани
- 18. Протеогликаны
- 19. СОСТАВ ГЛЮКОЗАМИНГЛИКАНОВНазвание глюкозамин-гликанаДисахаридный мономер
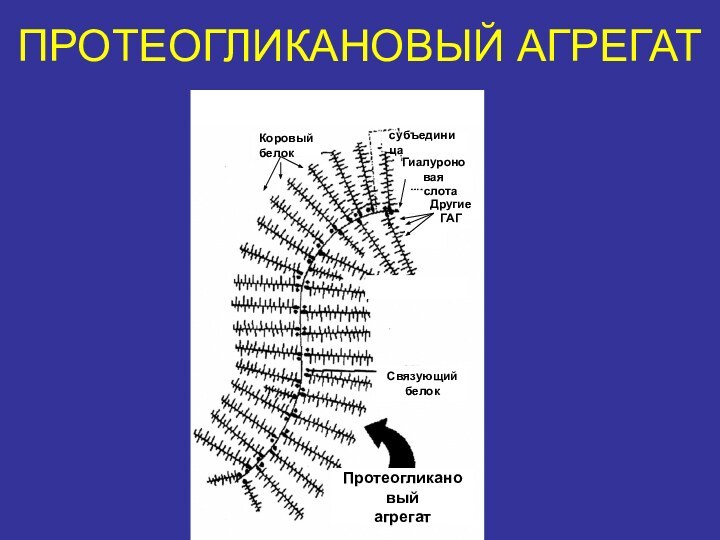
- 20. ПРОТЕОГЛИКАНОВЫЙ АГРЕГАТКоровыйбелоксубъединицаГиалуроноваякислотаДругие ГАГСвязующийбелокПротеогликановыйагрегат
- 21. Функции протеогликановДепонирование воды,Депонирование жира (адипоциты)Депонирование осмотически активных
- 22. Особенности метаболизма соединительной ткани1. Низкая скорость обновления
- 23. Особенности метаболизма соединительной ткани2. Возрастные изменения метаболизма
- 24. Скачать презентацию
- 25. Похожие презентации
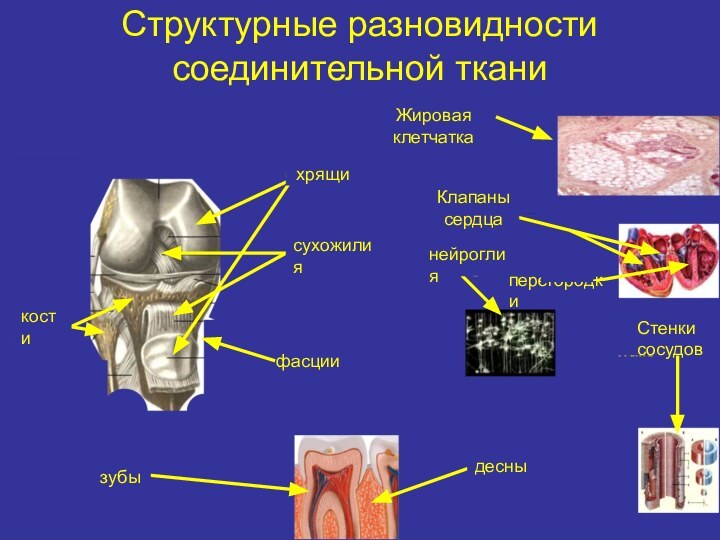
Структурные разновидности соединительной тканиЖировая клетчаткахрящиКлапаны сердцасухожилиякостифасциинейроглиязубыдесныперегородки Стенки сосудов
















Слайд 2
Структурные разновидности соединительной ткани
Жировая
клетчатка
хрящи
Клапаны
сердца
сухожилия
кости
фасции
нейроглия
зубы
десны
перегородки
Стенки
Слайд 3
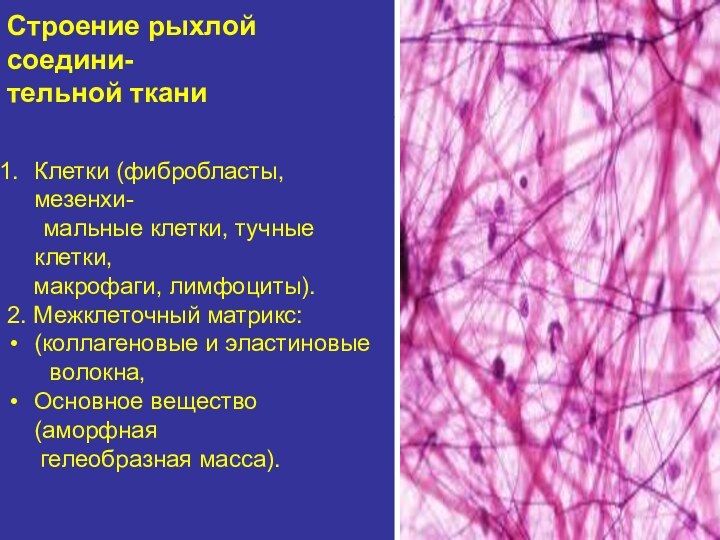
Строение рыхлой соедини-
тельной ткани
Клетки (фибробласты, мезенхи-
мальные клетки, тучные
клетки,
макрофаги, лимфоциты).
2. Межклеточный матрикс:
(коллагеновые и эластиновые
волокна, Основное вещество (аморфная
гелеобразная масса).
Слайд 5
Коллаген
Самый распространенный белок организма (25-30% всех белков организма)
Входит
в состав коллагеновых волокон
Водонерастворимый, но набухающий белок
Мультимерный белок (субъединица
– тропоколлаген)Выполняет структурную и минерализующую функцию
Слайд 6
Первичная структура коллагена
На сегодняшний день известно свыше 20
генетических типов коллагена
Первичная структура коллагена абсолютно уникальна:
-мало или совсем
нет триптофана,-каждая третья аминокислота в п/п цепях коллагена – глицин,
-содержание пролина и гидроксипролина колеблется от 14 до 23%,
-относительно высока доля лизина и гидрокслизина
-наиболее часто повторяемый фрагмент первичной структуры – [гли-про-Х], где Х – какая-либо из остальных аминокислот.
Слайд 7
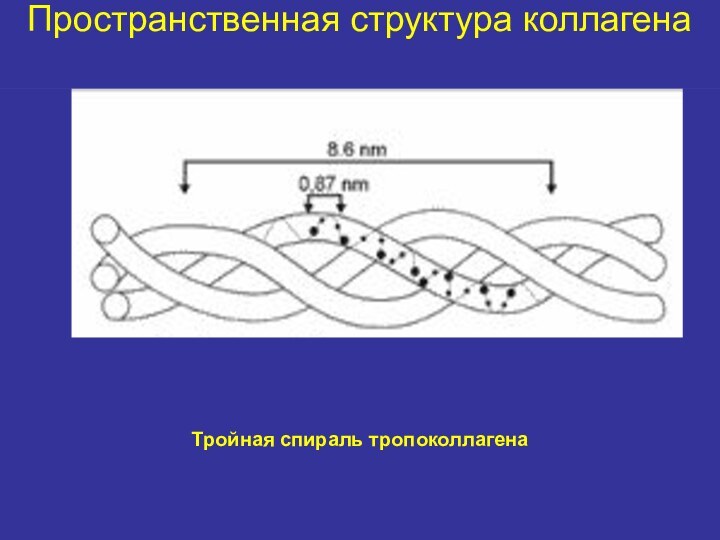
Пространственная структура коллагена
Коллаген – мультимерный белок
Субъединицей коллагена является
тропоколлаген
Каждая молекула тропоколлагена представляет собой правозакрученную спираль из трёх
α-цепей, соединенных друг с другом, в основном, водородными связями за счет остатков гидроксипролина (тройная спираль)
Слайд 9
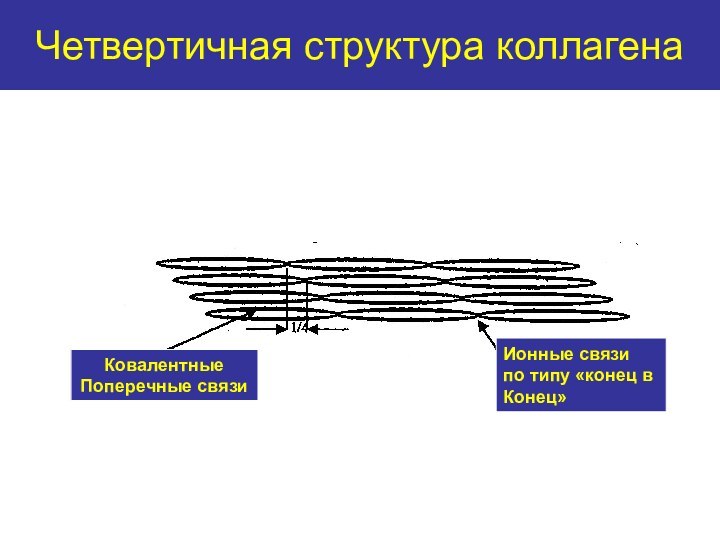
Четвертичная структура коллагена
Ковалентные
Поперечные связи
Ионные связи
по типу
«конец в
Конец»
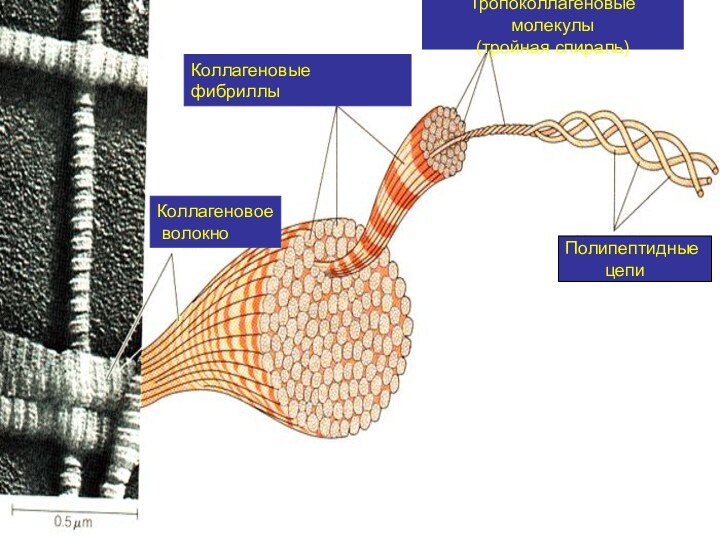
Слайд 10
Полипептидные
цепи
Тропоколлагеновые молекулы
(тройная спираль)
Коллагеновые
фибриллы
Коллагеновое
волокно
Слайд 12
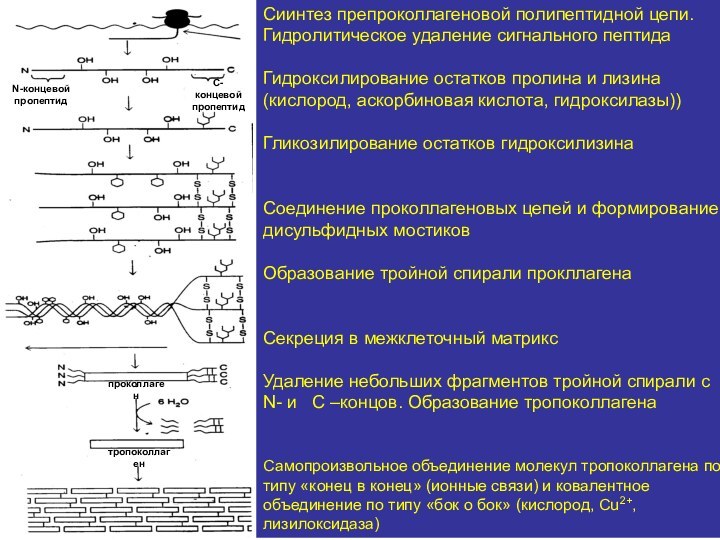
Сиинтез препроколлагеновой полипептидной цепи. Гидролитическое удаление сигнального пептида
Гидроксилирование
остатков пролина и лизина
(кислород, аскорбиновая кислота, гидроксилазы))
Гликозилирование остатков гидроксилизина
Соединение
проколлагеновых цепей и формирование дисульфидных мостиковОбразование тройной спирали прокллагена
Секреция в межклеточный матрикс
Удаление небольших фрагментов тройной спирали с N- и C –концов. Образование тропоколлагена
Самопроизвольное объединение молекул тропоколлагена по типу «конец в конец» (ионные связи) и ковалентное объединение по типу «бок о бок» (кислород, Сu2+, лизилоксидаза)
N-концевой
пропептид
С-концевой
пропептид
проколлаген
тропоколлаген
Слайд 14
Эластин – основной белок эластиновых волокон соединительной ткани
Все
растяжимые органы и ткани содержат большое количество эластиновых волокон,
а следовательно, большое количество эластина:-легкие,
-желчный пузырь,
-мочевой пузырь,
-аорта,
-стенки кровеносных сосудов,
-кишечник,
-связки (особенно выйная и желтая)
Слайд 20
ПРОТЕОГЛИКАНОВЫЙ АГРЕГАТ
Коровый
белок
субъединица
Гиалуроновая
кислота
Другие
ГАГ
Связующий
белок
Протеогликановый
агрегат
Слайд 21
Функции протеогликанов
Депонирование воды,
Депонирование жира (адипоциты)
Депонирование осмотически активных ионов
(Na+, Cl-),
Формирование тургора ткани,
Минерализационная роль (связывание Ca2+ в кости
и зубе),Формирование гисто-гематических барьеров,
Противосвертывающая функция (гепарин)
Защитная функция (сайты связывания иммуноглобулинов)
Слайд 22
Особенности метаболизма соединительной ткани
1. Низкая скорость обновления всех
молекул
(более длительный период полураспада
по сравнению с другими тканями). Например:
- τ1/2 белков печени, почек, легких ~ 5 дней
- τ1/2 альбуминов плазмы крови ~ 7-26 дней,
- τ1/2 коллагена кости ~ 10 лет
Слайд 23
Особенности метаболизма соединительной ткани
2. Возрастные изменения метаболизма соединительной
ткани:
-снижение количества ГАГ,
-снижение отношения ХС/KС (12.0 – дети;
0.95 – старше 60 лет),-увеличение отношения коллаген/эластин,
-увеличение числа поперечных сшивок в коллагене,
-увеличение резистентности коллагена к протеолизу,
-снижение уровня экскреции оксипролина с мочой,
-снижение содержания воды (тургор),
-аномальное накопление солей кальция и
других труднорастворимых солей,
-накопление липофусцина,
-накопление гликозилированных белков (белков Амадори).