- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Колігативні властивості біологічних рідин. (Лекція 3)
Содержание
- 2. Колігативні властивості розчиніводностороння дифузія розчинника через напівпроникну мембрану у бік більш концентрованого розчину називається осмосом.
- 3. Частинки розчинника (сині) здатні перетинати мембрану, частинки розчиненої речовини (червоні) - ні.
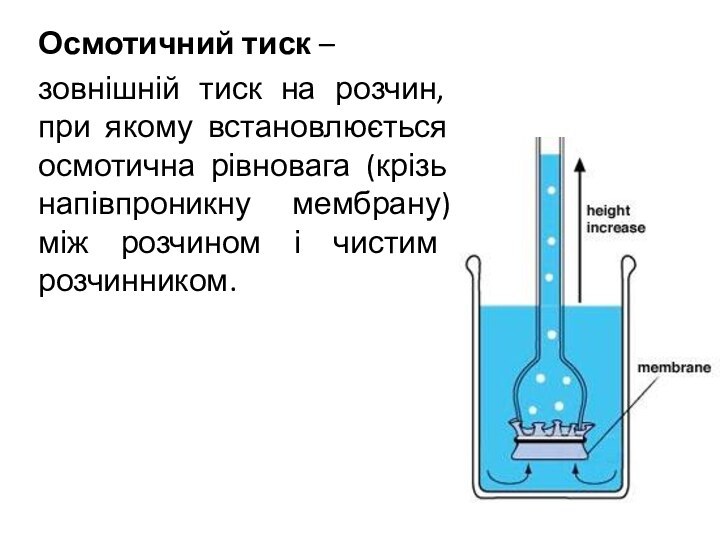
- 4. Осмотичний тиск – зовнішній тиск на розчин,
- 5. Закон Вант-Гоффа: Осмотичний тиск розчину дорівнює тому
- 6. Осмотичний тиск крові людини при 37ºC 780 кПа = 7,8∙105 Па (7,7 атм).
- 7. Розчини з однаковим значенням осмотичного тиску називаються
- 9. Скачать презентацию
- 10. Похожие презентации
Колігативні властивості розчиніводностороння дифузія розчинника через напівпроникну мембрану у бік більш концентрованого розчину називається осмосом.






Слайд 2
Колігативні властивості розчинів
одностороння дифузія розчинника через напівпроникну мембрану
у бік більш концентрованого розчину
Слайд 3 Частинки розчинника (сині) здатні перетинати мембрану, частинки розчиненої
речовини (червоні) - ні.
Слайд 4
Осмотичний тиск –
зовнішній тиск на розчин, при
якому встановлюється осмотична рівновага (крізь напівпроникну мембрану) між розчином
і чистим розчинником.Слайд 5 Закон Вант-Гоффа: Осмотичний тиск розчину дорівнює тому тискові,
який мала б розчинена речовина, якби вона при даній
температурі знаходилася б у газоподібному стані і займала б такий самий об’єм, що займає розчин.= c(X) R∙T,
де: π – осмотичний тиск;
c(X) – молярна концентрація розчиненої речовини X;
R – універсальна газова стала (R = 8,31∙103 );
T – температура.
= і c(X) R∙T
(i вводиться в формулу для розчинів електролітів)
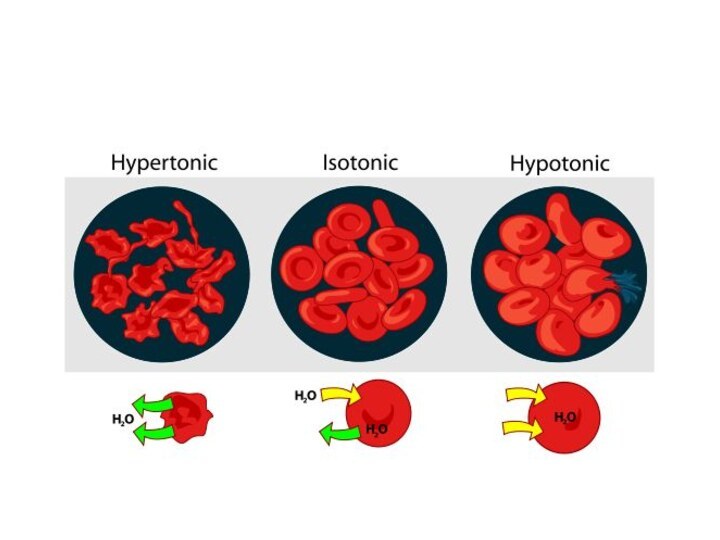
Слайд 7 Розчини з однаковим значенням осмотичного тиску називаються ізотонічними
Ізотонічними відносно крові являються розчини
ω (NaCl) = 0,85
– 0,90 % , (0,15 моль/л) розчин глюкози з масовою часткою глюкози 4,5– 5%, (0,30 моль/л).
Розчини з осмотичним тиском, більш високим, ніж у стандартного, називаються гіпертонічними
Розчини з меншим осмотичним тиском – гіпотонічними.