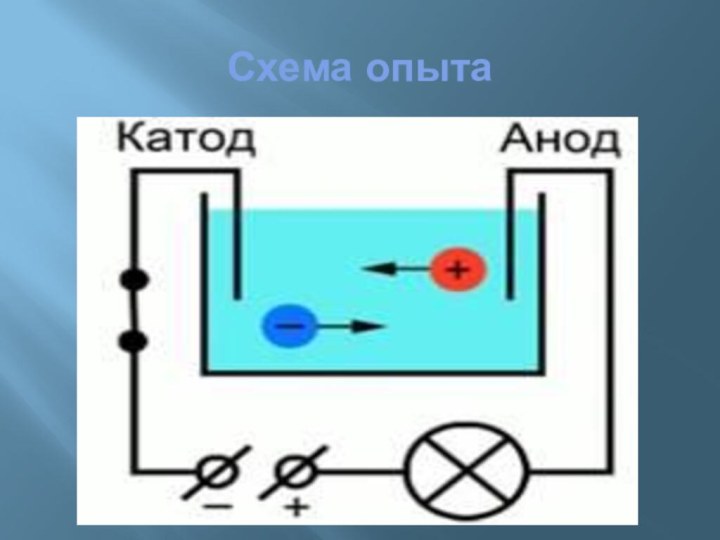
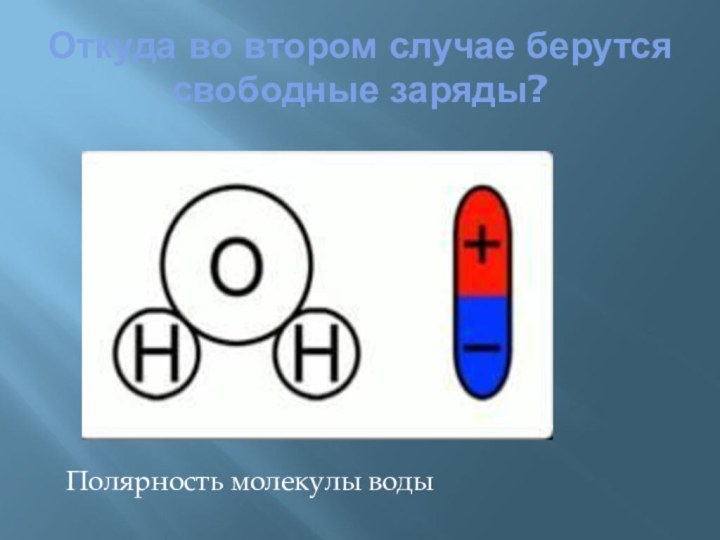
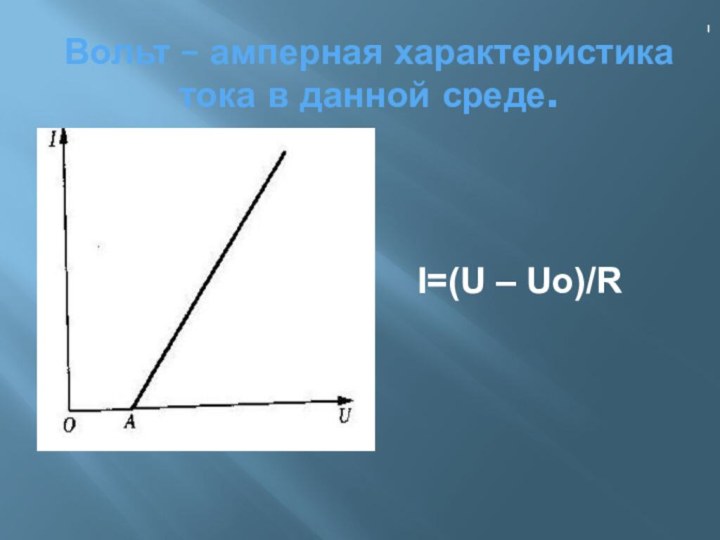
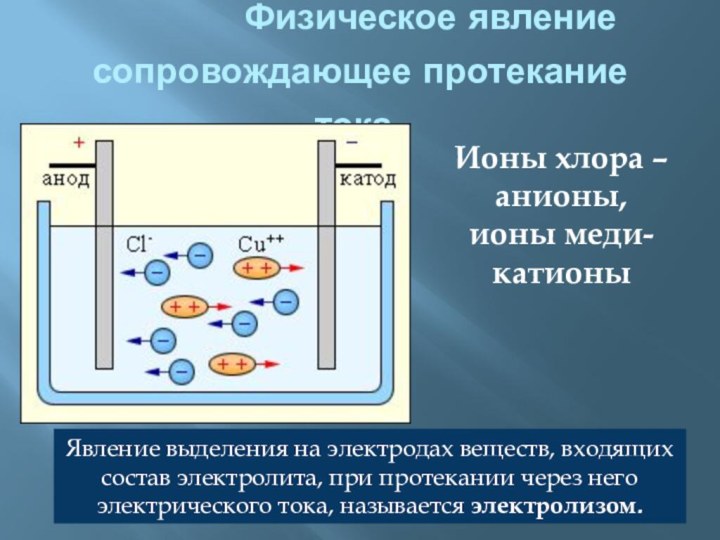
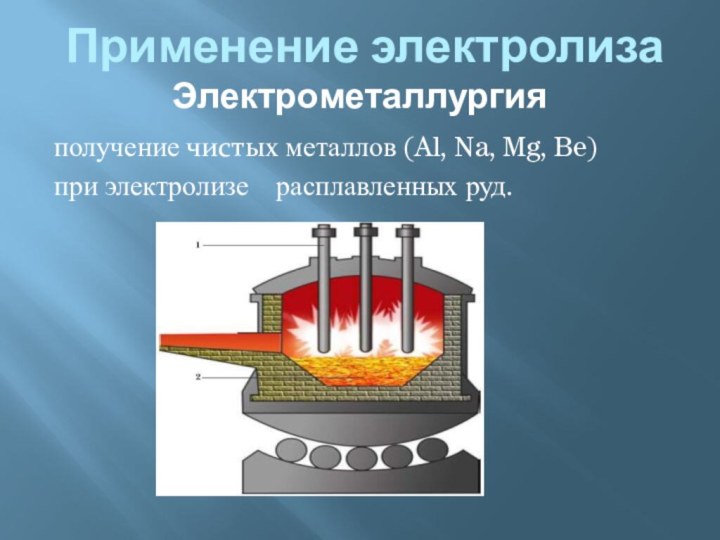
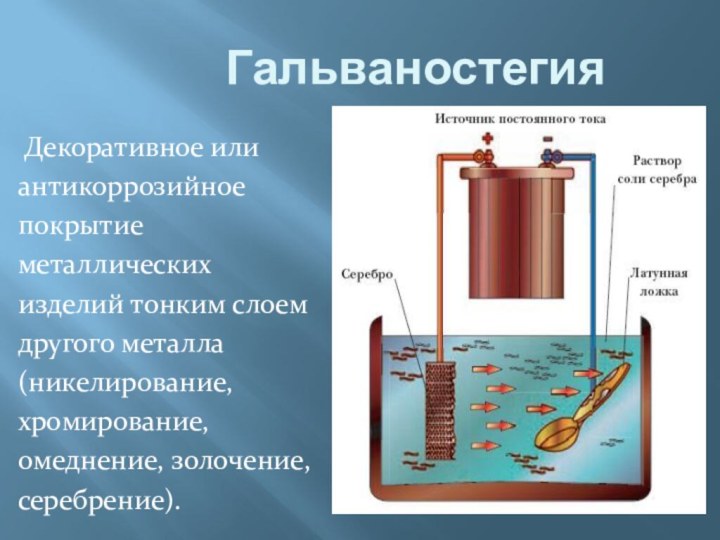
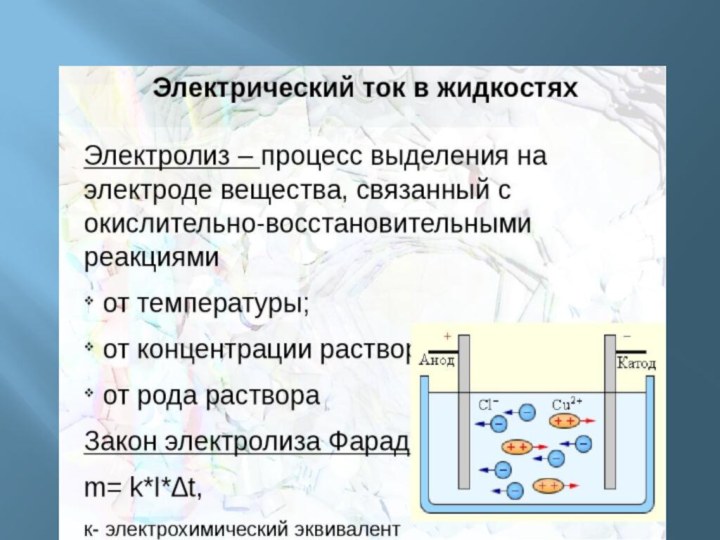
электропроводности делятся на:
диэлектрики (дистиллированная вода)
проводники (электролиты –растворы солей, щелочей
и кислот)полупроводники (расплавленный селен)