- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Атомная физика
Содержание
- 2. Строение атома. Опыты Резерфорда.Атом состоит из атомного
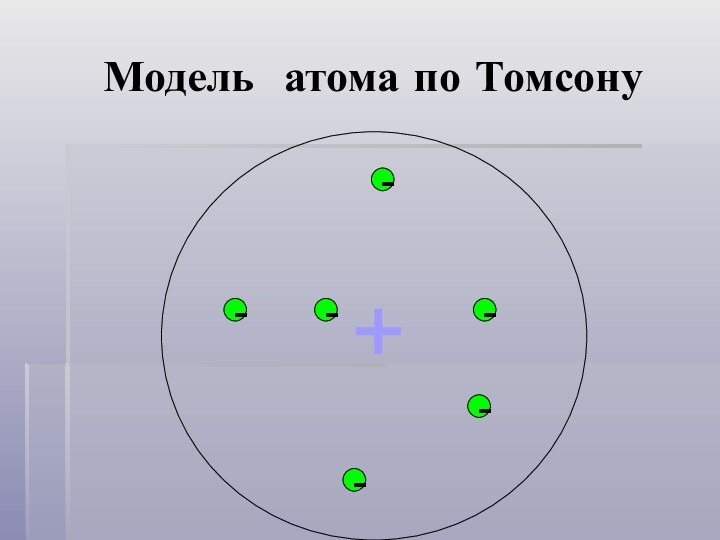
- 3. Модель атома по Томсону------+
- 4. Опыты резерфордаПланетарная модель атома Резерфорда. Атомное ядро
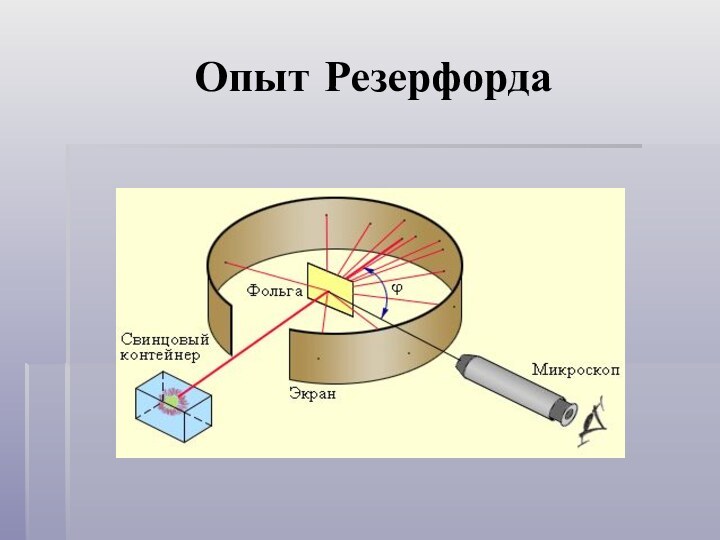
- 5. Опыт Резерфорда
- 6. Опыт Резерфорда++++++++Свинцовый контейнер++Золотая фольга источник α-частицЭКРАН+++++
- 7. Объяснение опыта Резерфорда+++++++++
- 8. Медь-+Протон-Электрон-Нейтрон------Порядковый номер-29Атомная масса- 63,546=64Число протонов-29Число нейтронов-35Число электронов -29Как устроен атом по Резерфорду
- 9. Строение атомовПланетарная модель атомовРезерфорд создал планетарную модель
- 10. Современная модель атома водорода
- 11. Формула связи частиц в атомеЧисло протонов Z
- 12. Квантовые постулаты бора. Модель атома водорода по
- 13. Постулаты БораСледующий шаг в развитии представлений об
- 14. Модель постулаты Бора.
- 15. Скачать презентацию
- 16. Похожие презентации
Строение атома. Опыты Резерфорда.Атом состоит из атомного ядра и электронов. Электрон – это частица, заряд которой отрицателен и равен по модулю элементарному заряду e = 1,6·10–19 Кл, а масса me = 9,1·10–31 кг. Согласно планетарной модели Бора – Резерфорда электроны обращаются вокруг












Слайд 4
Опыты резерфорда
Планетарная модель атома Резерфорда.
Атомное ядро заряжено
положительно. Его диаметр не превышает 10–14–10–15 м, а заряд q
равен произведению элементарного заряда на порядковый номер атома Z: q = Z·e.Явление радиоактивности, а также опыты Резерфорда показали, что атомное ядро состоит из протонов и нейтронов, удерживаемых вместе ядерными силами. Протоны и нейтроны носят общее название нуклонов.
Слайд 8
Медь
-
+
Протон
-
Электрон
-
Нейтрон
-
-
-
-
-
-
Порядковый номер-29
Атомная масса- 63,546=64
Число протонов-29
Число нейтронов-35
Число электронов -29
Как
устроен атом по Резерфорду
Слайд 9
Строение атомов
Планетарная модель атомов
Резерфорд создал планетарную модель атома:
электроны обращаются вокруг ядра, подобно тому как планеты обращаются
вокруг Солнца. Эта модель просто, обоснована экспериментальна, но не позволяет объяснить устойчивость атома
Слайд 11
Формула связи частиц в атоме
Число протонов
Z
P
Число электронов
E e
Порядковый номер
Элемента
№
Атомная массе A
= число протонов Z +Число нейтронов NA = Z + N.
Слайд 12
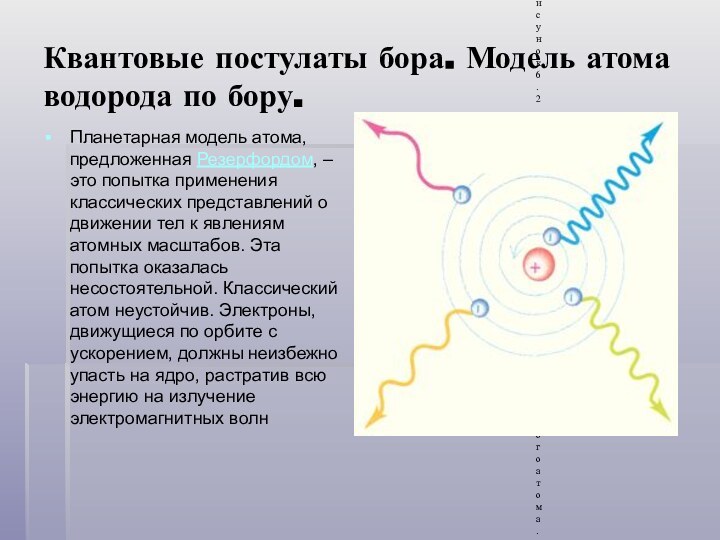
Квантовые постулаты бора. Модель атома водорода по бору.
Планетарная
модель атома, предложенная Резерфордом, – это попытка применения классических
представлений о движении тел к явлениям атомных масштабов. Эта попытка оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн
Слайд 13
Постулаты Бора
Следующий шаг в развитии представлений об устройстве
атома сделал в 1913 году выдающийся датский физик Н. Бор. Проанализировав
всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:hνnm = En – Em,где h – постоянная Планка.