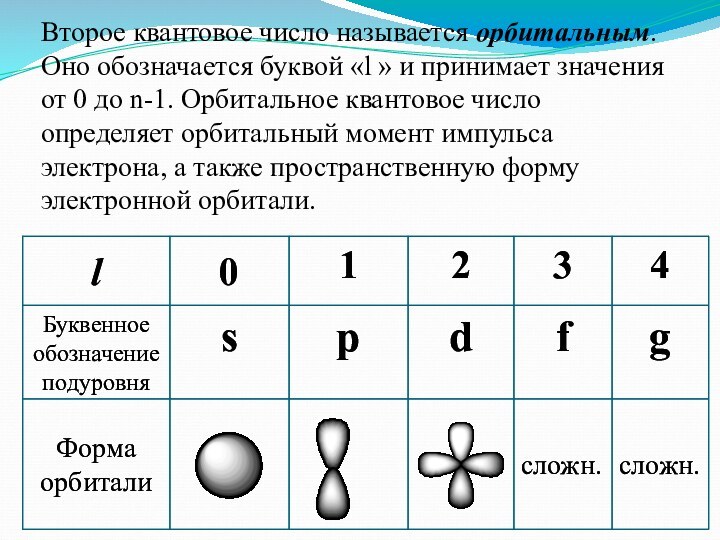
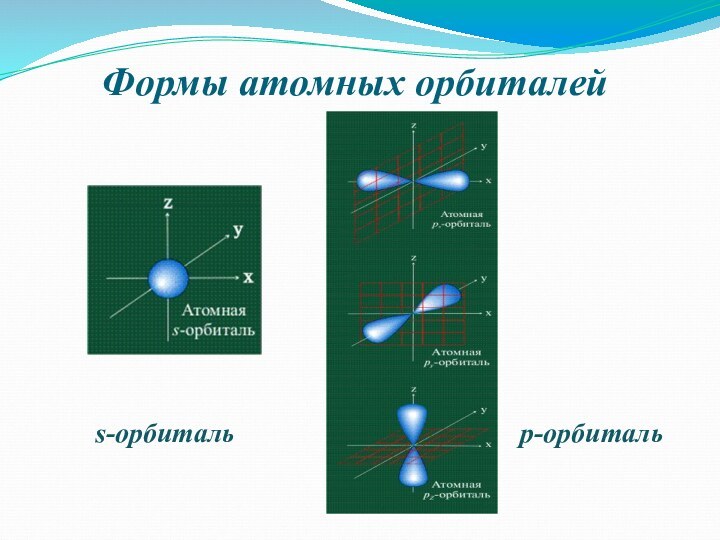
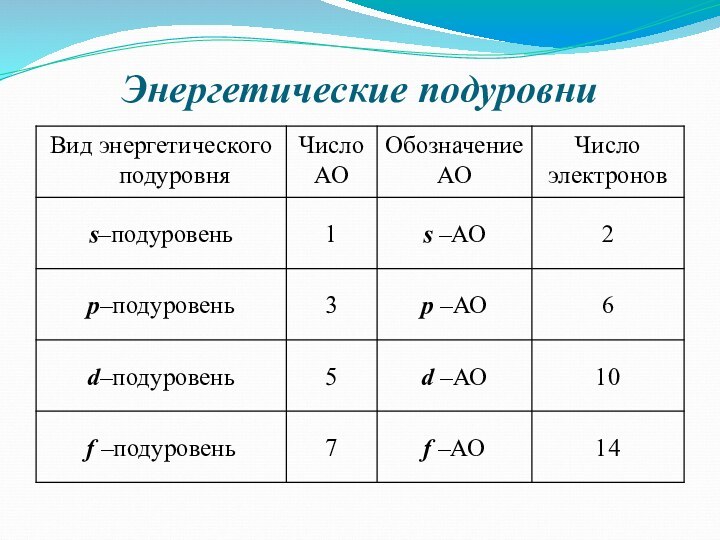
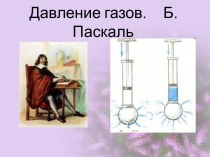
заряд, как частица.
Электрон проявляет волновые свойства –
способен к дифракции.Электрон в атоме можно рассматривать как частицу, которая при движении проявляет волновые свойства. Т.е. нельзя описать движение электрона в атоме определенной траекторией (орбитой).