2006 год
Электрический ток в различных средах
Электрический ток
в жидкостях
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



















Электрический ток
в жидкостях
Не содержащие свободные заряженные частицы (недиссоциирующие)
К ним относятся растворы (чаще всего водные) и расплавы солей, кислот и оснований
К ним относятся дистилированная вода, спирт, минеральное масло…
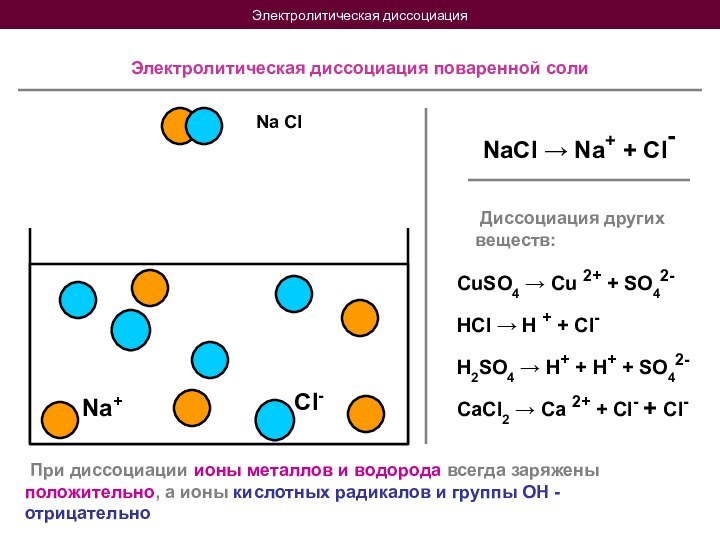
Электролитической диссоциацией называется распад нейтральных молекул вещества в растворителе на положительные и отрицательные ионы
HCl H + + Cl-
H2SO4 H+ + H+ + SO42-
CaCl2 Ca 2+ + Cl- + Cl-
При диссоциации ионы металлов и водорода всегда заряжены положительно, а ионы кислотных радикалов и группы ОН - отрицательно
+ (анод)
- (катод)
+
+
+
-
-
-
+
-
Электрический ток в электролитах представляет собой упорядоченное движение положительных и отрицательных ионов
+
+
- (катод)
Положительные ионы меди, подходя к катоду, получают два недостающих электрона, восстанавливаясь до металлической меди
В процессе протекания тока через электролит на катоде происходит оседание слоя чистой меди – электролиз раствора медного купороса
Cu 2+ + 2 е Cu 0
На катоде:
Cu 2+
Cu 2+
Сульфат - ионы SO42- , подходя к аноду, отдают ему два лишних электрона, которые через источник тока поступают на катод и присоединяются к положительным ионам меди
SO42-
SO42-
Первый закон электролиза
Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна величине заряда, прошедшего через электролит
k – электрохимический эквивалент вещества
(равен массе вещества, выделившегося при прохождении через электролит заряда 1 Кл)
Если учесть, что q = I t, то
M – масса выделившегося вещества k – электрохимический эквивалент М – молярная масса вещества z – валентность вещества
Заряд, необходимый для выделения 1 моля вещества, одинаков для всех электролитов. Он называется числом Фарадея F
Электрохимический эквивалент и число Фарадея связаны соотношением
Как отсюда экспериментально определить заряд электрона?
Борис Семенович Якоби (1801 – 1874) – русский академик, открывший гальванопластику, создавший первую конструкцию электродвигателя
Гальванотехника - это отрасль прикладной электрохимии, смысл которой состоит в получении электролитическим путем металлических копий каких-либо предметов (гальванопластика) или же в нанесении этим же способом металлических покрытий на какие-либо поверхности (гальваностегия). Способ этот в свое время широко использовался в полиграфической промышленности и в определенных случаях применяется и сейчас
CuSO4
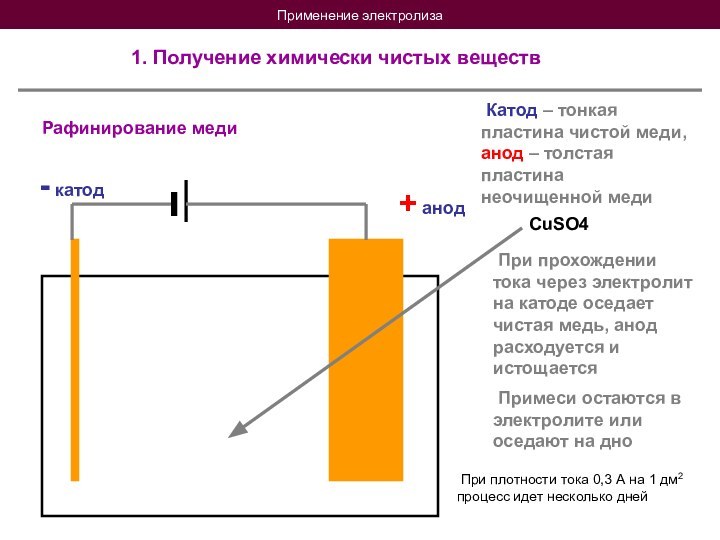
При прохождении тока через электролит на катоде оседает чистая медь, анод расходуется и истощается
Примеси остаются в электролите или оседают на дно
При плотности тока 0,3 А на 1 дм2 процесс идет несколько дней
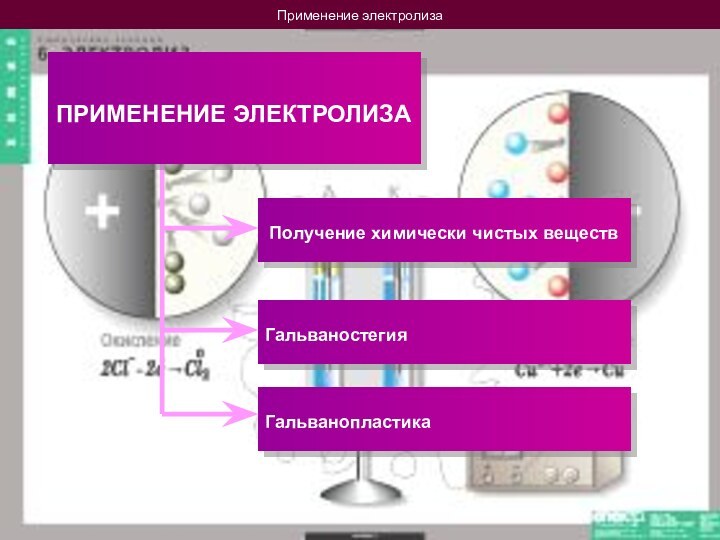
Электролитическим способом получают:
Магний, натрий, калий, кальций …
Соду, хлор, хлористый кальций …
Осуществив, например, электролиз раствора поваренной соли NaCl, мы можем получить сразу 3 полезных химических вещества:
Газообразные водород и хлор, а также раствор едкого натра NaOH
Приведите примеры защитных покрытий в быту и технике
Точность копирования формы предмета очень высокая, т.к. процесс идет на ионном (молекулярном) уровне
Применение:
Получение рельефных копий барельефов, статуй
Изготовление клише, полиграфия
выпуск ценных бумаг, денег
В приложении к презентации – некоторые интересные опыты по электролизу ( с сайта alhimik.ru)