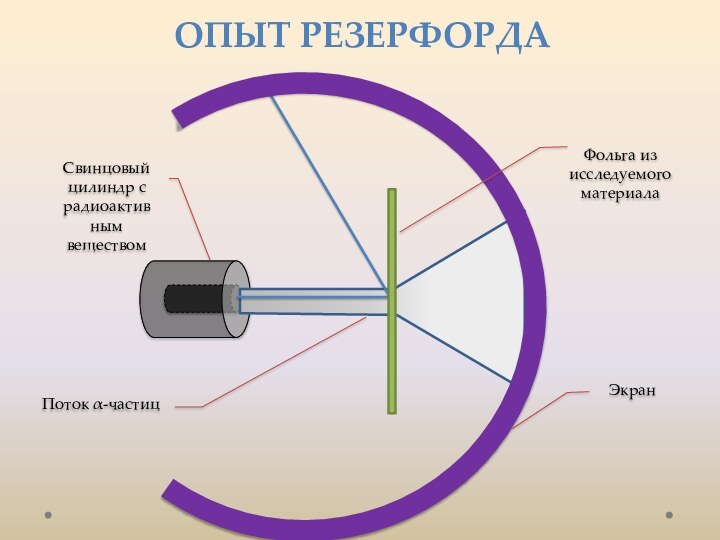
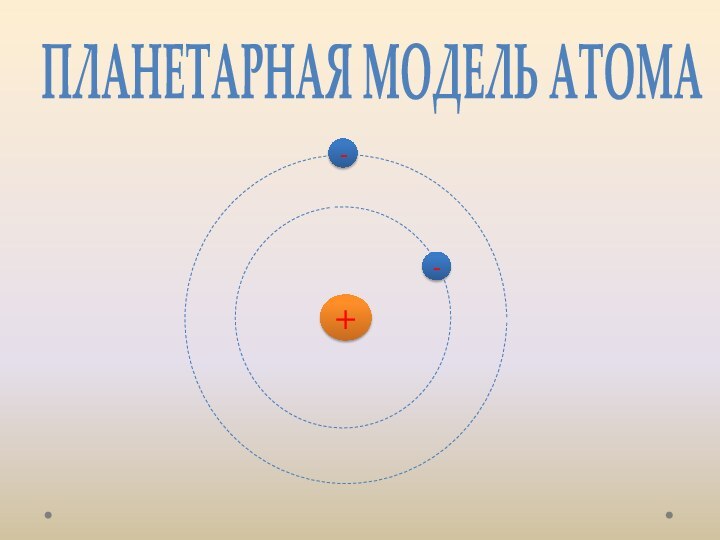
лаборатории, лауреат Нобелевской премии. открыл электрон.
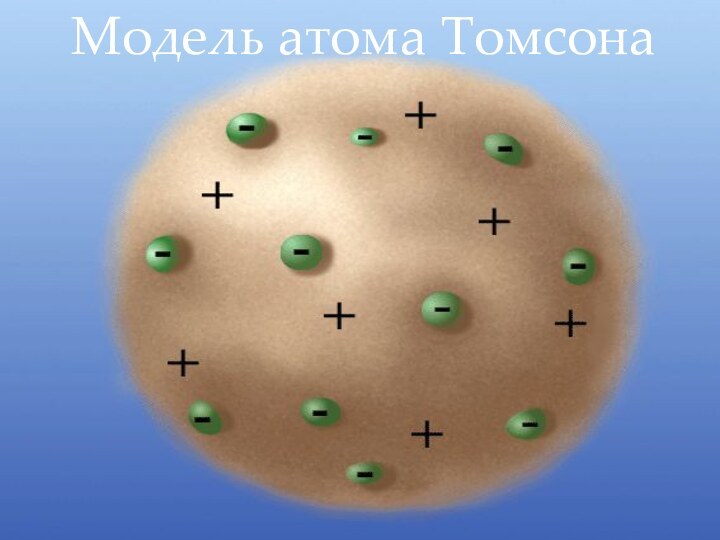
1903г. - Дж.Дж.Томсон
выдвинул гипотезу о том, что электрон находится внутри атома. Но атом в целом нейтральный, поэтому ученый предположил, что отрицательные электроны окружены в атоме положительно заряженным веществом. Атом, по мысли Дж. Томсона, очень похож на "пудинг с изюмом", где "каша" - положительно заряженное вещество атома., а электроны- " изюм" в ней.Дж.Дж.Томсон